基于图论的轻度认知障碍患者功能脑网络研究
2022-07-27何文娟谢琦王雅杰谭智霖廖炎辉
何文娟,谢琦,王雅杰,谭智霖,廖炎辉
轻度认知障碍(mild cognitive impairment,MCI)是正常认知和痴呆之间的一种过渡状态,患者认知功能进行性下降,但没有达到痴呆的诊断标准[1]。65 岁以上的老年人群中有15%~20%患有MCI,其中15%发展为痴呆[2-3],一旦发展为痴呆,将给患者家庭和社会带来极大的负担。有大量证据表明,在MCI期给予生活方式的干预及认知训练可以有效改善患者认知功能,因而MCI期被视为可以被干预和能延缓痴呆进程的“时间窗”[4],因此早期准确诊断MCI 对于延缓痴呆进程非常重要。然而,目前临床上MCI的诊断标准多样,且均主要依赖于临床病史采集和神经心理学评估,但评估过程中受到测评人员对临界值的把握、受试者接受测试时的状态等因素的影响,这种评估方法主观性较强,诊断结果不够稳定,因此,寻找客观、简单的定量评估方法对于MCI的早期准确诊断具有重要意义。
MCI影像生物标志物的研究有望提供一种易量化的、可靠的、客观的评估方式。近年来,静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)发展迅速,它能够揭示人脑内在的自发性活动规律[5],现已广泛应用于MCI影像生物标志物的探索,但既往的研究主要使用局部一致性、低频振幅、功能连接及独立成分分析的方法进行研究,目光聚焦在对局部脑区的研究上,但局部脑区的变化并不能完全解释脑功能的异常,近年来迅猛发展的图论的分析方式为弥补这一缺陷提供了强有力的工具。
图论是一种数学分析工具,它以图为研究对象,图论中的图可以定义为G=(V,E),其中V 是一组有限的节点,E 是一组边[6],根据图论,大脑被模拟成一个带有节点和边的图,每个节点代表一个相对独立的脑区,每条边代表两个脑区之间的功能连接[7]。应用图论及rs-fMRI 探索MCI 影像生物标志物尚处于起步阶段,相关研究较少,且结论多不一致[8]。在此背景下,本研究拟采用rs-fMRI 对MCI 患者的功能脑网络进行研究,并采用图论的方法分析其全局属性及节点属性的变化规律,以期寻找MCI的影像生物标志物,为MCI的早期准确诊断提供科学依据。
1 材料与方法
1.1 一般资料
本研究为前瞻性研究,并已取得广州市第一人民医院伦理委员会批准(批准文号:K-2019-166-01)。研究者通过在体检中心派发传单及微信公众号推广招募志愿者,所有受试者都已签署知情同意书。
MCI 组:自2018 年8 月至2021 年6 月共招募MCI患者28 例。纳入标准:(1)符合Bondi 等制订的MCI诊断标准[9];(2)年龄≥60 岁,性别不限;(3)受教育年限≥7年;(4)受试者视力、听力及精神状态良好;(5)没有明显的行为和语言障碍;(6)受试者知情同意,且自愿参加研究。排除标准:(1)受试者为左利手或双利手;(2)曾经发生过脑创伤、脑肿瘤、脑梗死、脑出血、帕金森病或其他神经系统疾病;(3)存在磁共振扫描禁忌证;(4)磁共振图像质量不达标者;(5)不能配合完成神经心理学量表评估者。
正常对照组(normal control,NC):招募15 名健康志愿者为对照组。纳入标准:(1)年龄≥60岁,性别不限;(2)日常生活能力正常,无自我主观的认知下降;(3)认知功能正常;(4)没有明显的行为和语言障碍;(5)右利手。
1.2 认知功能评估
由经过训练的2名研究人员对所有受试者进行整体认知状态评估,使用的量表包括:蒙特利尔认知评估基础量表(Montreal Cognitive Assessement Basic,MoCA-B)、华山版听觉词汇记忆测试量表(Audirory Verbal Learning Test-Huashan version,AVLT-H)、连线测试量表(Shape Trails Test,STT)、动物词语流畅性测试量表(Animal Fluency Test,AFT)及Boston 命名试验量表(Boston Naming Test,BNT)。
1.3 MRI检查方法
采用德国Siemens MAGNETOM Skyra 3.0 T MRI扫描仪及32 通道头颅线圈进行扫描,扫描时受试者保持平卧,头部固定以减少头部运动,并佩戴3M降噪耳塞,全程保持静止、闭眼的清醒状态。对所有受试者均采集T1_MPRAGE (magnetization-prepared rapid acquisition gradient echo sequence)及rs-fMRI序列。
1.3.1 T1_MPRAGE序列
TR 2530 ms,TE 2.96 ms,TI 1100 ms,FOV 256 mm×256 mm,矩阵256×256,激励次数1,翻转角7°,带宽240 Hz/Pz,层数192,层厚1 mm,层间距0.5 mm,体素大小1.0 mm×1.0 mm×1.0 mm,序列扫描时间共4 min 30 s。
1.3.2 rs-fMRI序列
采集静息态血氧水平依赖(blood oxygenation level dependent,BOLD)序列,扫描参数为TR 2000 ms,TE 30 ms,FOV 224 mm×224 mm,矩阵64×64,层数32,翻转角90°,层厚3.5 mm,层间距1 mm,体素大小3.5 mm×3.5 mm×3.5 mm,序列扫描时间共8 min。
1.4 数据处理方法
1.4.1 数据预处理过程
使用GRETNA (Graph Theoretical Network Analysis)2.0 (https://www.nitrc.org/projects/gretna)软件对rs-fMRI数据进行预处理,预处理过程包括:(1)将原始DICOM数据文件转换成NIfTI格式;(2)去除前10个时间点图像;(3)时间层校正;(4)头动校正;(5)空间标准化;(6)空间平滑:全宽半高核用6 mm进行平滑;(7)去线性漂移;(8)回归协变量:回归掉全脑信号、脑脊液信号及脑白质信号;(9)时间带通滤波(0.01~0.08 Hz):过滤高频、超低频的噪声信号。
1.4.2 构建功能连接矩阵
使用GRETNA 2.0软件构建脑功能连接矩阵。首先,使用自动解剖标记(automated anatomical labeling,AAL)图谱将受试者的大脑及小脑分成116个脑区,获取每个脑区的平均时间序列,计算116 个脑区之间的Pearson相关系数,再对这些相关系数进行Fisher_Z变换,从而得到一个对称的116×116相关系数矩阵。
1.4.3 大脑功能网络分析
使用GRETNA 2.0软件构建大脑功能网络,选定网络稀疏度阈值的取值范围为0.05~0.40,以0.01为步长,以保障网络同时具有小世界属性和稀疏特性,分别计算MCI组与NC组在该范围内所有36个阈值点的大脑网络拓扑属性:聚类系数(clustering coefficient,Cp)、特征路径长度(the shortest path length,Lp)、全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)、节点聚类系数(nodular clustering coefficient,NCp)、节点局部效率(nodular local efficiency,NEloc)。将计算得到的有差异的脑区用BrainNet Viewer (https://www.nitrc.org/projects/bnv)软件进行可视化。
1.5 统计学分析
采用SPSS 22.0软件进行统计分析。连续变量符合正态分布以±s表示,采用两独立样本t检验比较MCI组与NC组间年龄、受教育年限的差异,使用χ2检验比较两组间性别构成,P<0.05为差异具有统计学意义。分析两组间全局拓扑属性差异时,使用每个拓扑属性的曲线下面积(area under the curve,AUC)值,AUC值可以提供脑网络拓扑属性的总的标量,而不依赖于单个阈值的选择[10],然后使用GRETNA软件对MCI组与NC组的全局拓扑属性进行两独立样本t检验,选取网络稀疏度阈值为0.2时,对2组间NCp及NEloc进行两独立样本t检验,并采用Bonferroni校正对结果进行多重比较校正,校正后P<0.05为差异具有统计学意义。
2 结果
2.1 人口学资料分析
MCI组与NC组在性别、年龄及受教育年限方面差异均无统计学意义(P>0.05),见表1。

表1 两组的人口学资料Tab.1 Demographic data of two groups
2.2 全局拓扑属性分析
与NC 组相比:(1) MCI 组的Cp及Eloc降低,且差异具有统计学意义(P<0.05);(2) MCI组的Lp降低,差异无统计学意义(P>0.05);(3) MCI 组的Eglob升高,差异无统计学意义(P>0.05)。见表2、图1。

图1 不同网络稀疏度阈值下MCI组与NC组的全局拓扑属性对比。注:MCI组:轻度认知障碍组;NC组:正常对照组。Fig.1 Comparison of global topological properties between MCI and NC under different network sparsity thresholds.Note:MCI:mild cognitive impairment;NC:normal control.
表2 MCI组与NC组全局拓扑属性比较(±s)Tab.2 Comparison of global topological properties between MCI and NC groups(±s)
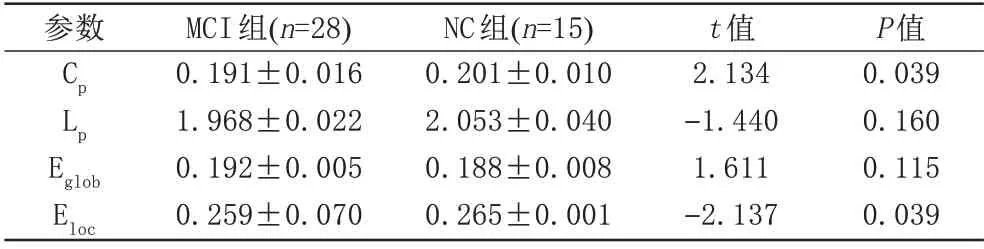
表2 MCI组与NC组全局拓扑属性比较(±s)Tab.2 Comparison of global topological properties between MCI and NC groups(±s)
注:MCI组:轻度认知障碍组;NC组:正常对照组;Cp:聚类系数;Lp:特征路径长度;Eglob:全局效率;Eloc:局部效率;P<0.05表示差异有统计学意义。
P值0.039 0.160 0.115 0.039参数Cp Lp Eglob Eloc MCI组(n=28)0.191±0.016 1.968±0.022 0.192±0.005 0.259±0.070 NC组(n=15)0.201±0.010 2.053±0.040 0.188±0.008 0.265±0.001 t值2.134-1.440 1.611-2.137
2.3 节点网络属性分析
2.3.1 节点聚类系数
选取网络稀疏度阈值为0.2计算MC组及NC组的NCp。与NC 组相比,MCI 组的NCp在直回(L,R)、杏仁核(R)、距状裂周围皮层(L,R)、楔叶(L,R)、枕上回(L,R)、枕中回(L)、颞上回(R)明显降低,差异具有统计学意义(P<0.05)。见表3、图2。
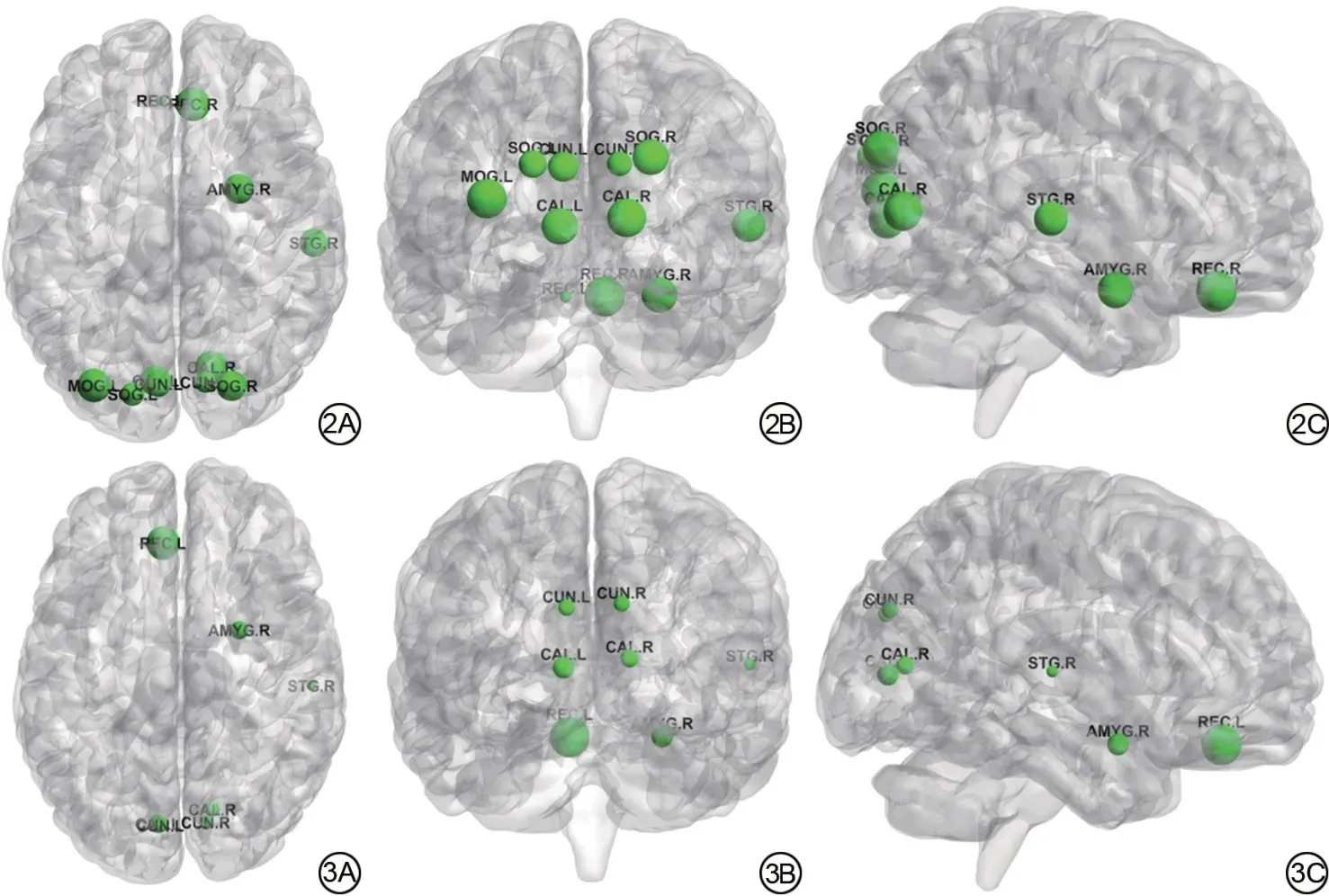
图2 MCI 组与NC 组节点聚类系数比较,绿色小球表示MCI 组较NC 组节点聚类系数减低的脑区,绿色小球体积越大,表示减低越明显。2A:轴位;2B:冠状位;2C:矢状位。注:REC:直回;AMYG:杏仁核;CAL:距状裂周围皮层;CUN:楔叶;SOG:枕上回;MOG:枕中回;STG:颞上回;L:左;R:右;MCI 组:轻度认知障碍组;NC 组:正常对照组。 图3 MCI组与NC组节点局部效率比较,绿色小球表示MCI组较NC组节点聚类系数减低的脑区,绿色小球体积越大,表示减低越明显。3A:轴位;3B:冠状位;3C:矢状位。注:REC:直回;AMYG:杏仁核;CAL:距状裂周围皮层;CUN:楔叶;STG:颞上回;L:左;R:右;MCI 组:轻度认知障碍组;NC组:正常对照组。Fig. 2Comparison of node clustering coefficient between MCI and NC groups.The green balls indicate the brain areas where the nodular clustering coefficient of the MCI group are lower than the NC group, the larger the ball, the more obvious the reduction. 2A:axial; 2B: coronal; 2C: sagittal. Note: REC:rectus gyrus; AMYG: amygdala; CAL:calcarine fissure and surrounding cortex;CUN:cuneiform; SOG: superior occipital gyrus; MOG: middle occipital gyrus; STG: superior temporal gyrus; L: left; R: right; MCI: mild cognitive impairment; NC:normal control. Fig. 3 Comparison of nodular local efficiency between MCI and NC groups.The green balls indicate the brain areas where the nodular clustering coefficient of the MCI group are lower than the NC group,the larger the ball,the more obvious the reduction.3A:axial;3B:coronal;3C:sagittal.Note:REC:rectus gyrus; AMYG: amygdala; CAL: calcarine fissure and surrounding cortex; CUN: cuneiform; STG: superior temporal gyrus; L: left; R: right; MCI: mild cognitive impairment group;NC:normal control.
表3 MCI组与NC组节点聚类系数比较(±s)Tab.3 Comparison of nodular clustering coefficients between MCI and NC groups(±s)

表3 MCI组与NC组节点聚类系数比较(±s)Tab.3 Comparison of nodular clustering coefficients between MCI and NC groups(±s)
注:MCI 组:轻度认知障碍组;NC 组:正常对照组;P<0.05 为差异有统计学意义。
P值0.002 0.039 0.026 0.029 0.034 0.016 0.009 0.013 0.027 0.037 0.021脑区名称直回(L)直回(R)杏仁核(R)距状裂周围皮层(L)距状裂周围皮层(R)楔叶(L)楔叶(R)枕上回(L)枕上回(R)枕中回(L)颞上回(R)MCI组(n=28)0.566±0.092 0.558±0.101 0.528±0.103 0.628±0.119 0.640±0.130 0.607±0.127 0.616±0.139 0.569±0.139 0.574±0.156 0.562±0.133 0.543±0.086 NC组(n=15)0.662±0.093 0.628±0.104 0.605±0.104 0.720±0.141 0.732±0.133 0.700±0.085 0.726±0.097 0.677±0.104 0.678±0.107 0.662±0.166 0.611±0.092 t值-3.241-2.131-2.312-2.267-2.187-2.524-2.734-2.608-2.298-2.157-2.391
2.3.2 节点局部效率
当网络稀疏度阈值为0.2 时,与NC 组相比,MCI组的NEloc在直回(L)、杏仁核(R)、距状裂周围皮层(L,R)、楔叶(L,R)、颞上回(R)明显降低,差异具有统计学意义(P<0.05)。见表4、图3。
表4 MCI组与NC组节点局部效率比较(±s)Tab.4 Comparison of nodular local efficiency between MCI and NC groups(±s)

表4 MCI组与NC组节点局部效率比较(±s)Tab.4 Comparison of nodular local efficiency between MCI and NC groups(±s)
注:MCI 组:轻度认知障碍组;NC 组:正常对照组;P<0.05 为差异有统计学意义。
P值0.003 0.020 0.020 0.028 0.032 0.033 0.049脑区名称直回(L)杏仁核(R)距状裂周围皮层(L)距状裂周围皮层(R)楔叶(L)楔叶(R)颞上回(R)MCI组(n=28)0.773±0.055 0.808±0.058 0.812±0.074 0.797±0.068 0.792±0.113 0.792±0.060 0.747±0.068 NC组(n=15)0.802±0.067 0.857±0.073 0.864±0.068 0.842±0.050 0.860±0.053 0.805±0.082 0.776±0.072 t值-3.131-2.416-2.414-2.273-2.215-2.202-2.028
3 讨论
本研究通过rs-fMRI 及图论的方法探索MCI 患者的功能脑网络全局及节点拓扑属性变化,并探索功能脑网络的变化如何影响认知功能。既往有少量研究采用图论的方式对MCI 患者的功能脑网络拓扑属性进行了研究,但得出的结论不一致。我们的研究结果显示MCI 患者的大脑功能网络的拓扑结构遭到破坏:首先,MCI组的全局拓扑属性Cp及Eloc较NC组降低,且主要影响视觉及听觉功能相关的脑区;其次,MCI 组的Lp具有降低的趋势,Eglob具有升高的趋势。本研究是既往采用图论对MCI 影像生物标志物进行研究的重要补充。
3.1 MCI患者全局拓扑属性变化及其神经机制
本研究结果显示随着网络稀疏度阈值的增加,MCI 组与NC 组的Cp及Eloc均升高,进一步比较显示,MCI 组的Cp及Eloc较NC 组降低。虽然Lp及Eglob在MCI组与NC 组之间的差异没有统计学意义,但与NC 组相比,MCI 组的Lp具有下降的趋势,Eglob具有上升的趋势。Cp为节点趋向聚类的程度[11],Eloc为由节点及其相邻节点组成的子网络中最短平均路径长度的倒数[12],Lp为网络中所有节点对之间最短路径长度的平均值[13],Eglob为所有节点对之间特征路径长度平均值的倒数[14]。Cp和Eloc均反映功能脑网络的局部信息处理能力,也在一定程度上反映网络防御随机攻击的能力,Cp及Eloc越高,表示脑网络的局部信息处理能力越强,网络防御攻击的能力越强;而Lp和Eglob反映脑网络的全局水平信息整合能力,Lp越短、Eglob越高,脑网络全局信息整合能力越强[15]。因此,推测MCI 患者的邻近脑区之间短连接中断,长距离脑区之间的长连接有增加的趋势,脑网络局部专业化和全局一体化之间的平衡受到干扰,从而导致脑网络分离功能减弱,整合能力代偿性有所增加。在既往的研究中也讨论过MCI患者全局拓扑属性改变,但是得出来的结论有差异。Yao等[16]发现Lp在MCI组与NC组之间差异无统计学意义,而Son 等[17]发现MCI 组的Lp较NC 组显著降低,近年来Zhang 等[18]研究显示MCI 组的Lp显著缩短,Eglob提高,Xu 等[19]发现MCI 组的Cp较NC 组增高,Xue 等[20]发现与NC 组相比,遗忘型MCI 组的Lp升高,Eglob显著降低。多个研究得出的结论不一致的原因可能是:首先,由于MCI的异质性,临床有多种病因可导致MCI,不同的病因导致的病理生理改变不一样,从而导致网络拓扑结构改变不一样;其次,可能是因为受试者的MCI 类型不一样,有的选取遗忘型MCI 进行研究[20],有的没有对MCI患者进行分型[18];最后,有可能是因为所采用的研究手段不一样,有的采用rs-fMRI进行研究[19-20],有的采用正电子发射体层成像(positron emission tomography,PET)进行研究[17]。我们的研究结论与既往以健康老年人为研究对象的研究结果相一致,与年轻人相比,老年人的Cp及Eloc显著降低,体现了神经退行性变的拓扑属性变化[21]。MCI 大部分是由神经退行性疾病所导致的,我们的研究结果符合神经退行性变的发展规律,为MCI患者认知障碍提供了神经生物学解释。
3.2 MCI患者节点拓扑属性变化及其相应脑区
本研究显示与NC 组相比,MCI 组的NCp显著降低的脑区位于直回(右)、杏仁核(右)、距状裂周围皮层(左、右)、楔叶(左、右)、枕上回(左、右)、枕中回(左)、颞上回(右),MCI 组的NEloc显著降低的脑区位于直回(左)、杏仁核(右)、距状裂周围皮层(左、右)、楔叶(左、右)、颞上回(右)。以上脑区主要包含了视觉初级皮层及听觉中枢,与视觉及听觉功能高度相关[22]。因此,推测MCI患者视觉功能网络和听觉功能网络内部的短连接减少可能是MCI 患者认知功能障碍的神经机制之一。这与既往关于视觉网络与认知功能障碍相关的研究相一致,既往有研究显示多发性硬化患者视觉功能障碍是由枕叶内功能连通性减弱引起的,且与认知功能障碍之间存在直接或间接的关系[23]。
本研究具有一定的局限性。首先,本研究样本量较小,统计分析可能会有一定的偏倚,下一步将扩大样本量来验证我们研究结果的可重复性;其次,本研究未对青年及中年MCI患者的拓扑属性进行研究,今后将对青中年MCI 患者进行相关研究;最后,本研究未做独立的视觉功能相关量表评估,以后将加入相关量表评估并分析其与认知功能的相关性。
综上所述,通过rs-fMRI与基于图论的复杂网络分析方法对MCI患者的全局及节点拓扑属性的分析,笔者认为MCI患者的局部信息处理能力遭到破坏,且主要影响视觉及听觉相关的脑区。研究结果表明Cp及Eloc降低可能成为潜在的MCI 影像生物标志物,为MCI的早期准确诊断提供科学依据。
作者利益冲突声明:全部作者均声明无利益冲突。