基于3D体素增强和3D alpha背景分离的多发性硬化症病灶分割方法
2022-07-26孙颖张吟龙王鑫曾子铭毛海霞
孙颖,张吟龙,王鑫,曾子铭,毛海霞
1.中国医科大学附属第一医院重症医学科,辽宁 沈阳 110001;2.中国科学院沈阳自动化研究所,辽宁 沈阳 110016;3.沈阳建筑大学信息与控制工程学院,辽宁 沈阳 110168;4.深圳职业技术学院汽车与交通学院,广东 深圳 518055
前言
多发性硬化症(Multiple sclerosis,MS)是一种中枢神经系统的炎症性脱髓鞘疾病,会导致脑部组织架构发生变化,出现肢体无力、感觉异常及眼部不适等 症状[1-4]。磁共振(Magnetic Resonance Imaging,MRI)图像一直被认为是MS 最有价值的临床检查方法[5],常规病灶的MRI能够在T2加权像中呈现高信号,而在T1加权像中呈现低信号。目前,国内外学者们已提出一些基于MRI的半自动和自动MS 病灶分割方法。例如,Zeng 等[6]提出了一种针对MS 病变的二维关节直方图模型,用于处理正常组织和异常组织之间的密度重叠,检测出MRI异常组织中病灶的位置。Geremia等[7]采用空间决策森林来分割感兴趣区域,并利用多通道完成对MRI的准确处理。Brosch等[8]提出一种基于快连接深度卷积编码网络的分割网络,该网络由两个相关联的通路组成,分别用来学习和预测,并通过特征提取和预测对不同大小范围的病灶进行精确分割。Ghribi 等[9]提出基于数据库的高斯混合模型脑区分割算法,首先对MRI进行估计,再经过阈值约束,并利用病变扩展算法进行细化处理,最终完成分割。然而,鉴于临床MRI中存在不确定噪声、密度不均、部分体素效应等影响因素,导致现有方法针对MS 病灶的位置、大小和形状等特征信息的检测效果并不显著[10-13]。
3D 技术作为一种虚拟现实、实时仿真和交互三维设计结合产生的关键技术,能够将图像的纵深、层次、位置等诸多信息展现给观察者[14-15]。在临床上,3D 技术可以提供多层面视图[16-17],以便于医生观察病灶的结构、形态及其跟周围组织的关系,为病情做出合理的诊断。因此,本文提出了一种基于3D 体素增强和3D alpha 背景分离技术的MS 病灶分割方法,通过体素融合来增强3D图像,使图像特征更易提取。消除部分假阳性目标区域(Volume of Interest,VOI)来检测出潜在的MS 病变,并使用3D alpha 背景分离细化分割MS 病变的三元图结果,提高分割速度的同时也确保了对MS病变组织的准确分割。
1 实验方法
本研究在CHB(Cascaded H-bridge)MRI图像数据集上进行实验[18]。对于每种情况,可以使用由T1加权像、T2加权像和Flair MRI图像配准的体像素生成的3 种不同MR 模态。每个模态包含512 个切片,体素尺寸为0.5 mm3。在预处理阶段,采用互信息的方法配准T1加权像、T2加权像和Flair MRI图像[19]。然后,由专家从图集中选择具有MS 病灶的单个原始图像。本方法的处理过程如图1所示,首先,利用分割结果驱动的增强函数对融合体素中的MS 病灶进行增强。其次,去除假阳性VOI,得到白质(White Matter,WM)中潜在的MS 病灶图像。最后,将WM中的病变组织细分为3 张图像(前景、背景、未知区域),并使用3D背景分离获得准确的最终分割结果。
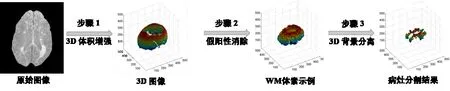
图1 算法处理流程图Figure 1 Flowchart of algorithm processing
1.1 3D体素增强
由于MS 病灶在T2加权像和Flair MRI图像中较其他组织表现为高信号,且Flair MRI图像较T2加权像能更好地区分MS 病灶与脑脊液(Cerebro Spinal Fluid,CSF)的密度。因此,本文采用不同权重((1 2)T2+ Flair)融合T2加权像和Flair MRI图像的体素以增强MS 病灶密度,然后将融合体素的灰度值从0 归一化到255。考虑到所提出算法的计算速度,由专家挑选具有MS 病变的单张切片作为基准,用于增强整个MRI体素。首先使用BET 工具去除单张切片的非脑组织[20]。然后使用Hidden Markov Random Field-Expectation Maximization(HMRF-EM)方法将脑组织分为CSF、WM、灰质(Gray Matter,GM)和背景(Back Ground,BG)[21]。最后将WM 和GM 的群中心定义为CWM和CGM。通过使用增强函数E(x)来增强此切片中的MS病灶,该函数定义为:
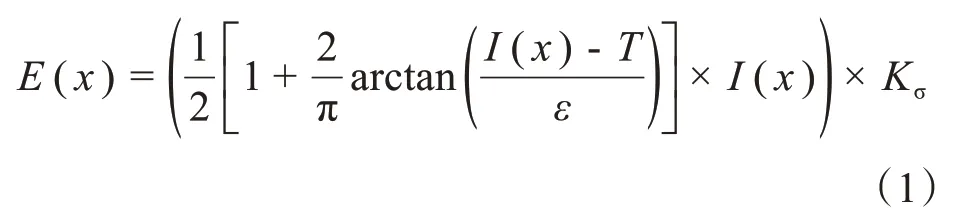
其中,I表示单个MR图像/体素,Kσ是一个高斯核,σ是一个常数,T定义为每次迭代时,增强切片将被分割,并利用新的群中心来估计新的参数T。在每次迭代中,通过分割增强切片来驱动的增强函数会影响整个融合体素,利用逐级增强切片估计的互信息作为迭代停止准则。最后,在增强的3D体素中使用较小的阈值来获得MS病灶的二元VOI。
1.2 假阳性消除
在传统的研究中,一些假阳性的VOI,如头骨、GM 和脑室之间的区域,也由于高强度和密度不均匀而增强,本方法将不计算这些假阳性的VOI,以提高算法效率。首先,我们使用大脑对称平面进行逻辑处理,并使用在前面步骤中3D增强的VOI。然后,通过丢弃与对称平面相连的标签,去除颅骨和脑室之间的VOI。其次,由于95%的MS 病变发生在WM 组织中[22],因此本文仅考虑WM 中包含的MS病变。但大多数传统方法在分割WM 之前需逐片删除颅骨切片[23],浪费了大量时间且无法考虑整个体素信息,并且WM 与其他组织之间的密度重叠可能导致WM 分割结果中出现假阳性。
为此,本文采用一种新颖的颜色分割方案用于分割WM。利用T1加权像、T2加权像和Flair MR体素生成彩色MR 体素。每个R、G、B通道分别对应于T1加权像、T2加权像和Flair MRI图像。与其他MRI模式相比,T1加权像可以更好地区分解剖型脑组织,并选择T1加权像MRI体素的中间切片。然后去除非脑组织,并使用HMRF-EM方法将选取的无颅骨脑组织分割成4 组[24],分别代表CSF,WM,GM 和BG。将WM 组作为掩模,利用形态学对WM 掩模进行腐蚀,以减少由于分割错误导致的WM 中的假阳性。然后利用已腐蚀的掩模区域作为新掩模,以提取彩色MR体素中同一张切片相应的像素,并计算每个颜色通道中的平均值Rμ,Gμ和Bμ。对于每个彩色像素I(Ri,Gi,Bi),可以计算出像素与平均颜色值之间的距离ΔEi为:
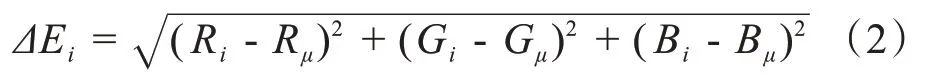
距离阈值公式如(3)所示:

其中,mean()和std()分别表示平均值和标准偏差值。随后,在相应区域中使用红绿蓝3原色来估计所有其他相似的颜色区域。所获取的值(Rμ,Gμ,Bμ)用于计算整个体素中其他体素的ΔEi。如果ΔEi≤Ttolerance,体素将被分割为WM。最后,本文利用颜色分割方案去除在WM体素之外的所有VOI。
1.3 细化分割结果
病灶分割以及消除假阳性的另一个巨大挑战是VOI的不确定性边界,这可能是由于部分体素效应和图像分辨率的限制所致,也可能是由于前景组织(肿瘤)和背景组织(正常组织)的混合物引起的。为了从其他组织中提取MS 病变,我们在分割步骤中引入3D alpha 背景分离[25]。对于这些体素,alpha 背景分离不需要生成0 和1 的分割标签,而是生成0 到1 之间的alpha 值,这种方法可看作更精确的软分割。本文使用彩色MR 体素来细化分割结果。对于每个颜色体素i,它都是前景(F)和背景(B)的凸组合,可以将其建模为:

其中,α是透明度参数,c表示T1加权像、T2加权像和Flair MRI图像的RGB 颜色通道。3D alpha 背景分离获得包含N个体素的输入图像的局部颜色属性,其中元素(i,j)定义为:
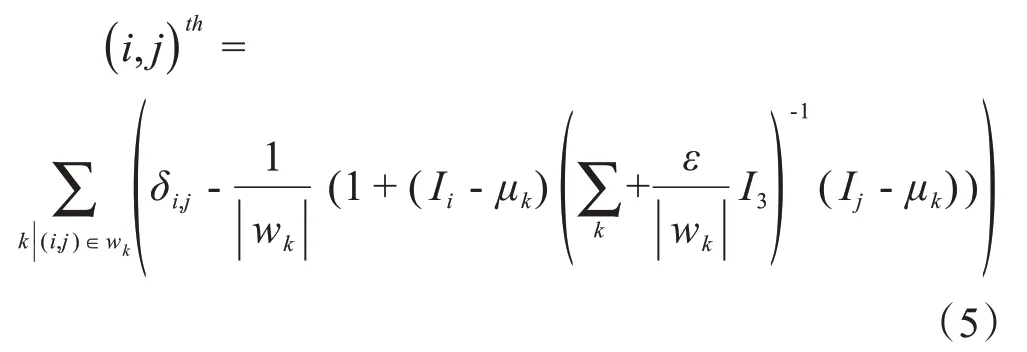
其中,δi,j是克罗内克函数,μk是窗口wk中关于k的颜色矢量的均值,|wk|是3D 窗口中的像素数。如果在计算整个体素时,拉普拉斯矩阵L的尺寸过大,则会导致大量的计算。因此,该亚体素被用来分割MS 病灶而不是分割整个体素。在分割之前,首先必须生成MS 病灶的三元图,将图像分为3 区域,如图2步骤三所示:确定前景F(以彩色显示),确定背景B(在粉红色矩形内显示,但不包括其他颜色)和未知区域U(以彩色显示,但不包括前景)。具体来说,本文使用三维形态学对先前的分割结果进行球状结构腐蚀得到前景图像,然后对3D VOI进行扩张并计算其最大边界框。采用没有前景的矩形区域作为背景。未知区域可以通过逻辑处理、前景以及扩张的VOI生成。
2 实验结果与分析
2.1 MS病灶分割实验
本方法分割CHB 数据集图像的实验过程如图2所示,共包括3 部分:3D 体素增强、假阳性消除和3D alpha背景分离,具体过程如下。
步骤一:3D 体素增强。使用(1/2)T2+ Flair 融合T2加权像和Flair MRI图像的体素。然后,由专家选取在MR 体素中存在MS 病变的切片,去除非大脑区域(图2a)。随后,使用HMRF-EM 分割脑组织(图2b)。根据分割结果,将式(1)中的参数T估计为0.8。然后对3D 体素和切片进行增强(图2c、d)。在式(1)中,参数ε= 10,σ= 7。在第二次迭代中,再次对增强后的图像进行分割(图2e)。图2f 是第二次迭代中增强的体素和片段。随着迭代次数的增加,本文在连续的迭代中计算增强切片的互信息,且将阈值δ=0.9 用作停止标准。在这种情况下,在第五次迭代中停止3D 体素增强的处理。图2g、h、i 分别是部分增强结果、最终增强结果和最终增强体素。
步骤二:假阳性消除。估计对称平面(图2j)并将其用于删除假阳性区域。然后,利用颜色分割方案对WM(图2k)进行分割,并删除WM 外部的3D 标签(图2l)。图2m显示了假阳性去除的VOI。
步骤三:3D alpha背景分离。自动生成一个包含前景(图2m)、背景(图2n)和未知区域(图2o)的三元图。随后,使用alpha 背景分离方法来细化分割彩色MR 体素。将alpha 背景产生的软分割(图2p)阈值设为体素最大值的一半,从而得到最终的VOI二值分割结果(图2q),与专家手工分割的标准VOI结果(图2r)进行比较。
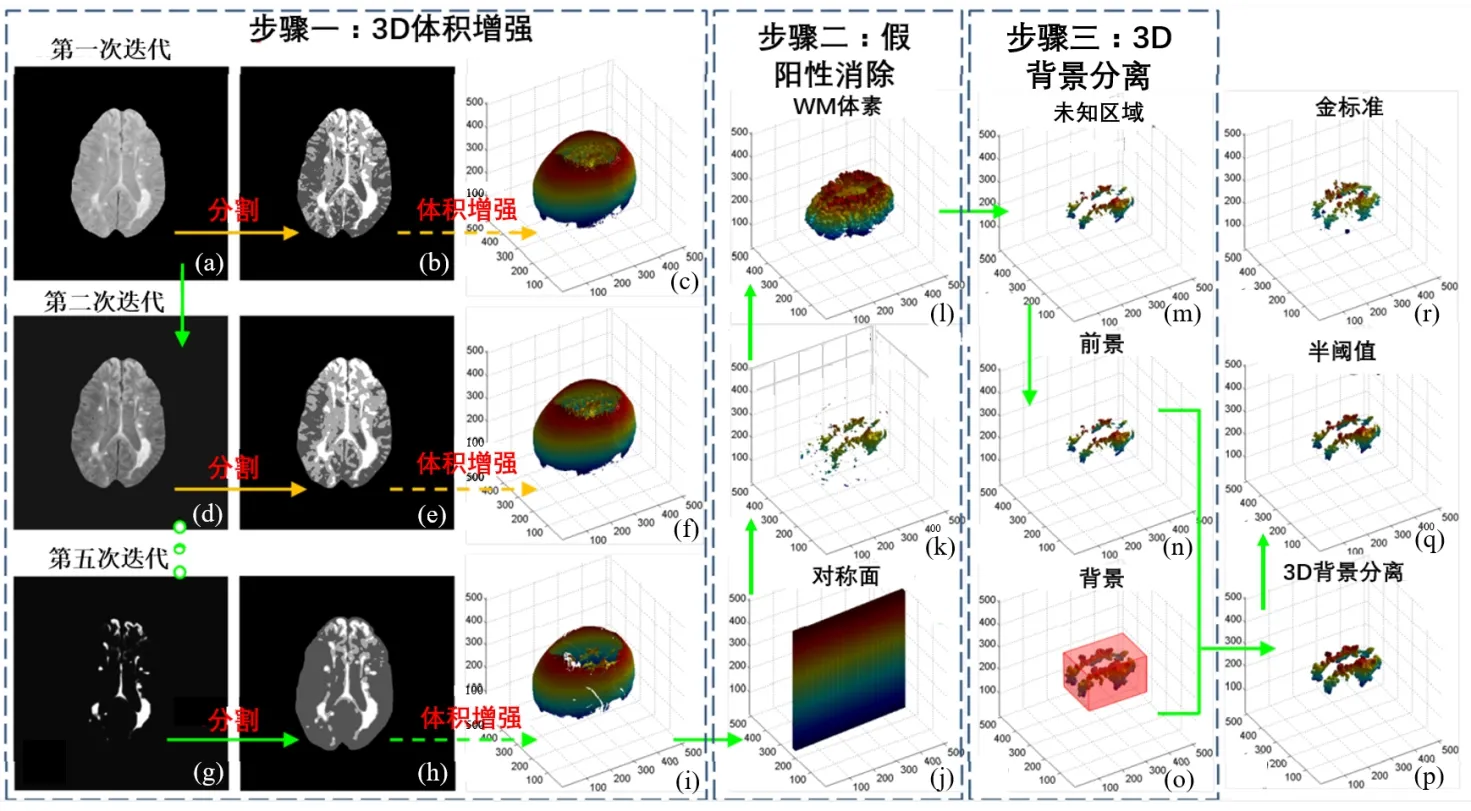
图2 基于3D增强和3D alpha背景分离的MS病灶分割T1加权像、T2加权像、Flair MRI实验过程Figure 2 Experimental process of MS lesions segmentation in T1-weighted,T2-weighted and Flair MRI using 3D voxel enhancement and 3D alpha matting
2.2 结果评估与分析
为了评估分割结果的准确性,本文采用3 种指标:真阳率(True Positive Rate,TPR)、阳性预测值(Positive Predictive Value,PPV)和Dice 相似 系数(Dice Similarity Coefficient,DSC)对分割结果进行评价,并与同样在CHB 数据集上进行检验的分割方法进行比较,如表1所示。其中DSC反映了分割结果和真实病灶在位置上的差异,其值为0~1。当DSC=0,表明二者没有重叠,DSC=1,则表明二者完全吻合。由表1可知,本方法与Ch.winner 的方法相比,在5 个患者(CHB01~CHB05)MRI数据均取得了更好的检测结果,其中平均TPR 提升0.3,PPV 提升0.21,DSC 提升0.28。与Context-rich RF 方法相比,本方法在TPR和DSC 方面同样具有显著提升,通过实验结果对比,验证了本方法具有更好的准确性和有效性。
为进一步验证所提方法的有效性,本文从正面、中矢面和矢状面视图对MRI图像的分割结果进行分析,如图3所示。图3中第1 行为MRI原始图像,第2行为本方法的分割结果,第3行为半阈值法的分割效果,第4 行为专家手动分割所得结果金标准。从图3可以看出,本文所提方法取得效果与金标准非常接近,对于病灶位置较特殊的图像也能完成分割任务。而应用半阈值分割方法取得的效果不是很理想,对于断层图像中较小的病灶出现模糊的现象,对于不规则的病灶边缘出现误分割或漏分割现象。实验结果表明,本方法能够在MS 病灶的不同视图上取得更为准确的分割效果。
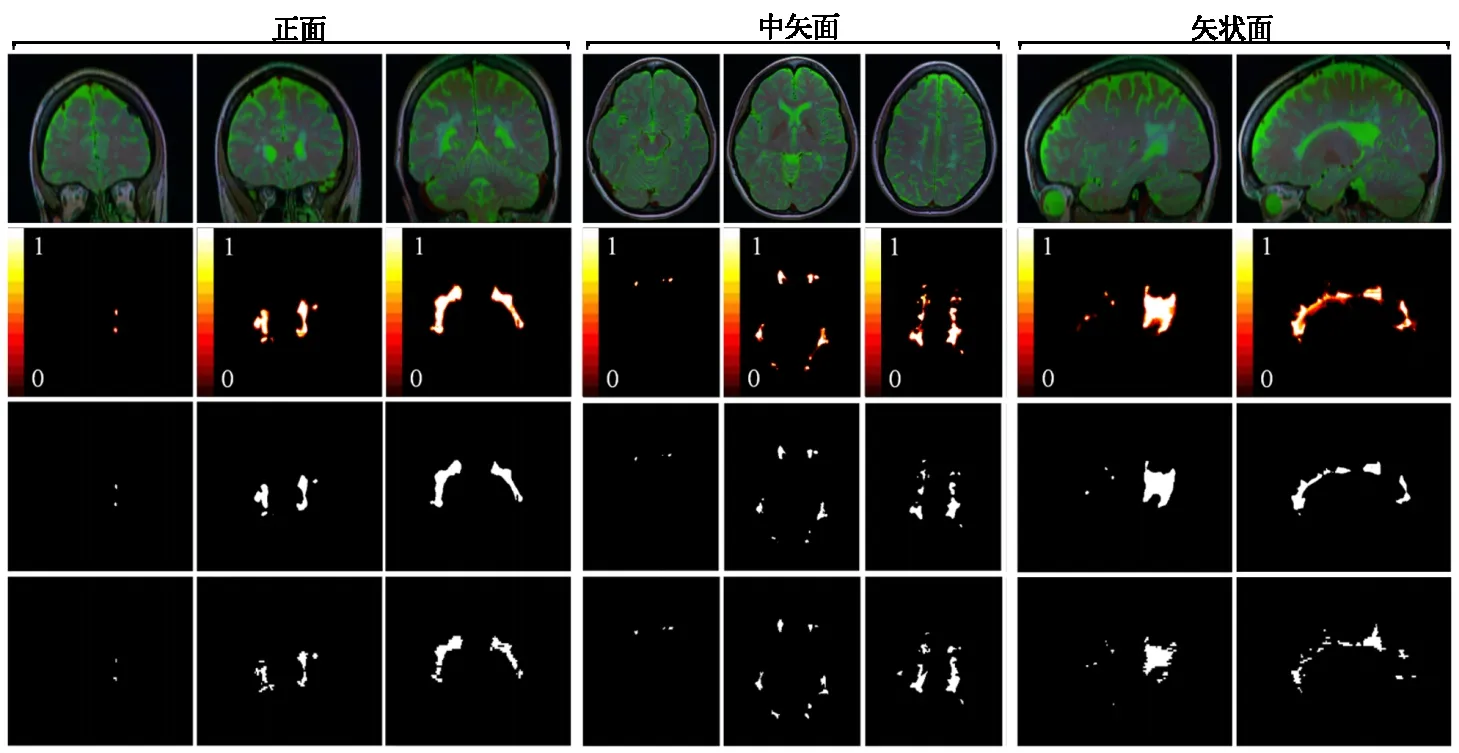
图3 基于不同视图的MRI图像分割效果比较Figure 3 Examples of the results of the proposed method in MRI segmentation from different views
3 结论
本文提出了一种新颖的基于3D 体素增强和3D alpha 背景分离的分割方法。利用3D 增强方法可以很好地处理图像噪声以及MS 病灶内部密度不均匀的问题。并且引入3D alpha 背景分离进行彩色MRI分割,可以有效地处理部分体素效应,以及去除噪声及其他无关非病变组织,进而准确分割MS 病灶。实验结果表明,本文方法具有较好的准确性和有效性,能为后续的MS 分割技术分析提供依据。同时为MS病变的预防治疗、病情跟踪提供客观、方便的诊疗方法。
目前本文方法尚存在一些不足,如射频场不均和不同软组织差异性导致MRI退化严重的情况下,无法进行精准分割。其次,由于图像分割过程中存在背景噪声和伪影干扰,导致无法提取到3D 特征和边界信息。在未来的研究中,可以基于级联随机森林的3D MR 图像分割方式,融合多模态3D 特征,从而消除噪声,提取丰富的特征信息。此外,后续可以对算法模型进一步改进,以达到更精确的分割效果。
