软体机器人在医学领域的应用
2022-07-26王成军亓杨杰
王成军,亓杨杰
1.安徽理工大学人工智能学院,安徽 淮南 232001;2.安徽理工大学机械工程学院,安徽 淮南 232001
前言
传统机器人主要由刚性部件组成,具有精度高、承载能力大等优点,但环境适应性差。软体机器人由软材料构成,因而具有刚性机器人难有的连续变形、高自由度、适应性强等特点[1-3]。软体机器人表现出的特点及优势使其在一些领域具有广泛应用前景,如医学[4]、工业抓取[5-6]、复杂环境勘探、搜救[7-8]等。
在20世纪80年代医学领域成功引入机器人技术之后,大量有关研究使医疗机器人发展迅速,但刚性医疗机器人仍存在柔性度不足等难以突破的局限性问题[9-11]。随着软体机器人的发展,研究发现软体机器人能弥补刚性医疗机器人的一些不足,如在微创手术中,刚性机器人在体内很难避开一些障碍器官,而软体机器人可轻易避开器官[12-13];此外,软体机器人由软材料构成,对人体有较高的友好性,不会对组织及器官造成伤害[14-15]。
1 软体机器人关键技术
1.1 软体驱动方式
传统刚性机器人多采用电机驱动,而软体机器人的驱动方式则主要包括流体驱动、形状记忆合金(Shape Memory Alloy,SMA)驱动、电活性聚合物(Electroactive Polymer,EAP)驱动。
(1)流体驱动方式的原理是利用流体压力使软体材料产生形变。按照流体不同,可分为气体驱动和液体驱动。因气体易获得、质量轻,气体驱动是软体机器人最常用的驱动方式[16]。(2)SMA驱动方式是利用材料在不同温度下对应不同形变量,进而产生软体机器人的驱动力。该驱动方法具有能量密度大、结构简单、无噪音等优点,在智能穿戴服饰中应用较为广泛[17]。(3)EAP 驱动是利用材料在电场作用下产生变形而实现的。根据电场作用对象不同,可分为离子型EAP、电子型EAP。其中,离子聚合物金属复合材料(Ionic Polymer Metal Composite,IPMC)驱动是离子型EAP 驱动典型代表。IPMC 驱动具有变形大、驱动电压低等特点[18],但需在水环境中进行,适用于水下软体机器人[19]。介电弹性体(Dielectric Elastomer,DE)驱动属于电子型EAP 驱动,具有质轻、能量密度大、响应速度快等优点,是人工肌肉的最佳选择[20-21]。
此外,还有磁驱动[22]、生物驱动[23]等驱动方式,这些驱动方式促进了无系留软体机器人的发展,如药物输送软体机器人。
1.2 建模与控制
对软体机器人进行分析,需要建立其运动学模型和动力学模型。其中,运动学建模常采用分段常曲率(Piecewise Constant Curvature,PCC)模型[24]。对软体机器人变形的变曲率进行正运动学分析时,可将其分割成多个微小段,然后采用微分方程等方法确定末端的空间位置[25]。对于动力学建模,可根据能量守恒定律得到动力学方程。Mustaza 等[26]利用改进的Kelvin-Voigt材料模型结合Lagrange方程建立软体机械臂的动力学模型;Xu等[27]使用Kane法建立电缆驱动的软体机械臂在粘性流体环境中的动力学模型。
软体机器人控制方面的研究包括基于模型控制和无模型控制[28]。基于模型控制是指利用运动学模型或动力学模型的控制方法。Bieze等[29]基于运动学模型提出了一种软机械手的闭环静态控制模型;Santina等[30]提出基于PCC 假设模型的二维软体机器人动态控制策略。无模型控制可在建模困难、建模精度不够时采用。软体机器人现阶段建模方法精度不高,因此无模型控制成为一个热点研究方向。Li等[31]以气动人工肌肉驱动软体机器人为例,提出一种基于自适应卡尔曼滤波器的无模型控制方法;Turan 等[32]采用深度强化学习算法实现磁驱动胶囊型软体机器人的动作控制。
1.3 制造技术
目前,软体机器人的制造方法有浇铸成型、3D打印、沉积成型(Shape Deposition Manufacturing,SDM)等。浇铸成型是将硅胶等软弹性液体浇注进模具成型的工艺,它对于结构简单和材料单一的软体机器人较为常用[33],其缺点是需要单独设计模具、制造周期长。3D打印属于增材制造,成型速度较快,是软体机器人主流制造方法之一。Georgopoulou 等[34]使用熔融沉积成型方法制造出一种气动执行器;Zhou等[35]提出使用直接墨水书写技术打印出高弹性硅胶的方法,并成功制造出气动人工肌肉。SDM 通过材料沉积,再进行部分加工,从而达到制造目的,可与嵌入成型方法相结合。Gafford 等[36]应用SDM 技术将传感元件与电缆等零件封装到抓钳的内部。SDM技术还被证明适合用于微尺度软体机器人的制造[37]。
软体机器人的每一种制造方法都有其适用范围和优缺点,应结合软体机器人的材料、结构、成本等选择合适的制造方法。
1.4 变刚度方法
软体机器人具有高柔性特点,但在完成一些任务时既需要柔性特征,又需要刚性特征[12,38]。因此,变刚度是软体机器人关键技术之一。目前,软体机器人变刚度方法主要有基于层干扰变刚度[39]、基于阻塞原理变刚度[40]、基于材料相变变刚度[41]、基于耦合结构变刚度[42]。其中,基于阻塞原理变刚度方法简单且效果好,是最常用的变刚度方法;基于层干扰变刚度方法在小范围内变刚度效果较好;基于材料相变变刚度方法可实现刚度大幅度改变,但需提供相变激活系统;基于耦合结构变刚度方法是利用结构的冗余现象实现刚度调节,该方法简单,但效果不佳。
2 医疗软体机器人
目前,医疗软体机器人按照用途主要可分为:外科手术软体机器人、康复及辅助软体机器人、药物输送软体机器人、心脏治疗软体机器人。
2.1 外科手术软体机器人
手术是重要的治疗手段,机器人技术的应用可提高手术效率及成功率。软体机器人在外科手术的应用研究以微创手术最为典型[43]。
微创手术应用软体机器人的研究主要集中在软体操纵器及软体抓钳方面。软体操纵器通常用作其它手术工具的载体,利用软体机器人的高自由度及柔软特性保障运动的安全性。Ranzani等[44]设计了一种基于章鱼手臂原理的变刚度软体操纵器(图1),基于颗粒堵塞原理实现软操纵器的刚度变化,满足安全避障及手术稳定性要求。Wang 等[45]将内窥镜、活检钳等工具嵌入其设计的电缆驱动软体机器人(图2),并在完整软体机器人系统下完成其性能测试;Diodato等[46]将带有内窥镜的气动软体操纵器成功融入达芬奇机器人系统(图3),实现软体机器人与传统刚性机器人的协同工作。传统的刚性抓钳抓取力不易控制,容易损伤组织[47],因此,Huan 等[14]设计了两种微创手术用软体抓钳:离散软体抓钳和连续软体抓钳(图4),抓钳的上下颚采用软体材料,接触面积会随抓取力作相应调整,相互之间的压力不会急剧增大,大大降低了组织遭到破坏的可能性。
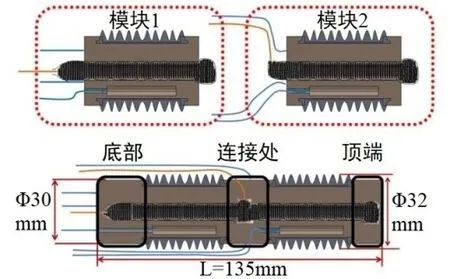
图1 双模块气动软体操纵器Figure 1 Dual module pneumatic soft manipulator

图2 电缆驱动软体操纵器Figure 2 Cable actuated soft manipulator
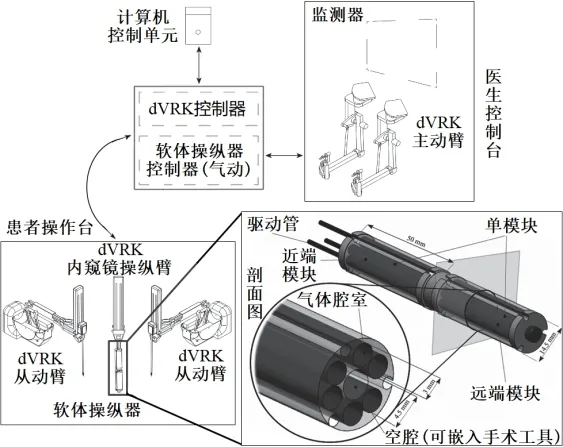
图3 软体操纵器嵌入方式Figure 3 Soft manipulator embedding mode
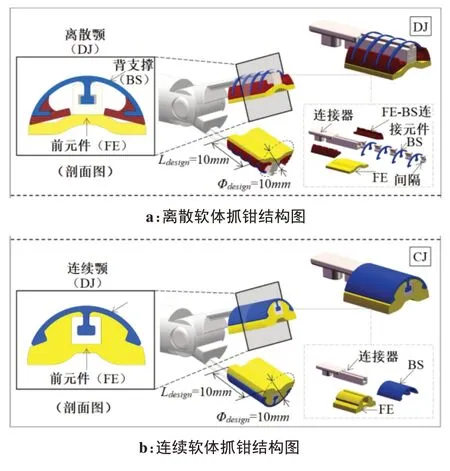
图4 离散软体抓钳和连续软体抓钳Figure 4 DJ soft grasper and CJ soft grasper
除在微创手术外,在一些其它精度要求和敏感性高的手术中,软体机器人也有应用。Guo等[48]针对神经修复手术设计了一种双臂型软体机器人夹持系统(图5),其气动夹持器的夹紧力可有效控制在安全范围内双臂的固定气动锁,为手术提供稳定的环境;Kanno等[49]设计了一种眼科手术辅助用单自由度软体机器人(图6),采用气体驱动,外部缠绕线圈限制驱动器径向膨胀,轴向变形可推动针头完成相应的动作。

图5 双臂式软体机器人夹持系统Figure 5 Dual arm soft robot clamping system
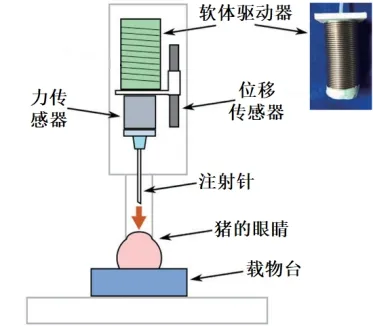
图6 眼科手术用软体机器人Figure 6 Soft robot used in ophthalmic surgery
外科手术用软体机器人目前采用的材料主要是硅胶,安全可靠,满足手术环境要求;驱动方式多采用气体驱动或电缆驱动。
2.2 康复及辅助软体机器人
对于肢体功能障碍的人群,需要长期康复治疗及日常生活辅助。采用机器人能提高康复训练便利性及治疗效果,且使用成本低。软体机器人与刚性机器人相比,具有安全性高、适应性强、成本低等优点,更适用于康复治疗及肢体功能辅助。
针对上肢康复及辅助的研究主要集中在手部。Hong等[50]设计了一种6指软体机器人(图7),置于腕部的软气动执行器能帮助完成部分日常抓取动作,提高手部功能障碍者的生活便利性;Taylor等[51]提出一款热驱动式用于手指康复的软体机器人,采用相变石蜡材料作为驱动,可省去泵、阀门等部件;Patterson 等[52]研发一种软体康复手套(图8),可实现每根手指康复性训练的单独控制。目前辅助运动设备主要面向成人,针对儿童的设计较少。Kokkoni等[53]研发了一种可穿戴软体机器人(图9),能辅助和训练具有脑损伤或上肢残疾的婴儿进行上肢运动。
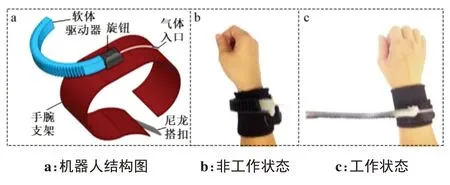
图7 6指软体机器人Figure 7 Six-finger soft robot

图8 软体康复手套Figure 8 Soft rehabilitation glove

图9 上肢康复软体机器人Figure 9 Upper limb rehabilitation software robot
在下肢康复及功能辅助方面,软体机器人也有应用案例。Low 等[54]研制出一种软气动装备(图10),可辅助患者进行踝关节运动,预防深静脉血栓形成;Kim 等[55]研发了一款SMA 线驱动的智能服装(图11),SMA 线驱动器产生的驱动力可为踝关节提供一定辅助力,减轻人体行走时的负担。目前,智能服装中采用的SMA 材料工作温度普遍较高,需要使用隔热保温材料,能源消耗较大。Ozbek等[56]针对较低激活温度的SMA 驱动器进行试验,在临近室温的温区内能产生足够的驱动力,可满足智能服装的使用需求;但由于其在低于室温到室温之间也存在一定驱动力,具有低温不可控性。
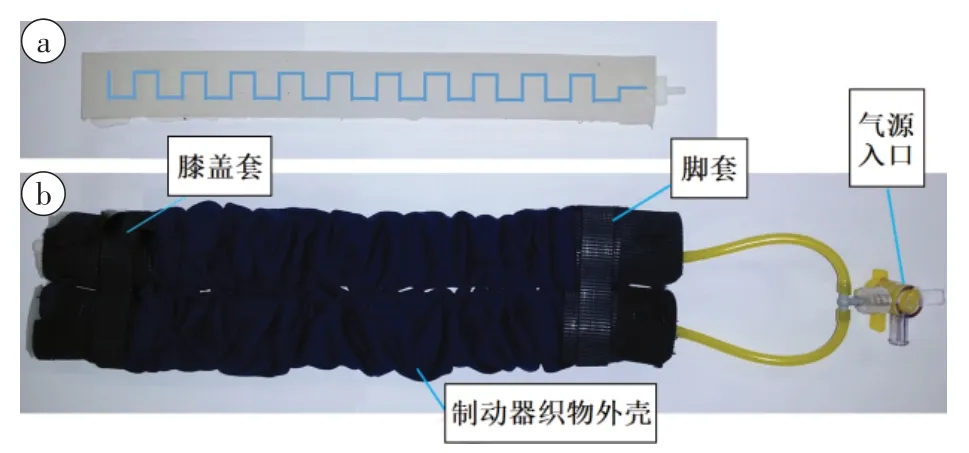
图10 软气动装备Figure 10 Soft pneumatic equipment
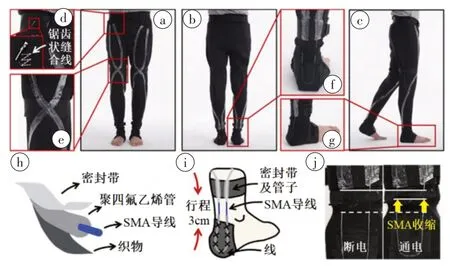
图11 SMA线驱动智能服装Figure 11 SMA wire actuated smart clothing
康复型软体机器人采用气体驱动方式居多,虽然气源泵不易携带,但可满足居家康复训练要求。肢体辅助软体机器人需要较强的便携性,采用轻便、能量密度大的智能材料驱动方式是其未来发展的主要趋势。
2.3 药物输送型软体机器人
药物定向输送对于治疗某些疾病非常重要。如癌症治疗中因药物到达肿瘤靶细胞的效率低下,导致药物的有效性大大降低[57],加大药物的剂量不仅造成了浪费,还增加了药物的副作用[58],采用药物输送机器人可解决此问题。
磁驱动能实现无线驱动,且对人体无害,因此被广泛应用在药物输送软体机器人中[59]。Yim 等[60]提出一种半植入式形状可变磁驱动胶囊式软体机器人(图12),该机器人能在磁场作用下实现球形和圆柱形态相互转变,达到进出及停留在胃部的目的。Li等[61]设计出一种磁性驱动微型软体机器人(图13),包括8个花瓣状的软体径向臂,由含有磁性颗粒的双层结构水凝胶制成,通过磁场及pH 值刺激完成药物的靶向传递;Lee 等[62]研制出一种弹簧型磁驱动水凝胶式微型软体机器人(图14),采用红外刺激诱导药物释放;Mushtaq 等[37]研发出仿电鳗混合软体纳米机器人(图15),可在不同磁场下实现平移、旋转和摆动等三维运动,进而将药物输送至靶点位置,而且柔性尾巴在磁场作用下,利用压电效应能实现药品定量释放。

图12 形状可变胶囊式软体机器人Figure 12 Capsule soft robot of variable shapes
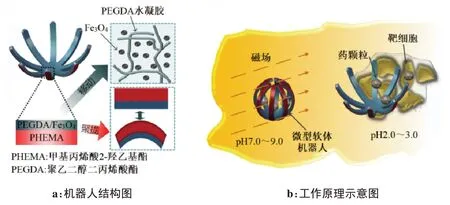
图13 pH值响应型软体机器人Figure 13 Soft robot response to pH value
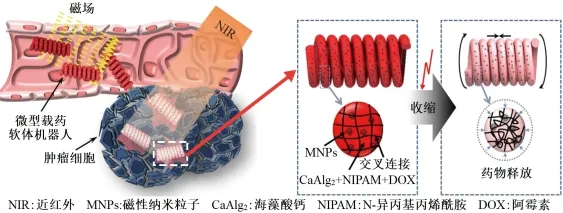
图14 弹簧型水凝胶式软体机器人Figure 14 Spring-type hydrogel soft robot
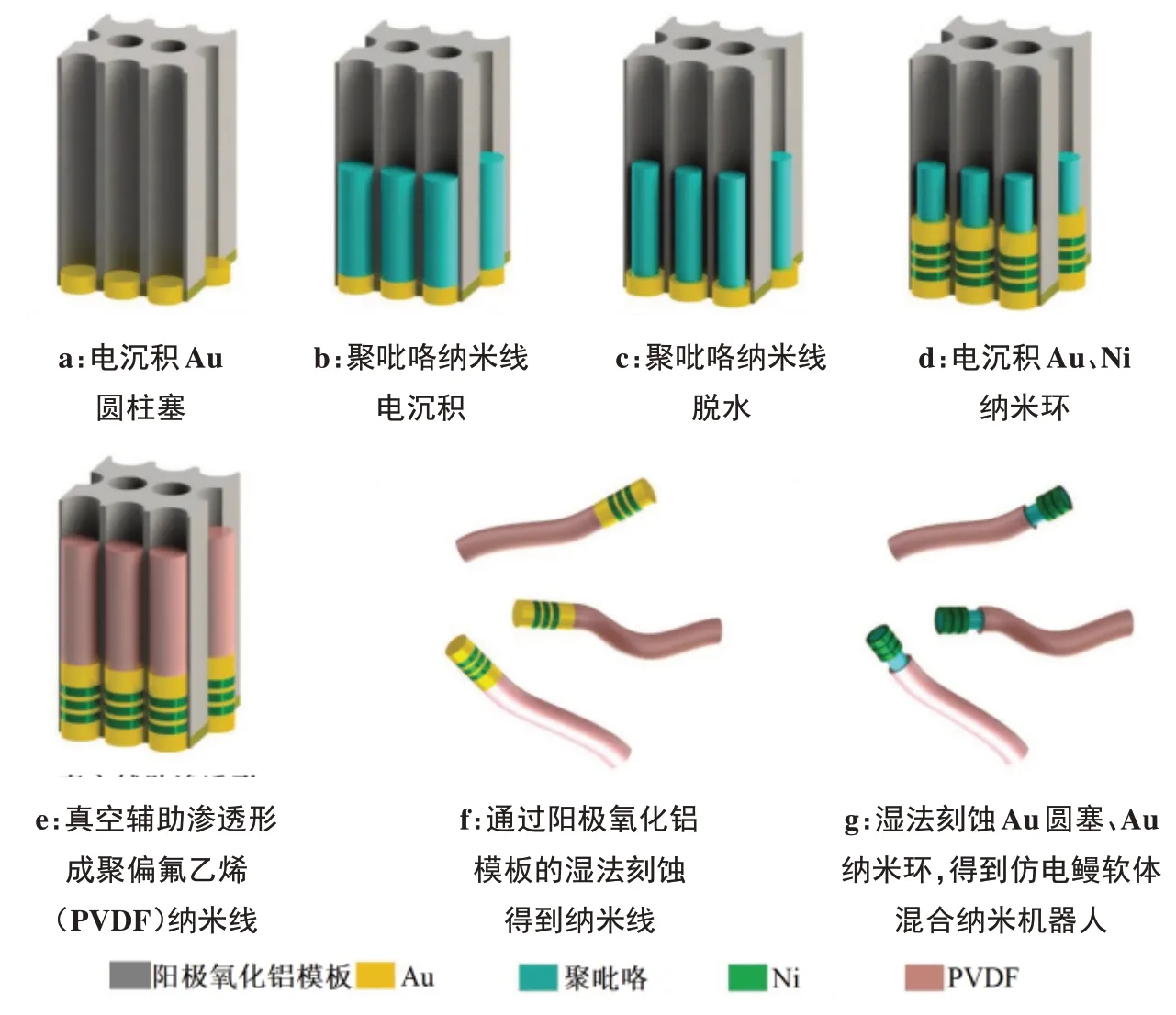
图15 仿电鳗混合软体纳米机器人Figure 15 Hybrid soft nano-robot imitating electric eel
药物输送软体机器人需要在体内移动,形状微小,不宜携带电池等能源;因磁场安全可靠,能有效解决软体机器人移动动力问题,磁驱动成为药物输送软体机器人最常用的驱动方式。除了磁驱动外,生物驱动也是药物输送软体机器人的一个研究方向。Singh 等[23]设计出一种将细菌与W/O/W 微乳相结合的生物杂交软体机器人,他们在体外实验中采用大肠杆菌与微乳结合,验证了该杂交软体机器人的可实施性,为药物输送机器人的研究提供了新的方向。
2.4 心脏治疗软体机器人
心脏衰竭是心脏恶化的最终走向,其治疗的根本方法是更换心脏;但心脏供体远远不足,因此心室辅助装置(Ventricular Assist Devices,VADs)成为缺少供体时的替代治疗方法。
哈佛大学、波士顿儿童医院心脏外科等机构针对心脏衰竭问题提出一系列辅助治疗措施[63-68]。针对目前VADs 容易造成血栓、心脏模拟性较低等问题,Roche等[63]设计出一种软体机器人用于辅助心脏工作(图16a)。软执行器由PAM 制成的圆周执行器和螺旋扭转执行器组合而成,可单独或同时使用。该软体机器人采用直接压缩式辅助心脏工作,克服了形成血栓等问题,但对于单心室异常引起的室间隔异常问题还存在技术瓶颈。Horvath等[64]提出一种固定在右心室自由壁和室间隔上的软体机器人(图16b),其气动线性执行器在心室内,存在气动回路泄漏导致发生空气栓塞的危险。Payne 等[65]设计了另一种固定在心室自由壁和室间隔上的软体机器人(图16c),其线性驱动器放置在心室外,避免发生空气栓塞的问题,同时该软体机器人将室中隔和自由壁的作用更好的发挥出来,使心室的射血能力显著增强。

图16 软体机器人式VADsFigure 16 VADs of soft robot
在心脏瓣膜置换治疗方面,Ohlmann等[69]依据现有人工瓣膜存在的缺陷,设计出一种软体机器人式人工主动脉瓣膜,能利用心室收缩压扩大有效孔区面积,避免发生人工心脏瓣膜患者心脏不匹配问题。
无论是VADs 还是人工主动瓣膜,都属于长期植入体内设备,受现有技术的限制,目前尚未达到临床试验水平。
3 医学领域软体机器人面临的挑战
软体机器人的研究起步较晚,有许多技术不够成熟。其应用在医学领域的挑战主要有以下几个方面:
(1)提高软体材料的安全性,优化软体机器人制造技术。医疗软体机器人与人体接触,因此对材料的安全性要求更高,尤其对于植入性心室辅助用软体机器人,需在体内具有长期相容性,不会产生免疫反应,目前使用的材料只被证明短期内适合使用[63-65]。可体内降解是药物输送软体机器人的一个重要研究方向,目前用作软体机器人的材料难以实现体内完全无害降解[70]。微型软体机器人可应用于微创手术、体内药物输送等方面,其尺寸微小,制造困难且对软体材料的要求较高[60-62,71]。因此,对软体材料及制造方法仍需继续深入研究。
(2)驱动系统应向集成化、多样化发展。气体驱动是目前医疗软体机器人中应用最多的驱动方式,但气体驱动需要大量额外附件,便捷性差[50]。在医疗软体机器人中,以SMA 为代表的智能材料驱动器主要应用于智能穿戴服饰,其它方面应用较少[55]。微小、无系留、不适合搭载电源等是药物输送软体机器人的特点。目前,其大多采用含有磁性材料的执行器搭载磁驱动方式[37,60-62],单一的磁驱动在药物运输中存在一定的局限性,有研究采用磁驱动与红外刺激[62]、pH值刺激[61]等混合驱动方式解决此问题;但人体内情况复杂,混合驱动的方法也难以满足更多应用需求,因此驱动系统的研究应向集成化、多样化发展。
(3)建模理论有待完善,控制精度不高。软材料的变形属于连续的非线性变形,且其具有较高的响应延迟性[72],这对软体机器人的建模与控制带来了极大的挑战。目前,由于软体机器人的建模大都基于PCC 模型假设[24],虽然使软体机器人的建模得到极大简化,但导致模型存在较大的误差。模型的精确程度与基于模型控制方法的精准程度息息相关。因此,对软体机器人模型的精准建立是未来工作的一项重要挑战。无模型控制对运动学与动力学模型虽然无要求,但其目前普遍存在训练时间长、精度不够等问题[32]。
4 总结与展望
软体机器人关键技术包括驱动方式、建模与控制、制造技术以及变刚度方法,关键技术的发展决定了软体机器人的应用前景。目前,软体机器人在手术、康复及辅助、药物输送、心脏治疗方面都有应用。其中部分康复治疗型软体机器人的技术较为成熟,可在临床中使用;而外科手术软体机器人、药物输送软体机器人、心脏治疗软体机器人大多处于设计阶段,实验数据基本是体外实验测得,距离临床应用的要求还存在一定差距。
随着软体机器人在材料、驱动方式、建模理论、控制方法等方面的不断创新、完善和发展,软体机器人终究能达到临床应用标准,在医学领域的应用也会更广泛。软体机器人与传统刚性机器人共同协作可为医学治疗提供更多解决方案,提高医疗效率。
