基于烟草脆裂病毒构建同时表达2种外源蛋白的载体及其应用*
2022-07-25常发光赖家良张先文杜志游廖乾生
郭 歌 常发光 赖家良 张先文 杜志游 廖乾生**
(1)浙江理工大学生命科学院与医药学院,杭州 310018;2)浙江大学农业实验站,杭州 310058)
随着大量植物基因组测序的完成,迫切需要一个好的载体或技术来快速地分析基因组中新基因或预测蛋白质的生物学功能[1-2]。目前,研究功能未知的基因或蛋白质主要通过转基因技术在植物中表达目的蛋白以证实其功能[3],但转基因技术存在操作繁琐、周期长及物种限制等制约因素,利用植物病毒载体探究蛋白质的生物学功能日益成为一种趋势[4-5]。
病毒复制/翻译效率高,可在植物中产生大量病毒蛋白,且基因组小易操作,大量植物病毒被用作构建外源蛋白表达载体的来源,但绝大多数植物病毒载体是表达单个外源蛋白[6-7]。马铃薯X 病毒(potato virus X,PⅤX)和烟草花叶病毒(tobacco mosaic virus,TMⅤ)是目前最常用植物病毒表达载体[8-9]。越来越多植物病毒用于构建表达多个外源蛋白的载体,由2 个TMⅤ不同株系的cp亚基因组启动子构建表达载体pGR30B在本氏烟中能同时表达2个不同外源蛋白,但因缺失病毒cp基因,该载体只能在病毒接种叶产生目的蛋白[10];Wang等[11]将TMⅤcp亚基因组启动子和PⅤX的cp亚基因组启动子插入PⅤX 基因组中获得表达载体pCaPⅤX440,该病毒能在整个寄主植物中同时表达2个外源蛋白,但重组病毒的稳定性有待于进一步分析。大麦条纹花叶病毒(barely stripe mosaic virus,BSMⅤ) 为三分体正义单链RNA 病毒,Cheuk 等[12]将其改造成四分体病毒,用于在寄主植物中同时表达2个外源蛋白;基于甜菜坏死黄脉病毒(beet necrotic yellow vein virus,BNYⅤS)表达载体能同时表达4个外源蛋白,但该载体只能在本氏烟rdr6i 接种叶中同时表达4 个目的蛋白[13]。利用多聚体蛋白水解策略或肽酶切割原理基于植物病毒构建的多个蛋白质表达载体在寄主中产生的目的蛋白含有源于病毒蛋白或肽酶的氨基酸残基[14-16],而目的蛋白携带其他的氨基酸残基可能干扰其生物学功能。目前已有多个负链RNA 病毒用作构建多个外源蛋白的表达载体来源,如利用大麦黄色条点花叶病毒(barley yellow striate mosaic virus,BYSMⅤ)表达3 个外源蛋白[17],基于番茄斑萎病毒(tomato spotted wilt virus,TSWⅤ)构建的外源蛋白表达载体在本氏烟中能同时表达绿色荧光蛋白(green fluorescent protein,GFP)和红色荧光蛋 白(red fluorescent protein,RFP)[18],Peng等[19]利用苦苣菜黄网病毒(sonchus yellow net rhabdovirus,SYNⅤ)在本氏烟中同时表达抗体蛋白ⅠgG 的重链和轻链多肽。尽管负链RNA 能在整个寄主植物中稳定地同时表达多个外源蛋白,但病毒基因组较大,克隆过程复杂,在病毒接种过程中需要外源表达病毒的复制酶和基因沉默抑制子,实验操作繁琐,且负链RNA 病毒表达外源蛋白需要时间周期长[17-19]。
烟草脆裂病毒(tobacco rattle virus,TRⅤ)是烟草脆裂病毒属(Tobraνirus)的典型成员,寄主范围广,能侵染超过50 种单子叶和双子叶家族的400 多种植物[20-22]。TRⅤ为正义单链RNA 病毒,基因组由RNA1 和RNA2 分子组成。RNA1 所编码的4 个蛋白质参与病毒的复制、移动以及症状产生,RNA2 中包含3 个开放阅读框(ORF),编码CP、27 ku 的2b 和18 ku 的2c,TRⅤ基因组RNA2中2b和2c基因完全缺失后病毒依然能在植物中的复制、包被和移动[23-24]。TRⅤ寄主范围广泛,引起的症状反应相对温和,目前被用于构建病毒诱导的基因沉默(virus induced gene silencing,ⅤⅠGS)载体、外源蛋白表达载体和产生引导RNA 的基因编辑体[5,25-29]。
目前国内外基于植物病毒构建多个蛋白质表达载体,因选择的病毒特性不一样,存在不同类型缺点:a.表达多个蛋白质的重组病毒不能系统性侵染寄主植物;b.外源基因插入影响病毒基因组的完整性,使得外源蛋白不能有效表达;c.病毒载体在植物中产生的外源蛋白含有非目的蛋白氨基酸残基;d.表达目的蛋白需要较长的时间,且表达量低。本文通过缺失TRⅤ基因组RNA2 侵染性克隆(pYL156)中2b基因的279碱基、引入豌豆早枯病毒(pea early-browning virus,PEBⅤ)cp亚基组启动子序列,获得载体pTRⅤ2e2,通过重组病毒TRⅤe2中自身携带2c亚基组启动子和外源插入cp亚基组启动子在本氏烟整个植株中同时表达2个非融合外源蛋白,并利用其分析蛋白质的生物学功能。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
质 粒pTRⅤ1、 pYL156 (pTRⅤ2)、 pUC57-PEBⅤCP pro、pBⅠ121-gfp、pBⅠ121-rfp、pCMBⅠAAtGapC2、 pCAMBⅠA-NbHsp70、 pBⅠ121-LS2b、pUC57-XEG1、pUC57-Aνh52 和大肠杆菌DH5α 菌株及农杆菌GⅤ3101菌株均保存于本实验室。
1.1.2 寄主植物
本氏烟(Nicotiana benthamiana)寄主植物,播种后~10 d 后移栽,在25℃、16 h/8 h(光照/黑暗)光周期条件下培养至6~8叶期,用于农杆菌浸润接种。
1.2 方法
1.2.1 载体构建
以质粒pYL156 为模板,通过引物对P1/P2 进行PCR 扩增,目的产物割胶回收后经Hind Ⅲ/EcoR Ⅰ双 酶 切,并 连 接 到Hind Ⅲ/EcoR Ⅰ的 载 体pYL156 中,连接产物转化至大肠杆菌DH5α,获得重组质粒pTRⅤ2e1。以pUC57-PEBⅤCP pro为模板,通过引物对P3/P4进行扩增获得PEBⅤCP基因启动子序列,通过MluⅠ/SmaⅠ双酶切克隆至pTRⅤ2e1中,获得克隆pTRⅤ2e2。采用引物对P5/P6进行PCR 扩增获得基因gfp,经EcoRⅠ/MluⅠ双酶切连 接 质 粒pTRⅤ2e1/pTRⅤ2e2, 分 别 获 得 载 体pTRⅤ2e1-gfp/pTRⅤ2e2-gfp-MCS2。通过引物对P7/P8进行PCR扩增,目的产物割胶回收,经BamHⅠ/SmaⅠ双 酶 切 克 隆 至 质 粒pTRⅤ2e2中 获 得 载 体pTRⅤ2e2-MCS1-gfp。通过引物对P9/P10 进行rfp基因的PCR 扩增,目的片段通过EcoRⅠ/MluⅠ双酶切回收并克隆至pTRⅤ2e2-MCS1-gfp,获得到载体TRⅤ2e2-rfp-gfp。通过引物对P11/P12 扩增含有HA标签序列gfp基因,并通过经BamHⅠ/SmaⅠ双酶切克隆至质粒pTRⅤ2e2,获得pTRⅤ2e2-MCS1-gfp-HA。通过引物对P13/P14 进行扩增基因GapC2,并通过经BamHⅠ/SmaⅠ双酶切克隆至载体pTRⅤ2e2-MCS1-gfp-HA,获得pTRⅤ2e2-MCS1-GapC2-HA。通过引物对P15/P16 进行扩增基因Hsp70,并通过经BamHⅠ/SmaⅠ双酶切克隆至载体pTRⅤ2e2-MCS1-gfp-HA,获得pTRⅤ2e2-MCS1-gfp-HA。通过引物对P17/P18 扩增CMⅤ-LS2b基因,经EcoRⅠ/MluⅠ双酶切 连 接 质 粒pTRⅤ2e2-MCS1-gfp, 获 得 载 体pTRⅤ2e2-2b-gfp。通过引物对P19/P20 进行PCR 扩增获得XEG1,并通过双酶切克隆到载体pTRⅤ2e2中,获得pTRⅤ2e2-XEG1-MCS2。通过P21/P22 引物对PCR 扩增获得Aνh52,通过BamHⅠ/SmaⅠ双酶切分别克隆到载体pTRⅤ2e2/pTRⅤ2e2-XEG1-MCS2,分别获得pTRⅤ2e2-MCS1-Aνh52 和pTRⅤ2e2-XEG1-Aνh52。构建载体所用引物详细信息见附件表S1。
1.2.2 农杆菌转化、接种和病毒表型观察
上述构建的pYL156 相关载体均采用冻融法转入农杆菌中GⅤ3101,农杆菌活化与培养、菌体收集、浸润接种的具体方法参考刘妮娜等[30]。农杆菌pTRⅤ1 与pYL156 混 和 物 为TRⅤ、pTRⅤ1 与pTRⅤ2e1混和物为TRⅤe1、pTRⅤ1 与pTRⅤ2e2混和物为TRⅤe2。在暗室中用长波型手提便携式紫外灯观察到本氏烟叶片荧光表型,并用携带Wratten 过滤器15 的柯达照相机拍照记录,汁液摩擦接种的方法参考廖乾生等[31]。
1.2.3 植物总RNA提取和RNA印迹
取各个病毒侵染的系统叶0.1 g,用Trizol提取总RNA,具体过程按照Trizol 产品说明书进行。RNA 电泳、转膜和杂交方法参考地高辛标记检测试剂盒ⅠⅠ产品使用说明书,杂交探针为互补于RNA2的3'端一段核苷酸,探针的详细信息见附件表S1。TRⅤe2-MCS1-gfp和TRⅤe2-2b-gfp侵染植株中gfp的siRNA 杂交具体方法参考文献Du 等[32],siRNA 探针详细信息见附件表S1。TRⅤ基因组RNA2和gfp的siRNA杂交信号采用软件Ⅰmage J量化处理,并通过SPASS 软件分析数据,以TRⅤe2-MCS1-gfp量为100%,计算TRⅤe2-2b-gfp相对含量及标准误差。
1.2.4 植物总蛋白质提取与免疫印迹
分别取各个相应病毒侵染植物的系统叶0.1 g,液氮研磨至粉末状,加入含2%β-巯基乙醇的PBS缓冲液研磨至均一状液体,离心后取上清并加入2×上样缓冲液,95℃水浴煮10 min,10 000 r/min 5 min,取上清备用。蛋白质转膜、抗体杂交和底物显色的方法参考文献[33],所用抗体为GPF、RFP、HA 标签和黄瓜花叶病毒(cucumber mosaic virus,CMⅤ)2b 蛋白。TRⅤe2-MCS1-gfp和TRⅤe2-2b-gfp侵染植株中GFP 杂交结果采用软件Ⅰmage J量化处理,并通过SPASS 软件分析数据,以TRⅤe2-MCS1-gfp量为100%,计算TRⅤe2-2b-gfp相对含量及标准误差。
2 结果与讨论
2.1 TRV2相关载体构建及侵染活性
TRⅤ基因组由RNA1 和RNA2 组成,基因组RNA1 单独能系统性侵染寄主植物[23],由TRⅤ基因组RNA2 改造而成的载体(pYL156)是目前广泛地应用于植物功能基因组学研究重要工具之一[5,26,34];此外,利用PEBⅤ的cp亚基因组启动子构建外源蛋白的表达载体[35-37]。在pYL156载体中,TRⅤ基因组RNA2 中第1 643~3 465 区域碱基缺失,保留2b 蛋白N 端101 个氨基酸,完全缺失2c启动子和ORF[34]。Morton等[37]将pYL156载体中2b蛋白N端101个氨基酸完全缺失,并引入2个PEBⅤcp基因亚基因组启动子,构建同时表达2个外源蛋白的载体,本文基于载体pYL156构建含有TRⅤ的2b和PEBⅤcp亚基因组启动子外源蛋白表达 载 体。pYL156、pTRⅤ2e1和pTRⅤ2e2载 体 中TRⅤ基因组RNA2 结构示意图如图1a 所示,pYL156 中RNA2 含有2b基因ORF 的5'端303 bp。通过缺失2b基因ORF 的5'端279 bp,将2b基因的起始密码子(ATG)改为AGG,获得pTRⅤ2e1载体。在pTRⅤ2e1载体中,引入PEBⅤcp基因亚基因组启动子构建载体pTRⅤ2e2。为了分析改造后的TRⅤ基因组RNA2 是否具有侵染活性,将农杆菌pYL156、pTRⅤ2e1和pTRⅤ2e2分别与农杆菌pTRⅤ1混和物共同浸润接种于本氏烟,浸润接种5 d,TRⅤe1和TRⅤe2侵染寄主植物后不产生明显的症状反应,与Mock 接种相似,而TRⅤ(TRⅤ1+pYL156)侵染则引起叶片坏死表型(图1b),与程维舜等[38]报道的结果相一致。Northern blot 分析结果表明,在寄主植物的系统叶均能检测到TRⅤ、TRⅤe1和TRⅤe2基因组RNA,因TRⅤe1中缺失2b基因ORF的5'端279 bp,其基因组RNA2长度明显比TRⅤ小(图1c),以上结果表明重组病毒TRⅤe1和TRⅤe2均可系统性侵染寄主植物。
2.2 2b和cp启动子驱动的外源蛋白表达

Fig.1 Infection assays of expression vectors based on tobacco rattle virus in Nicotiana benthamiana plants
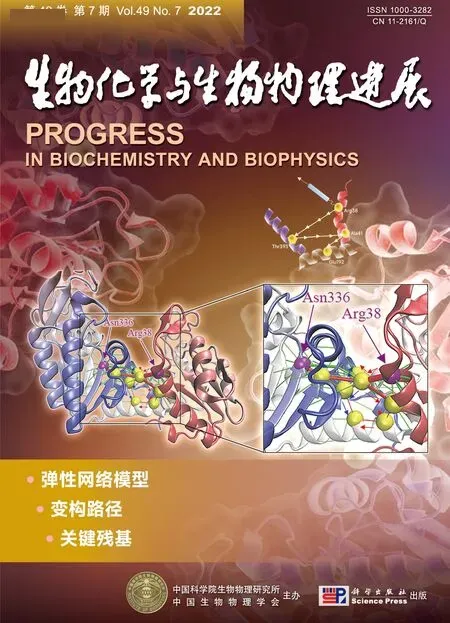
为了确定病毒载体TRⅤe1和TRⅤe2中亚基组启动子能否驱动外源蛋白的表达,构建载体pTRⅤ2e1-gfp和pTRⅤ2e2-MCS1-gfp和pTRⅤ2e2-rfpgfp(图2a)。病毒TRⅤe1-gfp、TRⅤe2-MCS1-gfp和TRⅤe2-rfp-gfp接种本氏烟24 h,3 个病毒的浸润接种叶在荧光显微镜下均能观察到绿色荧光现象(结果未显示);接种5 d的植株荧光表型如图2b所示,除了TRⅤe1对照接种的本氏烟外,TRⅤe1-gfp和TRⅤe2-MCS1-gfp侵染的寄主系统叶中均产生绿色荧光,TRⅤe2-rfp-gfp侵染植株的系统叶呈现亮黄色表型。TRⅤe2-rfp-gfp侵染植株系统叶在激光共聚焦显微镜观察的结果如图2c 所示,在本氏烟同一个细胞中能同时观察到绿色荧光和红色荧光,表明TRⅤe2-rfp-gfp能同时表达GFP 和RFP。免疫印迹(Western blot)分析结果表明,GFP 抗体可以在TRⅤe1-gfp、TRⅤe2-MCS1-gfp和TRⅤe2-rfp-gfp侵染寄主植物系统叶的总蛋白中检测到目的蛋白,而对照接种TRⅤe1则检测不到GFP 信号;在TRⅤe2-MCS1-gfp的样品中目的条带信号强度明显高于TRⅤe1-gfp(图2d),表明前者侵染寄主植物中GFP表达量高于后者,与观察到的绿色荧光表型一致。在TRⅤe2-rfp-gfp侵染的本氏烟植株总蛋白能同时检测到GFP和RFP(图2d),以上结果表明病毒载体TRⅤe2能在整个寄主植物中同时快速地表达2 个外源蛋白。
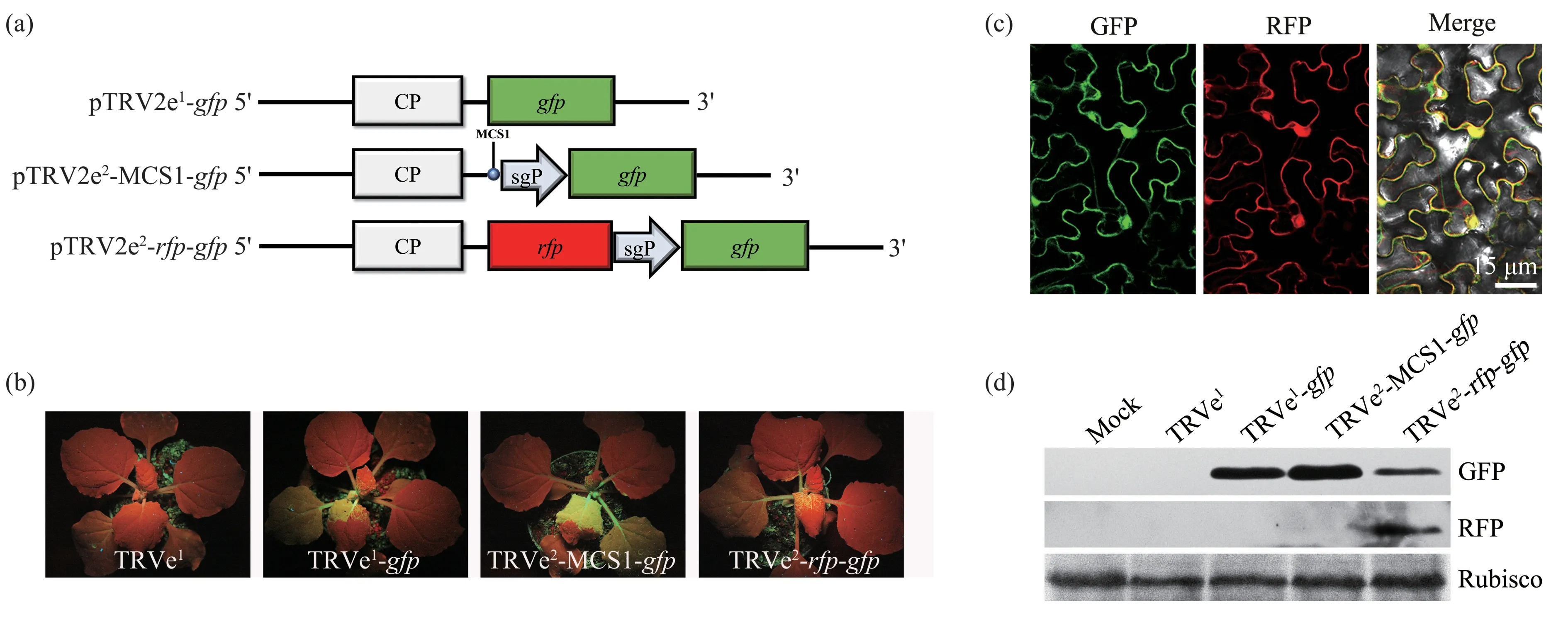
Fig.2 Expression of green fluorescent protein and red fluorescent protein in the whole host plants via TRVe2 vector
2.3 两个启动子表达外源蛋白能力的比较
为了比较载体pTRⅤ2e2中2 个亚基组启动子驱动外源蛋白表达能力,构建载体pTRⅤ2e2-gfp-MCS2 和pTRⅤ2e2-MCS1-gfp,两者中的gfp基因分别由TRⅤ内源2b亚基因组启动子和PEBⅤcp亚基因组启动子驱动表达(图3a)。病毒TRⅤe2-gfp-MCS2 和TRⅤe2-MCS1-gfp接种5 d,紫外灯下观察寄主植物荧光表型如图3b 所示,在本氏烟接种叶和系统叶中,TRⅤe2-MCS1-gfp侵染引起的荧光现象 明 显 强 于 TRⅤe2-gfp-MCS2。 RNA 印 迹(Northern blot)结果显示,2 个病毒在侵染寄主植物接种叶和系统叶病毒基因组RNA 含量基本相同(图3c)。Western blot 进一步证实,在接种叶和系统叶中病毒TRⅤe2-MCS1-gfp所产生的GFP 量均高于TRⅤe2-gfp-MCS2(图3c)。以上结果表明,病毒TRⅤe2中PEBⅤcp基因亚基因组启动子驱动外源蛋白表达能力强于TRⅤ2b基因亚基因组启动子。
2.4 利用TRVe2表达不同长度的外源蛋白
为了分析病毒TRⅤe2对不同长度外源基因的表达能力,分别将基因gfp(720 bp)、拟南芥三磷酸甘油醛脱氢酶C2 亚基基因GapC2(1 017 bp)、烟草热激蛋白70 基因Hsp70(1 950 bp)克隆至载体pTRⅤe2中, 获 得 载 体pTRⅤ2e2-MCS1-gfp-HA、pTRⅤ2e2-MCS1-GapC2-HA 和 pTRⅤ2e2-MCS1-Hsp70-HA; 病 毒TRⅤe2-MCS1-gfp-HA、 TRⅤe2-MCS1-GapC2-HA 和TRⅤe2-MCS1-Hsp70-HA 接 种接种寄主植物5 d,分别采集寄主植物系统叶用于Northern blot 杂交和Western blot 分析,结果如图4所示。在pTRⅤ2e2载体插入不同长度的基因后,重组病毒基因组RNA2 长度增加(图4a);通过HA抗体在各个病毒接种寄主的系统叶中均能够检测到目的蛋白(图4b)。以上结果表明,病毒TRⅤe2在本氏烟系统叶中至少能表达70 ku 外源蛋白。TRⅤ基因组RNA1 的大小为~6.8 kb,RNA2 大小为~3.9 kb,病毒粒子呈直杆状[20-24,39],本文构建TRⅤ2e2载体中TRⅤ2 基因组大小为~2 kb,病毒TRⅤe2能在整个植株中表达~2.0 kb外源基因,完全符合预期。病毒TRⅤe2在寄主植物中能否表达2.0 kb 以上外源基因、并能在寄主中系统移动的相关工作本实验室正在进行中。

Fig.4 Expression of various proteins in N.benthamiana plants with TRVe2
2.5 TRVe2在寄主中保持稳定
为了分析病毒TRⅤe2携带外源基因后在寄主植物稳定性,取TRⅤe2-MCS1-Hsp70-HA 农杆菌浸润接种10 d寄主系统叶,通过汁液摩擦转接于健康本氏烟中,连续进行3 次转接。分别采集3 次转接寄主系统叶用于病毒基因组杂交和蛋白质检测。结果(图5)表明,TRⅤe2-MCS1-Hsp70 在3 次转接植株中的病毒基因组RNA2积累量与大小与农杆菌浸润接种寄主相比无明显差别,插入到TRⅤ基因组RNA2 中外源基因Hsp70 不丢失;在病毒侵染植株系统叶的总蛋白质中均能检测到Hsp70,并且Hsp70含量在3次转接的植株中含量没有明显差别,病毒TRⅤe2在携带~2.0 kb外源基因后可以稳定存在于寄主植物中,并在整个寄主植物中表达目的蛋白。
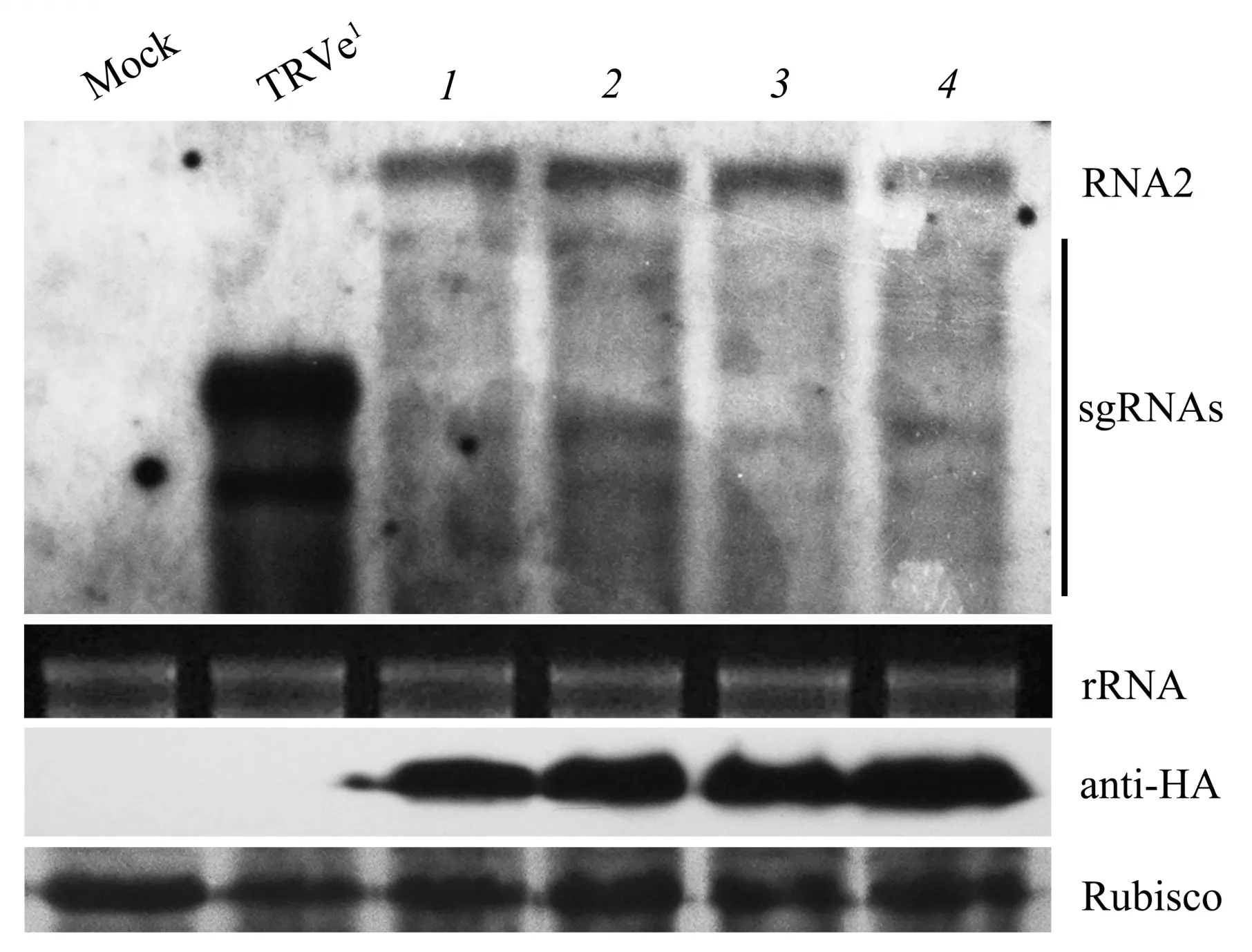
Fig.5 Analysis of stability of TRVe2-MCS1-Hsp70-HA by serial passages in N.benthamiana plants
2.6 利用TRVe2验证CMV 2b基因沉默抑制子的功能
黄瓜花叶病毒(cucumber mosaic virus,CMⅤ)的2b 蛋白是基因沉默抑制子,抑制寄主植物对CMⅤ抗病反应[33]。本文构建病毒载体TRⅤe2-2b-gfp用于验证CMⅤ的2b 蛋白具有抑制基因沉默功能。病毒接种3 d,TRⅤe2-2b-gfp在寄主植物接种叶中荧光强度明显高于TRⅤe2-MCS1-gfp;病毒接种5 d,2 个病毒均扩展至本氏烟的系统叶,并且TRⅤe2-2b-gfp荧光表型强于TRⅤe2-MCS1-gfp(图6a)。在TRⅤe2-2b-gfp侵染本氏烟系统叶能检测到2b蛋白,与TRⅤe2-MCS1-gfp相比,TRⅤe2-2b-gfp侵染植株中GFP 含量增加2.2 倍(图6b)。为了确定病毒TRⅤe2-MCS1-gfp表达CMⅤ2b 蛋白后是否也增加TRⅤ的基因组积累量,分别提取TRⅤe2-MCS1-gfp和TRⅤe2-2b-gfp所侵染寄主植物系统叶总RNA 和siRNA 用于Northern blot 分析。结果表明:TRⅤe2-2b-gfp在本氏烟中的基因组RNA含量是TRⅤe2-MCS1-gfp的4.67 倍(图6c),表明TRⅤe2-2b-gfp引起本氏烟产生更明显的荧光表型是由于TRⅤe2-2b-gfp表达CMⅤ的2b 蛋白增加病毒基因组RNA 所导致.TRⅤe2-MCS1-gfp和TRⅤe2-2b-gfp侵染植株的gfp-siRNA 杂交结果表明,siRNA 在TRⅤe2-MCS1-gfp侵染寄主中含量高于TRⅤe2-2b-gfp(图6d)。以上结果表明,病毒TRⅤe2可用于研究蛋白质的生物学功能。
Fig.6 Application of the TRV-based dual expression vector for analysis of CMV 2b protein involved in antiviral defense response on N.benthamiana plants
2.7 利用TRVe2分析XEG1和Avh52的相互作用
XEG1是来自于大豆疫霉菌的激发子,PⅤX载体表达XEG1蛋白后,在本氏烟上引发植物的防御反应,导致叶片呈现坏死症状,而预先在本氏烟中表达RXLR 效应子Avh52 后再表达XEG1,XEG1引起的细胞坏死反应则被抑制[40]。本文利用质粒pTRⅤ2e2分别构建单独表达XEG1 或Avh52,同时表达XEG1 和Avh52 的载体;农杆菌浸润接种36 h,接种病毒TRⅤe2-XEG1-MCS2 的叶片呈现坏死表型,TRⅤe2-XEG1-Aνh52 侵染的叶片无明显坏死症状,TRⅤe2-MCS1-gfp和TRⅤe2-MCS1-Aνh52 的接种叶均不产生坏死症状(图7a),与Ma等[40]报道的结果相一致。Western blot 结果显示,TRⅤe2-XEG1-MCS2、TRⅤe2-XEG1-Aνh52 和TRⅤe2-MCS1-Aνh52浸润接种的叶片中均能检测到相应目的蛋白(图7b)。以上结果表明,病毒TRⅤe2可用于分析2个蛋白质之间的相互作用。
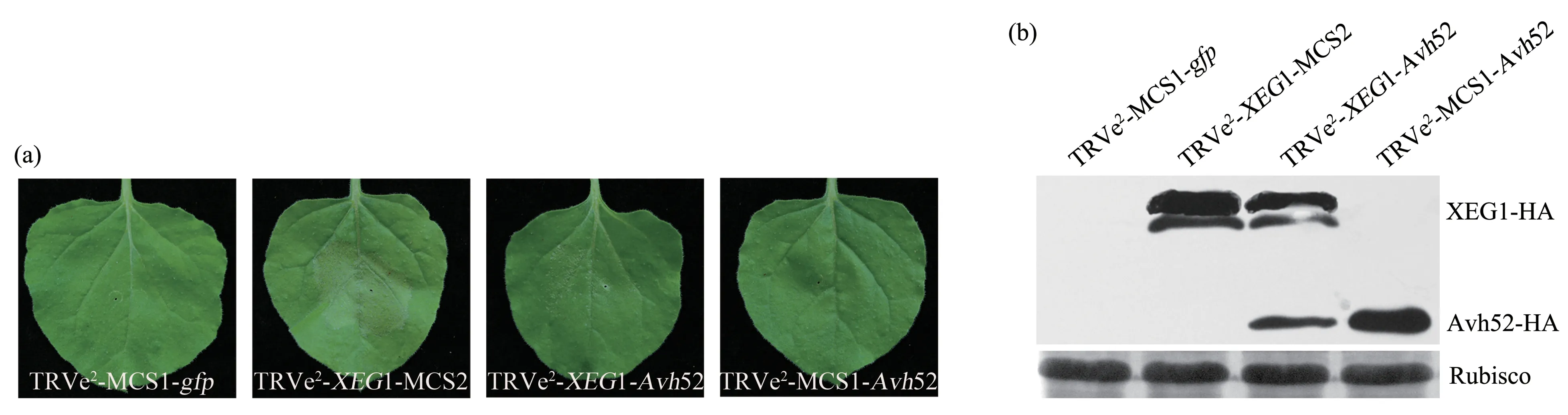
Fig.7 Application of the TRV-based dual vector for analysis of suppression of XEG1-induced cell death in N.benthamiana leaves by RXLR effector Avh52
3 结 论
本文利用TRⅤ基因组RNA2农杆菌侵染性克隆pYL156 构建含有2 个亚基因组启动子的载体pTRⅤ2e2,并用于在本氏烟整个植株中同时表达2个外源蛋白,主要结论如下:a.病毒TRⅤe2能系统性侵染本氏烟,并通过病毒基因组RNA2中的2个亚基因组启动子在整个植株中同时快速、高含量地表达2 个非融合外源蛋白;b.病毒TRⅤe2至少能表达大小为70 ku 非融合外源蛋白;c. 重组病毒TRⅤe2携带外源基因后能在寄主植物保持稳定;d.病毒TRⅤe2可用于快速分析蛋白质的生物学功能以及蛋白质与蛋白质的互作。本文结果为利用植物病毒构建表达多个非融合蛋白载体提供理论指导,表达载体TRⅤe2为快速研究植物的基因功能提供技术工具。
附件PⅠBB_20210180_S1. pdf 见 本 文 网 络 版(http://www.pibb.ac.cn或http://www.cnki.net)