不同生长阶段椰树叶片对椰心叶甲中肠消化酶活性的影响
2017-05-23李艺琼姚羽芯彭正强吕宝乾金启安
李艺琼+姚羽芯+彭正强+吕宝乾+金启安+温海波
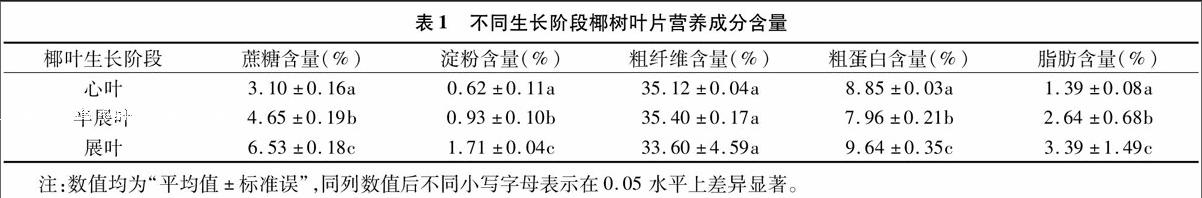

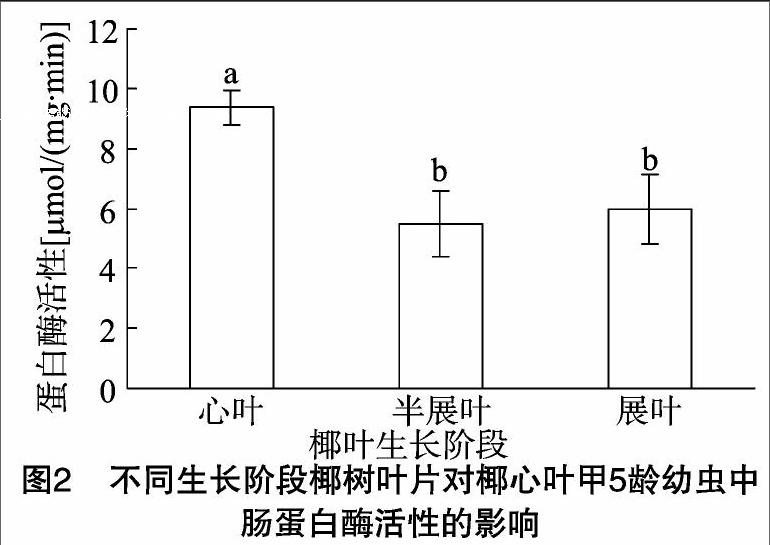
摘要:为探明椰心叶甲对椰树不同生长阶段叶片选择性取食的营养生理机制,研究椰树心叶、半展叶、展叶的营养成分含量差异以及这3个生长阶段叶片对椰心叶甲5龄幼虫中肠6种消化酶活性的影响。结果表明,椰树叶片营养成分中,蔗糖、淀粉、脂肪含量均为心叶中最低,展叶中最高,粗纤维含量无显著差异;椰心叶甲幼虫在取食不同生长阶段的椰树叶片后,中肠消化酶活性有显著变化,取食椰树半展叶、展叶的椰心叶甲5龄幼虫中肠蔗糖酶、淀粉酶、蛋白酶及脂肪酶比取食心叶的椰心叶甲5龄幼虫均有显著下降,而无论是取食椰树心叶、半展叶还是展叶,椰心叶甲5龄幼虫中肠消化酶均为淀粉酶活性最高,蛋白酶次之。
关键词:椰心叶甲;寄主植物;营养物质;消化酶活性
中图分类号: S433.5文献标志码: A文章编号:1002-1302(2017)07-0094-04
椰心叶甲[Brontispa longissima (Gestro)]属鞘翅目(Coleoptera)铁甲科(Hispidae),是棕榈科植物的重要害虫,自2002年入侵海南省后,椰心叶甲迅速扩散繁殖,现已扩散蔓延到海南全省,广东、广西、云南、福建等部分地区也有发生危害[1]。椰心叶甲在我国南方的入侵和暴发严重影响了当地的经济和生态环境[1]。在野外,椰心叶甲成虫和幼虫均取食椰树等寄主未展开的心叶表皮组织,形成与叶脉平行的狭长褐色条斑,心叶展开后呈大型褐色坏死条斑,严重时整株死亡[2]。
植食性昆虫通过取食寄主植物来获取生长发育所需的糖类、蛋白质和脂肪等营养物质。糖类是昆虫重要的植物源营养,同时也是重要的能量来源,特别是在繁殖和飞行方面[3]。蛋白质是植食性昆虫必需的植物源营养,昆虫可以通过取食含有蛋白质的植物来获取氨基酸,而这些氨基酸含有多种用途,如直接用于昆虫蛋白质的生物合成,特别是信息素和神经肽[4]。寄主植物的数量和质量是决定昆虫生长发育和繁殖的最重要因素,每种寄主都含有不同种类和含量的营养物质[5]。Zhang等的研究表明,寄主植物营养成分含量的不同,可显著影响昆虫的生长发育和繁殖[3,6-8]。
昆虫中肠消化酶主要包括α-淀粉酶、蔗糖酶、纤维素酶、半纤维素酶、蛋白酶及脂肪酶[9],用来消化分解通过取食摄入的糖类、纤维素、蛋白质和脂肪。昆虫消化酶在将通过取食摄入的混合食物原料转变成为小分子物质并提供能量及代谢物中扮演着重要的角色[10]。同时,不同寄主植物含有不同含量的营养元素、不同的抑制因子以及次生代谢物质,因此可以影响昆虫的消化酶活性,寄主植物的任何变化都会影响这些消化酶的活性及随后的生理过程[11]。Mardani-Talaee等研究表明,在取食不同寄主植物时,昆虫消化酶活性会发生相应的改变[5,11-15]。
当研究昆虫防治方法时,对目标昆虫的生理学、中肠生理生化反应过程及中肠微生物的深入了解是至关重要的[16]。故本研究从椰树不同生长阶段叶片营养成分含量差异及对中肠消化酶活性的影响出发,探究其寄主选择的营养代谢机制,这对阐明椰心叶甲取食选择性及开发利用酶抑制剂防治椰心叶甲等都具有重要意义。
1材料与方法
1.1试验材料
1.1.1供试虫源供试椰心叶甲为中国热带农业科学院环境与植物保护研究所昆虫饲养室在温度(26±2)℃、湿度(75±5)%条件下,分别以椰树心叶、半展叶、展叶饲养至5龄的椰心叶甲健康虫体。
1.1.2供试寄主植物试验中采用的植物材料为椰树的心叶、半展叶、展叶,均采自海南省儋州市长坡镇椰树林场,试验前将采自田间的叶片清洗干净,晾干后备用。
1.2试验方法
1.2.1不同生长阶段椰树叶片营养成分含量测定测定心叶、半展开叶、完全展开叶的营养成分含量。蔗糖含量测定采用紫外分光光度法[17];淀粉含量测定采用紫外分光光度法[17];粗纤维含量测定采用酸碱剂洗涤法[18];粗蛋白含量测定采用微量凯氏定氮法[19];粗脂肪含量测定采用索氏提取法[20]。
1.2.2酶液制备分别采集心叶、半展开叶和完全展开叶饲养的个体大小一致的椰心叶甲5龄幼虫各10头,在冰浴上解剖取其中肠,置于匀浆器中加入1 mL预先冰浴的蒸馏水在冰浴中匀浆,4 ℃、10 000 r/min离心10 min,取上清液,置于 -20 ℃ 冰箱冷藏,作为酶源备用。样品蛋白含量测定采用考马斯亮蓝G-250染色法[21],以牛血清蛋白(BSA)为标准蛋白。
1.2.3淀粉酶活性测定淀粉酶活性测定采用3,5-二硝基水杨酸法[22],并略加改进。在5 mL试管中分别加入 320 μL 柠檬酸缓冲液(0.1 mol/L,pH值=5)、150 μL酶液以及250 μL 0.1%淀粉溶液,混匀后于35 ℃水浴中温育 30 min,温育结束后加入1 mL二硝基水杨酸(DNS)试剂以停止反应。最后将反应混合物沸水浴10 min,冷却后于540 nm处读取D540 nm。采用麦芽糖标准曲线(y=5.032 6x-0.019 9,r=0.998 1;y为 540 nm 处吸光度;x为麦芽糖浓度,mg/mL)计算样品反应后麦芽糖含量。淀粉酶活性以单位时间、单位质量样品蛋白中麦芽糖的物质的量[μmol/(mg·min)]表示。空白对照以缓冲液代替酶液。
1.2.4蔗糖酶活性测定蔗糖酶活性测定采用3,5-二硝基水杨酸法[23],并略加改进。除反应底物为1%蔗糖,缓冲液为磷酸盐缓冲液(0.2 mol/L,pH值=6.5),反应时间为 60 min,葡萄糖标准曲线(y=6.021 6x+0.008 3,r=0.999 1)外,其余步驟与“1.2.3”节中相同。
1.2.5纤维素酶活性测定纤维素酶活性测定采用3,5-二硝基水杨酸法[24],并略加改进。除反应底物为2%羧甲基纤维素钠(CMC),缓冲液为柠檬酸缓冲液(0.05 mol/L,pH值=6.0),反应时间为60 min,反应温度为50 ℃,葡萄糖标准曲线(y=10.293 0x-0.027 5,r= 0.998 0)外,其余步骤与“123”节中相同。
