胆酸对LPS诱导小鼠乳腺炎的保护作用及其机制
2022-07-25郝浩扬赵才军何兆祺张乃生胡晓宇付云贺
郝浩扬,赵才军,何兆祺,张乃生,胡晓宇,付云贺
(吉林大学 动物医学学院,吉林 长春 130062)
乳腺炎(mastitis)是奶牛养殖过程中最为常见且高发的疾病之一。不仅造成了巨大的经济损失,还严重阻碍了畜牧养殖业的发展[1-2]。乳腺炎是由多种因素引起的乳腺组织的炎症反应,主要临床症状为红、肿、热、痛以及患病乳区发生机能障碍[3]。奶牛乳腺炎的发病原因十分复杂,除了跟养殖场的饲养环境、饲养管理、以及奶牛的年龄与胎次、所处的泌乳阶段、自身遗传因素等相关外[1],主要原因是由细菌、病毒、支原体、真菌致病性微生物感染所致,其中主要的致病菌是金黄色葡萄球菌、大肠杆菌和链球菌等[4-5]。脂多糖(LPS)是大肠杆菌等革兰阴性菌细胞壁的主要组成成分[6]。当大肠杆菌进入乳腺组织后可释放LPS 诱导机体发生炎症反应[6-7]。目前,对于奶牛乳腺炎的治疗,临床上主要以抗生素为主,但抗生素的滥用很容易导致抗生素残留,对公共卫生安全造成威胁[8];另外用药期间和休药期,牛奶的浪费及人工成本的增加,给养殖业带来巨大的经济损失。因此,寻找安全有效的药物或制剂来代替抗生素防治乳腺炎,具有至关重要的意义。
胆汁酸是由肝脏合成的一类氮烷酸衍生物,是肝细胞中胆固醇分解代谢的终产物[9]。胆汁酸根据存在形式可以分为游离型胆汁酸和结合型胆汁酸,胆酸(CA)广泛存在于多种动物胆汁酸,由肝脏中的胆固醇直接合成,属于游离型胆汁酸[10]。CA参与肝肠循环,是肝脏疾病诊断的一个重要依据[11]。在过去的研究中,CA被证实具有抑菌、抗炎的作用[10]。CA还具有乳化脂肪的作用,通过使脂肪与胰脂酶接触的表面积增大,促进脂肪消化[12]。在不同的组织器官中,CA也发挥着不同作用,在神经系统中CA可以起到镇静、镇痛的作用;在呼吸系统中CA具有镇咳平喘、舒张平滑肌的作用[13];在肌肉组织中CA具有解痉的作用;在循坏系统中CA具有降血压、调节心脏搏动的作用。同时CA还具有抗病毒活性、抗真菌活性、解热的作用[9,14]。然而,关于CA对乳腺炎的作用及潜在机制尚未见报道。因此,本试验采用LPS诱导的小鼠乳腺炎模型探索CA对乳腺炎的防治作用及潜在机制。
1 材料方法
1.1 主要试剂LPS(大肠杆菌,血清型O55:B5)和CA购自Sigma公司;髓过氧化物酶(MPO)测定试剂盒购自南京建成科技有限公司;小鼠肿瘤坏死因子(TNF-α);白介素-1β (IL-1β)ELISA试剂盒购自Biolegend公司;p65、IκB、p-p65、p-p38、p-IκB、β-actin、法尼醇X受体(FXR)抗体购自Immunoway公司;羊抗兔、羊抗鼠二抗购自爱必信公司。
1.2 主要仪器电子天平购自德国Sartonus公司;电泳仪购自北京六一仪器厂;100 μL微量注射器购自上海高鸽公司;高速离心机购自长沙湘仪离心机仪器有限公司;酶标仪购自美国Tecan公司;金属恒温加热器购自上海一恒科技有限公司;显影仪购自上海天能科技有限公司。
1.3 实验动物6~8周龄BALB/c小鼠购自辽宁长生生物技术股份有限公司,适应环境1周后以雌性∶雄性比例为3∶1合笼饲养,每天给予充足的饮食饮水,分娩后的母鼠用于构建乳腺炎动物模型。所有实验动物的饲养及操作均通过吉林大学实验动物管理与使用委员会的批准,符合动物福利要求。
1.4 小鼠乳腺炎模型建立分娩5~7 d的母鼠用于构建小鼠乳腺炎动物模型。提前3 h将仔鼠与母鼠分离,用10%乌拉坦将母鼠麻醉,并将母鼠仰卧保定在操作台上,消毒并暴露第4对乳腺及周围皮肤。左手持无菌眼科镊夹取乳头并固定,右手用灭菌眼科剪剪除1 mm左右乳头尖端,暴露乳导管。用微量注射器吸取 0.2 g/L的LPS 100 μL,沿乳头导管缓慢灌注到乳腺内,左右各50 μL。对照组灌注相同体积PBS。LPS刺激24 h后,断颈法处死小鼠,75%酒精消毒腹部皮肤后,沿腹中线剪开腹部皮肤,暴露第4对乳腺并收集乳腺组织。取适量乳腺组织浸泡在4%多聚甲醛中固定,用于HE染色观察乳腺组织病理学变化,其余组织-80℃冻存备用。
1.5 实验动物分组及处理将40只分娩5~7 d的母鼠随机分为5组:空白对照组、LPS组、LPS+CA(10 mg/kg)组、LPS+CA(20 mg/kg)组和LPS+CA(30 mg/kg)组,在LPS造模前3 h腹腔注射CA,空白对照组、LPS组腹腔注射等量PBS。
1.6 乳腺组织病理学观察及炎症评分LPS处理24 h后,收集小鼠乳腺组织固定于4%多聚甲醛溶液中,通过脱水透明、浸蜡包埋、切片、贴片、脱蜡、苏木精和曙红染色、脱水透明和封固完成切片制备,并在光学显微镜下观察组织病理学变化。
1.7 MPO检测称取小鼠乳腺组织,研磨,制备组织匀浆。根据MPO检测试剂盒说明书配制试剂,完成组织样品MPO测定。最后通过测量在460 nm 处的D值,计算酶活力。
1.8 细胞炎性因子检测称取小鼠乳腺组织,以(1∶9)的比例用PBS制备组织匀浆,将制备好的组织匀浆于4℃、12 000 r/min离心10 min,收集上清液,并根据ELISA试剂盒说明书对细胞因子浓度进行检测。
1.9 Western blot检测提取乳腺组织中的总蛋白。进行10% SDS-PAGE凝胶制备,完成电泳,然后将携带蛋白质的PVDF膜在室温下用5%脱脂乳封闭3 h,将小鼠 NF-κB p65、p-NF-κB p65、IκB、p-IκB、FXR抗体按1∶1 000比例稀释,β-actin抗体按1∶4 000稀释,4℃孵育过夜。TBST洗涤3次,辣根过氧化物酶标记二抗室温孵育2 h,TBST洗涤3次,最后用显影仪读取图像。
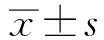
2 结果
2.1 CA缓解LPS诱导的小鼠乳腺组织病理损伤通过在光学显微镜下观察,空白对照组乳腺组织腺泡壁完整,腺泡内无炎性细胞浸润(图1A)。与对照组相比,LPS组小鼠乳腺腺泡结构遭到破坏,腺泡内有大量炎性细胞浸润(图1B)。然而,与LPS组相比,随着CA浓度的增加乳腺组织结构逐渐恢复正常,炎性细胞数量显著减少(图1C~E)。结果表明,补充CA可以有效改善LPS诱导的小鼠乳腺组织病理性损伤。
2.2 CA降低LPS诱导的小鼠乳腺组织MPO活性对MPO活性检测结果如图2所示,与对照组相比,LPS组小鼠乳腺组织中MPO活性显著增加。CA呈剂量依赖性降低LPS诱导的小鼠乳腺组织中MPO活性。
2.3 CA降低LPS诱导的小鼠乳腺组织炎性细胞因子的表达利用ELISA试剂盒检测小鼠乳腺组织中促炎因子TNF-α和IL-1β的浓度。结果表明,与对照组相比,LPS组小鼠乳腺组织中促炎因子TNF-α和IL-1β的表达显著升高。而不同浓度的CA处理后,乳腺组织中TNF-α和IL-1β的浓度显著低于LPS组(图3)。

图3 CA对LPS诱导小鼠乳腺组织TNF-α和IL-1β表达的影响
2.4 CA抑制LPS诱导的小鼠乳腺组织NF-κB信号通路活化NF-κB信号通路是一条重要的与炎症信号传导相关的通路,因此本试验检测了相关蛋白的表达。结果表明,与对照组相比,LPS组小鼠的乳腺组织中磷酸化p65和磷酸化IκB的表达显著上调,CA干预后,呈剂量依赖性地抑制了乳腺组织的磷酸化p65和磷酸化IκB的表达。表明CA可以通过抑制NF-κB信号传导的活化进而发挥抗炎的作用(图4)。

图4 CA对LPS诱导小鼠乳腺组织中NF-κB信号通路的影响
2.5 CA增加乳腺组织中FXR表达FXR是与胆汁分泌相关的常见受体,主要受初级胆汁酸的调节[15]。有研究表明FXR的激活具有抗炎的作用,同时发现胆汁酸能够依赖FXR的激活抑制NF-κB活化。本研究发现, LPS组小鼠乳腺组织中FXR表达降低,而CA处理组FXR的表达呈剂量依赖性增加(图5)。
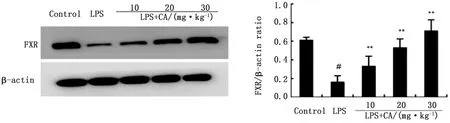
图5 CA对LPS诱导小鼠乳腺组织中FXR受体表达的影响
3 讨论
乳腺炎泛指发生在乳腺组织的炎症,是制约奶牛养殖业发展的重大疾病之一[16]。目前在临床上奶牛乳腺炎以使用抗生素治疗为主,容易导致抗生素滥用、抗生素残留等问题,对公共卫生事业造成了严重的威胁。同时在用药期和休药期,造成的乳汁浪费、人工成本增加等现象,给养殖业带来了巨大的经济损失[17]。CA作为胆固醇的主要代谢产物,广泛存在于多种动物胆汁,易提取易合成,并且其具有较强的抗炎能力[11]。然而关于CA在乳腺炎中的作用还尚未见报道。因此本研究探讨了CA对LPS诱导小鼠乳腺炎的保护作用及机制。
乳腺炎主要表现出乳腺组织的病理性损伤以及炎性细胞,特别是中性粒细胞的浸润[18]。病理学检测结果显示,CA呈剂量依赖性地降低了LPS诱导的小鼠乳腺组织腺泡结构的改变以及大量炎性细胞浸润。当炎症发生时,大量的中性粒细胞能被趋化性物质诱导到炎症部位[19]。同时在中性粒细胞内含有一定量的MPO,因此MPO活性通常用来评估中性粒细胞的浸润情况[20]。本研究发现LPS刺激导致小鼠乳腺组织中MPO活性显著增加,而CA可呈剂量依赖性的降低LPS诱导的小鼠乳腺组织中MPO活性的增加。此外,乳腺组织中炎性细胞因子的大量释放是导致乳腺组织损伤的重要因素。TNF-α是炎症反应过程中出现最早的炎性介质,使血管内皮细胞通透性增加,调节其他组织代谢活性并促进使其他细胞因子的合成和释放[21]。IL-1β是一种在多种细胞中产生的促炎细胞因子,包括单核细胞、组织巨噬细胞、B淋巴细胞、中性粒细胞、自然杀伤性细胞以及角质形成细胞等非免疫细胞[22-23]。在本试验中,LPS刺激导致小鼠乳腺组织中TNF-α和IL-1β的浓度显著升高,而CA干预后小鼠乳腺组织中TNF-α和IL-1β浓度显著下调。因此,CA干预可以抑制乳腺组织中促炎细胞因子的表达,缓解LPS诱导的乳腺炎症。
NF-κB是一种可以在许多细胞表达的转录因子,其主要由IkB,p65等转录因子组成,激活后可以参与机体的炎症反应、免疫应答,并且发现抑制NF-κB信号传导已成为一种新的可以治疗肠炎、关节炎、动脉粥样化等多种疾病的方式[24-26],同时在多种LPS炎症模型中,其发挥着重要作用[4],因此在本试验中,检测了相关的蛋白表达。结果发现在LPS诱导的小鼠乳腺炎模型中和p-p65和p-IκB的表达水平增加,CA可以降低p-p65和p-IκB的表达水平,进而抑制NF-κB的活性。
FXR 是核受体超家族的一员,是配体激活的转录因子。有研究报道,激活FXR受体可以抑制LPS诱导的炎症反应[27]。同时,FXR激动剂可以抑制NF-κB信号通路。本研究结果表明,CA 可以呈剂量依赖性地上调FXR的表达,从而发挥抗炎作用。
综上所述,CA对LPS诱导的小鼠乳腺炎具有保护作用,这一作用可能是通过增加FXR受体表达,进而抑制NF-κB 信号通路来实现的。
