稳定表达猪CD163受体的MARC-145细胞系的构建
2022-07-25刘文波任同伟欧阳康黄伟坚韦祖樟
吕 静,刘文波,刘 畅,任同伟,陈 樱,欧阳康,黄伟坚,韦祖樟
(广西大学 动物科学技术学院,广西 南宁530005)
猪繁殖与呼吸综合征(PRRS),是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种急性传染病,俗称“猪蓝耳病”。该病可导致怀孕母猪流产、产死胎、弱胎、木乃伊胎、返情等繁殖系统障碍、仔猪高死亡率、各年龄段猪只不同程度的呼吸道症状及食欲减退、并能引起免疫抑制和持续感染[1-3],给全球的养猪业带来了巨大的经济损失。我国于1995年开始暴发此病,郭宝清等[4]首次从流产胎儿中分离到美洲型PRRSV,并命名为CH-1a。2006年我国多地暴发高致病性PRRS,由高致病性PRRSV(HP-PRRSV)引起,感染了超过200万头猪,死亡病例约40万头,发病率和死亡率较经典型PRRS均明显升高[5-6]。2013年起,与NADC30毒株高度同源的毒株不断被分离并报道,其nsp2区域存在不连续缺失了131个氨基酸[7],统称这类毒株为NADC30-like毒株。我国现在流行的毒株主要为美洲型,其中主要优势流行毒株为谱系8毒株(HP-PRRSV-like)、谱系1毒株(NADC30-like)和谱系3毒株(QYYZ-like)。
PRRSV不论在体内还是体外均表现出严格的细胞嗜性。在体内,PRRSV主要感染猪肺泡巨噬细胞(PAMs);在体外,PRRSV只在原代PAMs和MA104以及衍生细胞系MARC-145中繁殖[8]。研究发现PRRSV通过结合细胞受体进入易感细胞,目前已经发现的细胞受体主要有:唾液酸黏附素(sialoadhesin,Sn)、硫酸乙酰肝素(heparin sulphate,HS)、波形蛋白(vimentin)、CD163分子、CD151分子及非肌肉肌球蛋白重链ⅡA分子[9]。CD163分子是大小约130 kDa的糖蛋白,富含半胱氨酸,其主要介导PRRSV在细胞质中的脱衣壳和病毒基因组的释放[10-11],并且已经确定CD163分子的病毒结合区为清道夫受体半胖氨酸富含结构域(SRCR)5-9[12]。现已成功建立的稳定表达pCD163的细胞系有:HEK-293-pCD163细胞系[13]、PAM-CD163细胞系[9]、CHO-K1-CD163细胞[14]、MARC-145-CD163细胞系[15]、PK-15-CD163细胞系[16]、BHK-21-CD163细胞系[17]等。已有报道通过普通单质粒载体方法构建出MARC-145-CD163细胞系。本研究通过慢病毒病毒载体的方法构建稳定表达pCD163受体的MARC-145细胞系,该方法宿主细胞广泛,转染、转导效率更高,该细胞系可用于高效、快速地增殖PRRSV毒株,为PRRSV的分离和相关研究奠定基础。
1 材料与方法
1.1 质粒、细胞和病毒慢病毒载体pLVX-IRES-mCherry购自生物风生物科技有限公司;VSVG质粒、psPAX2质粒、MARC-145细胞、293T细胞、PAMs细胞、PRRSV毒株(GXNN1396、GXNN202004a、GXGG202007)均由广西大学动物科学技术学院动物传染病与分子免疫学实验室保存;DH5α感受态细胞购自北京全式金生物技术有限公司。
1.2 主要试剂限制性内切酶XbaⅠ和BamHⅠ购自NEB公司;Reverse Transcriptase M-MLV(RNase H-)、TaKaRa LA Taq®、dNTP Mixture、T4DNA连接酶购自宝生物工程有限公司;Plasmid Mini Kit、Gel Extraction Kit、HP Total RNA Kit购自OMEGA公司;Lipofectamine 2000、fluorescein goat anti-mouse IgG(H+L)购自Invitrogen公司;细胞培养基MEM、新生胎牛血清(FBS)、DMEM粉剂、0.05%Trypsin-EDTA、0.25%Trypsin-EDTA购自Gibco公司;Mouse anti-porcine CD163购自Bio-Rad公司;辣根过氧化物酶(HRP)标记山羊抗小鼠 IgG(H+L)购自碧云天生物技术有限公司;ECL Western blot Kit购自康为世纪有限公司。
1.3 引物设计与合成根据GenBank公布的pCD163基因序列(登录号:HM991330)利用Primer Premier 5.0软件设计1对扩增pCD163受体基因序列的特异性引物,并在引物的上、下游分别引入酶切位点XbaⅠ和BamHⅠ。引物序列如下:pCD163-F:5′-CGATCTAGAATGGACAAACTCAGAATGGTGCTAC-3′,pCD163-R:5′-CGAGGATTCT-CATTGTACTTCAGAGTGGTCTCCTG-3′,下划线为内切酶识别位点,引物由北京擎科生物科技有限公司合成。
1.4 总RNA的提取及pCD163基因的扩增使用HP Total RNA Kit试剂盒提取PAMs总RNA,以总RNA为模板反转录得到cDNA。以cDNA为模板进行PCR扩增。PCR反应体系:10× LA Buffer 5 μL,dNTP Mixture 4 μL,pCD163-F 2 μL,pCD163-R 2 μL,TaKaRa LA Taq 1 μL,ddH2O 35 μL,cDNA 1 μL。反应条件:95℃预变性5 min;95℃变性45 s,63℃退火45 s,72℃延伸3 min 30 s,35个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定正确后切胶纯化回收。
1.5 重组质粒pLVX- pCD163-IRES-mCherry的构建及鉴定pCD163胶回收产物及慢病毒表达载体pLVX-IRES-mCherry分别使用XbaⅠ和BamHⅠ双酶切后纯化回收,经T4DNA连接酶16℃过夜连接后,转化DH5α感受态细胞,涂布于氨苄抗性的LA平板,37℃培养12~16 h。挑取单个菌落于含氨苄抗性的LB培养基中扩大培养,次日抽提质粒,经XbaⅠ和BamHⅠ双酶切鉴定后,将阳性质粒送华大基因测序,测序正确的重组质粒命名为pLVX-pCD163-IRES-mCherry。
1.6 重组质粒pLVX-pCD163-IRES-mCherry转染293T细胞将293T细胞传代于6孔板培养,待细胞密度达到80%~90%时,按照Lipofectamine 2000说明书,将重组质粒pLVX-pCD163-IRES-mCherry:psPAX2∶VSVG=5 μg∶3.5 μg∶1.25 μg 的比例共转染293T细胞。转染后48 h观察细胞及荧光表达情况,收集上清慢病毒感染液后添加2 mL新鲜10% FBS DMEM培养基;72 h再次收取细胞上清液,3 000×g离心10 min,-80℃保存。
1.7 慢病毒转导及细胞筛选将MRAC-145细胞接种于6孔板中培养,细胞密度达到80%~90%时,使用48 h慢病毒感染液感染MARC-145细胞,37℃孵育4~6 h,间隔1 h摇板1次,弃去感染液,加入新鲜的2% FBS DMEM培养基,置于37℃、5% CO2细胞培养箱培养,同时设置未感染的MARC-145细胞为阴性对照。感染96 h后,加入嘌呤霉素进行筛选,嘌呤霉素质量浓度为16 mg/L。每天观察细胞状态,3 d左右更换1次含有嘌呤霉素的新鲜培养基,待阴性对照细胞全部死亡后,终止筛选。将药物筛选后存活的细胞消化为单个细胞,进行细胞计数,使用终点稀释法稀释细胞,接种于96孔板,使每个孔细胞数为0~1个,培养10~14 d。待96孔板中细胞长满后,在荧光显微镜下观察,选取具有红色荧光的单克隆细胞株移至12孔板中培养,待细胞长满后对孔中部分细胞进行鉴定。
1.8 RT-PCR检测MARC-pCD163细胞系中CD163表达使用0.25%胰酶消化筛选到的MARC-pCD163细胞系,取部分细胞裂解,其余细胞继续培养。裂解后的细胞使用HP Total RNA Kit试剂盒抽提细胞总RNA,同时设置MARC-145细胞为阴性对照。反转录得到cDNA,PCR扩增CD163受体序列,PCR反应体系及条件按照1.4方法进行。1%琼脂糖凝胶电泳鉴定RT-PCR产物,凝胶成像系统观察分析结果。
1.9 间接免疫荧光(IFA)检测MARC-pCD163细胞系中pCD163表达将RT-PCR鉴定阳性的细胞株继续传代至12代接种于6孔细胞培养板。待细胞密度达100%时,PBS洗涤3次,冰甲醇4℃固定30 min;加入1% BSA常温封闭30 min,PBS洗涤3次;加入1∶300倍稀释后的小鼠抗pCD163单克隆抗体,37℃孵育2 h后,PBS洗涤5次,每次5 min;加入1∶500稀释的Alexa Fluor 568标记的山羊抗鼠IgG(H+L)二抗,37℃避光孵育1 h,PBS洗涤5次,每次5 min,置于荧光显微镜下观察结果。设置MARC-145细胞作为阴性对照。
1.10 Western blot检测MARC-pCD163细胞系中CD163表达情况分别将MARC-pCD163细胞及MARC-145细胞接种于6孔细胞培养板培养48 h,弃去培养基,PBS洗涤3次,加入配置好的RAPI裂解液(RAPI∶PMSF=100∶1)于冰上裂解20 min,4℃、12 000 r/min离心10 min,收集上清液加入5×loading buffer,于沸水中煮10 min。样品经12% SDS-PAGE后,按照Bio-Rad公司半干转仪操作说明进行电转印。转印后的PVDF膜置于5%脱脂奶粉中常温封闭2 h,加入1∶300稀释的小鼠抗pCD163单克隆抗体,4℃过夜孵育;TBST洗膜5次,每次5 min;加入1∶1 000稀释的HRP标记山羊抗小鼠 IgG(H+L),室温振荡孵育1 h,TBST洗膜5次,用ECL Western blot Kit试剂盒显色后观察结果。
1.11 MARC-pCD163细胞对不同PRRSV毒株增殖能力的测定将MARC-pCD163细胞与MARC-145细胞同时感染0.1 MOI的不同谱系PRRSV毒株GXNN1396(lineage 8)、GXNN202004a (lineage 1)、GXGG202007 (lineage 3),分别于感染后24,48,72,96,120 h收取300 μL细胞上清。将收获的病毒液进行10倍梯度稀释,取10-1,10-2,10-3,10-4,10-5,10-6,10-77个稀释梯度,每个稀释度设置8个重复,同时设置未接毒组作为对照,每天观察细胞病变(CPE)情况,按照Reed-Muench法计算每个时间点待测病毒TCID50值,绘制病毒增殖曲线。
2 结果
2.1 重组慢病毒质粒pLVX-pCD163-IRES-mCherry的构建和包装以反转录的cDNA为模板PCR扩增获得pCD163基因,经1%琼脂糖凝胶电泳可见约3 348 bp的目的条带(图1A)。将pCD163基因克隆至pLVX-IRES-mCherry中,重组质粒经XbaⅠ和BamHⅠ双酶切得到预期大小的片段(图1B),测序结果表明pLVX-pCD163-IRES-mCherry质粒构建成功。将重组质粒pLVX-pCD163-IRES- mCherry与包装辅助质粒psPAX2、VSVG共转染293T细胞,48,72 h均可观察到红色荧光,表明慢病毒包装成功。
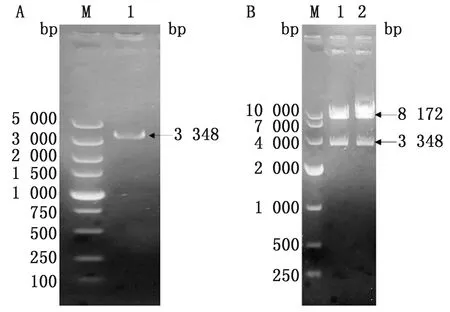
A.pCD163基因PCR扩增片段(M.DL5000 DNA Marker;1.pCD163基因PCR扩增产物);B.重组质粒的双酶切鉴定(M.DL10000 DNA Marker;1,2.pLVX-pCD163-IRES-mCherry质粒XbaⅠ/BamHⅠ酶切产物)
2.2 细胞系的筛选与鉴定慢病毒感染MARC-145细胞后,经过嘌呤霉素筛选,存活细胞经终点稀释法接种于96孔细胞培养板,10~14 d可见明显细胞克隆团。将显微镜下观察有红色荧光的细胞株扩大培养,抽提细胞总RNA,RT-PCR扩增pCD163基因,可见在3 348 bp处有相符目的条带(图2)。将RT-PCR鉴定正确的细胞传至12代,IFA可以观察到MARC-pCD163细胞呈特异性的绿色荧光,而MARC-145细胞无绿色荧光(图3)。收取细胞总蛋白,Western blot试验检测到MARC- pCD163细胞在130 kDa左右处有目的条带,而MARC-145细胞未检测到条带(图4)。上述结果表明成功筛选出稳定表达猪CD163受体蛋白的MARC-145细胞系。
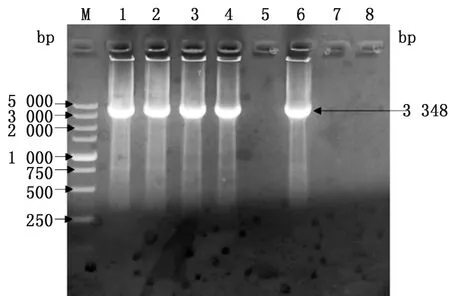
M.DL5000 DNA Marker;1~6.细胞系的RT-PCR产物;7.MARC-145细胞的RT-PCR产物;8.阴性对照
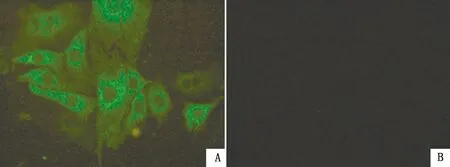
A..MARC-pCD163细胞;B.MARC-145细胞

1.MARC-pCD163细胞系;2.MARC-145细胞
2.3 MARC-pCD163细胞对不同PRRSV毒株增殖能力的测定将MARC-pCD163细胞与MARC-145细胞同时感染0.1 MOI的3个不同谱系的PRRSV毒株,测定不同时间点的TCID50,绘制3株毒株的生长曲线,结果见图5。3株毒株在MARC-pCD163细胞与MARC-145细胞上最高滴度相近,但在MARC-145细胞上最高滴度出现的时间为96 h,MARC-pCD163细胞上最高滴度出现的时间为48 h,结果表明MARC-pCD163细胞能显著加快病毒最高滴度出现的时间。
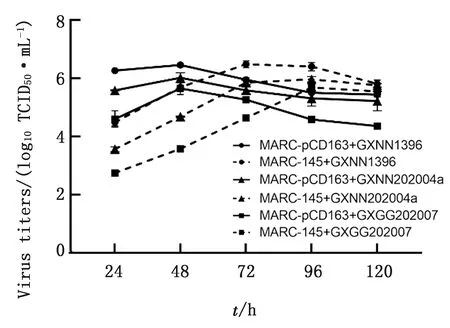
图5 PRRSV在MARC-pCD163和MARC-145细胞中的增殖图
3 讨论
pCD163分子已被鉴定为两种基因型PRRSV的细胞受体[18]。GORP等[19]用Sn和pCD163抗体同时孵育PAM细胞,能阻断PRRSV感染PAM细胞,但单独的pCD163抗体不能阻断PRRSV感染细胞,表明Sn与pCD163具有协同作用,但pCD163分子不介导PRRSV内化。DELRUE等[20]研究表明单独表达Sn的细胞能够吸附并內吞PRRSV,但PRRSV不能脱衣壳,但同时表达Sn和pCD163分子的细胞则能产生子代PRRSV,表明pCD163分子参与病毒的脱衣壳过程。流式细胞试验表明,PRRSV感染性与pCD163表达量之间存在直接正向关系[21],且试验证明PRRSV非敏感细胞(BHK-21、LLC-PK1、PK-15等)中过表达pCD163,能使非敏感细胞被PRRSV感染并能产生高滴度的子代病毒[8]。目前,常用MA104以及衍生细胞系MARC-145进行PRRSV毒株分离。然而,有些PRRSV毒株,特别是近年流行的NADC30-like毒株,在传代细胞系中复制能力弱,产生滴度低,难以获得在细胞系中稳定传代的病毒。而这些毒株在PAM中有较好的复制能力。为此,本试验设计特异性引物扩增pCD163基因序列,从PAM细胞中经RT-PCR扩增得到pCD163基因,构建了稳定表达pCD163的MARC-145细胞系。尽管不同谱系的PRRSV毒株在MARC-pCD163和MARC-145均能产生同样高的病毒量,但PRRSV毒株在MARC-pCD163细胞中最高病毒滴度出现的时间早于48 h,为以后PRRSV毒株的分离培养和受体功能奠定了基础。
目前,构建基因过表达稳转细胞系的载体主要有普通单质粒载体、逆转录病毒载体和转座子载体等[9]。慢病毒载体属于逆转录病毒的一种,对处于分裂期和非分裂期的细胞均具有感染能力,能够感染多种类型的细胞,且能携带大片段的外源基因在逆转录酶的作用下高效地整合至目的细胞染色体中[22]。目前所应用的慢病毒属于复制缺陷型病毒,具有良好的生物安全性,是一种理想的用于建立稳定细胞系的基因转移载体。常用的慢病毒表达系统为第1代的3质粒表达系统和第2、3代的4质粒表达系统,其中第2、3代的4质粒表达系统生物安全性更好。293T细胞是由293细胞通过基因技术衍生出的细胞系,具有生长速度快、易转染、蛋白表达水平高等优点,被广泛应用于病毒包装,但293T细胞贴壁性不强,在培养293T细胞及使用293T包装慢病毒时需要特别注意。本试验选用慢病毒载体pLVX-IRES-mCherry,载体本身带有嘌呤霉素抗性基因和红色荧光蛋白标记基因,可以通过在荧光显微镜下观察红色荧光,从而更加直观地观察监测慢病毒包装、慢病毒感染目的细胞及使用嘌呤霉素筛选细胞的情况。本试验通过慢病毒表达系统,成功构建了稳定表达猪pCD163受体蛋白的MARC-145细胞系,PRRSV在MARC-pCD163细胞中的增殖速度及病毒滴度均有所提高,为今后的PRRSV分离培养和生物学特性及PRRSV细胞受体的研究奠定基础。
