山奈酚对急性酒精性肝损伤小鼠的肝保护作用研究
2022-07-23徐亚鹏寇文龙张钰婷邢圆圆张文奎
徐亚鹏,寇文龙,张钰婷,邢圆圆,卢 燕,张文奎
(河南理工大学医学院,河南 焦作 454002)
急性酒精性肝损伤发病机制复杂,乙醇及其毒性代谢产物、脂质过氧化、氧化应激、炎性反应等均参与其中[1]。在我国,酒精性肝病仅次于病毒性肝炎,已成为引起肝功能损害的第二大病因[2]。酒精性肝损伤目前没有较好的临床治疗策略,因此寻找此类疾病的药物显得尤为迫切。山奈酚(Kaempferol,Kae)是一种广泛存在于水果和蔬菜中的黄酮类化合物,可通过提高人体对抗自由基能力起到抗氧化作用[3]。但是山奈酚是否对急性酒精性肝损伤具有保护作用尚不明确。ALT和AST时肝损伤疾病的敏感指标,主要存在于细胞浆内,AST还存在于线粒体中,当肝细胞严重受损时,因肝细胞通透性增加。胞浆内的ALT及线粒体内的AST则释放入血,导致血液中的ALT及AST的表达水平大幅升高[4],因此可以采用这两个指标评价小鼠肝脏的损害程度。
本研究拟通过一次性酒精灌胃建立小鼠急性酒精性肝损伤模型,通过检测血清中ALT、AST含量、观察肝脏切片形态评价山奈酚对小鼠肝脏的保护作用。
1 材料与方法
1.1 实验动物
健康C57BL/6J小鼠30只,雄性,八周,体重25g~30g,由河南斯克贝斯生物科技股份有限责任公司提供,许可证号:SCXK(豫)2020-0005,合格证号:410000000000001195。
1.2 主要试剂及仪器
山奈酚(诺斯夫生物技术有限公司提供),无水乙醇,羧甲基纤维素钠(上海阿拉丁生化科技股份有限公司提供)水合氯醛,福尔马林溶液,精密分析天平(Mettler Toledo)、低温离心机(安徽嘉文仪器装备有限公司)、自动生化分析仪
1.3 动物分组、给药与造模
实验小鼠饲养环境 23℃~ 25℃,30只健康雄性C57BL/6J小鼠适应性喂养一周。按体重随机分为对照组、酒精组及给药组(山奈酚低、中、高三个剂量组)共五组,每组6只。
将山奈酚溶于羧甲基纤维素钠,超声震荡使其溶解,每天中午预防性给药三天,对照组、酒精组分别按与给药组等体积灌服生理盐水,其余各组分别灌服相应剂量山奈酚,其中低剂量组40mg/kg,中剂量组50mg/kg,高剂量组60mg/kg),每只小鼠灌胃体积为0.5ml,第4天除对照组外其余各组均按12 ml/kg剂量一次性灌胃60%酒精(用无水乙醇稀释,下同)造模[5]建立小鼠急性酒精性肝损伤模型,灌胃60%酒精后小鼠禁食不禁水,灌胃后观察小鼠精神状态并记录醒酒时间。
6h后每只小鼠给予5%水合氯醛进行腹腔注射麻醉,眼眶静脉丛取血,采集血液,置于EP管内,室温静置1h后,5000r/min离心15min,取上清液,分装于EP管内,于-80℃冰箱中保存。取血结束后,快速摘取肝脏组织,并固定于10%福尔马林溶液中。
1.4 指标检测及方法
1.4.1 状态观察
观察各组动物的一般情况,包括醒酒时间、精神、活动状况、饮食、排便、翻正反射等,有任何异常情况及时记录。
1.4.2 血清生化指标测定
第4天灌胃酒精造模成功6h后,眼球静脉取血,血液静置1 h,4℃低温下进行离心,5000 r/min离心15min后取上清液,测试ALT、AST浓度。
1.4.3 肝脏组织病理学观察
取相同的小鼠肝脏部位,经酒精梯度脱水,石蜡包埋,预冷切片,苏木精-伊红染色处理后,在400倍显微镜下观察肝脏组织形态变化。
1.5 统计学方法
采用GraphPadPrism6.01统计软件进行差异显著性分析,计量资料以(Mean&SEM)表示,各组间比较采用(oneway ANOVA)检验。检验水准:a=0.05,双侧检验。
2 结果
2.1 状态观察
造模前小鼠生活状态正常,进食进水正常,毛色光泽,黑褐色颗粒样大便。给予酒精造模后,除空白组外,其余各组小鼠先表现为行动缓慢,翻正反射消失,进入嗜睡醉酒状态,进食少,毛散乱。灌胃4h后给药高剂量组小鼠逐渐苏醒,其他各给药组小鼠也逐渐苏醒,模型组小鼠仍处于嗜睡醉酒状态。
2.2 小鼠血清ALT、AST数值统计(x±SD)
从表1中观察可以得出各给药组降低ALT、AST水平随着剂量增大而增强。

表1 小鼠血清ALT、AST数值统计表
2.3 山奈酚对酒精性肝损伤小鼠血清AST、ALT的影响
如图1所示,与对照组(control)相比,模型组(alcohol)小鼠血清中的AST、ALT水平显著升高(P<0.05),说明本研究成功建立了急性酒精性肝损伤的模型。与模型组相比各给药组均可以抑制AST、ALT水平,在降低AST水平上高剂量组具有明显优势。
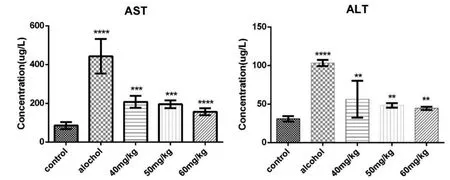
图1 山奈酚对酒精性肝损伤小鼠血清AST、ALT的影响
2.4 山奈酚对酒精性肝损伤小鼠肝组织形态的影响
由图2可以看出,空白对照组小鼠肝脏组织形态结构完整,未出现明显病变坏死和炎症,肝细胞排列整齐,红细胞未见渗出。模型组细胞出现大量坏死,细胞破裂,细胞核渗出,炎症浸润严重。给药组可明显改善酒精性肝损伤,肝索排列整齐,细胞形态趋于正常、红细胞未渗出,无明显炎症浸润。
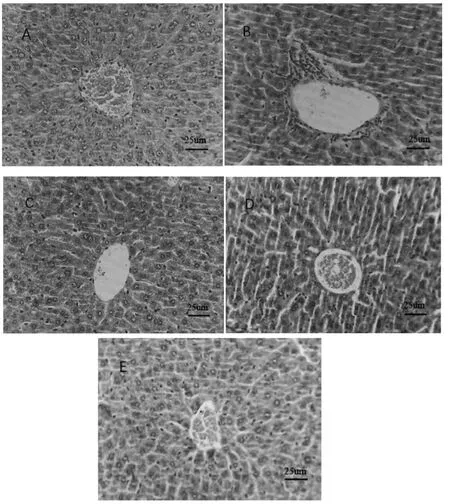
图2 酒精性肝损伤小鼠的肝脏组织形态学观察(苏木精-伊红染色,×400)A:空白组;B:模型组;C:山奈酚低剂量组;D:山奈酚中剂量组;E:山奈酚高剂量组.标尺=25um
3 讨论
酒精性肝病(alcoholic liver disease,ALD)是指长期过量饮酒导致的肝脏疾病,包括酒精性脂肪肝(alcoholic fatty liver,AFL)、酒精性肝炎(alcoholic hep-atitis,AH)、酒精性肝纤维化(alcoholic hepatic fibro-sis,AHF)、酒精性肝硬化(alcoholic cirrhosis,AC)和肝细胞癌(hepato cellular carcinoma,HCC)。酒精性肝病是世界范围内慢性肝病的最重要病因之一。约占全球死亡率的3.8%,在发达国家十分常见[6]。2007年美国国家防止酒精滥用及酒精中毒研究所的报告显示肝硬化死亡率位于死亡原因的第12位,其中超过48%的比例与酒精有关。在我国,随着社会经济的发展和生活水平的提高以及受“中国酒文化”的影响,酒精消费量逐年上升,酒精性肝病发病率也呈逐渐上升的趋势。
肝脏是人体酒精代谢的重要器官,大约80%的酒精在肝脏中进行代谢。酒精摄入过多会导致肝脏出现一系列损害性病变。如何安全有效地预防和治疗酒精性肝病已受到全社会的关注[8]。山奈酚(Kaempferol)是常见的黄酮类化合物之一,也称为山奈黄素、黄芪甙元、山柰酚-3等,分子结构式为C15H10O6,分子量为286.23,在山奈等姜科植物根茎中的含量最为丰富,也存在于生活中常见的果蔬及草本植物中[9]。
既往研究已证实了山奈酚具有多种重要的药理作用,包括抗氧化、抗炎、抗凋亡、促进免疫调节等,在肿瘤、心脑血管疾病、糖尿病肾病、急性肝损伤、骨关节炎等疾病中具有潜在的治疗价值[10,12]。山奈酚具有十分明显的抗炎作用,其作用机制主要包括调节促炎酶的活性和炎症相关基因表达,抑制转录因子、黏附分子以及基质金属蛋白酶等[13]。这为酒精性肝损伤的治疗提供了新思路。
本研究明确了山奈酚对急性酒精性肝损伤小鼠的保肝作用,在模型组中小鼠的ALT、AST明显高于空白组,提示急性肝损伤模型复制成功,而各给药组ALT、AST较模型组明显下降,且随着剂量因素比重的增大,抑制作用更明显。表明山奈酚预处理能稳定肝细胞膜,抑制因肝细胞破裂、坏死而引起的血清转氨酶升高,保护肝细胞免于大量酒精摄入引起的损伤。本实验结果为该产品的进一步开发与使用提供了实验依据,为临床酒精性肝病的治疗提供了新思路。
