系统性红斑狼疮患者外周血CD3+CD56+NKT水平与Th1/Th2细胞表达的相关性*
2022-07-23高娟邢燕张利军
高娟 邢燕 张利军
(1.重庆市九龙坡区中医院检验科,重庆 400016;2.重庆医科大学附属第一医院输血科,重庆 400016;3.重庆医科大学附属第二医院检验科,重庆 400010)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)为常见慢性自身免疫性疾病,其发病机制复杂,迄今仍未完全明确。较多学者认为免疫功能紊乱贯穿于SLE的病理过程[1-2]。自然杀伤T(NKT)细胞为异质性T淋巴细胞,同时具有NK细胞与T淋巴细胞的部分特性[3]。CD3+CD56+淋巴细胞为NKT细胞中的一员,其参与了类风湿性关节炎[4]、Graves病[5]等自身免疫性疾病的发病与进展,而在SLE中的研究报道较少,且在SLE中的作用存在较大争议。本研究选取112例SLE患者,采用流式细胞仪测定CD3+CD56+NKT细胞的表达情况,旨在探讨外周血CD3+CD56+NKT细胞表达与相关机制的关系,现报告如下。
1 资料与方法
1.1 一般资料 选取2019年8月~2020年12月重庆市九龙坡区中医院收治的112例SLE患者为SLE组。纳入标准:①符合美国风湿病学会制定的SLE诊断标准[6]。②近半年内未接受过免疫抑制剂、类固醇激素治疗。③未合并其它自身免疫系统疾病。④自愿参与本研究且对研究内容充分知情。排除标准:①合并急慢性感染、严重肝肾功能不全及恶性肿瘤者。②非SLE所致精神病。③妊娠期和哺乳期妇女。另选取同期我院体检科健康自愿者50例为健康组。本研究经医院伦理委员会审核批准。
1.2 方法
1.2.1 主要试剂与仪器 流式细胞仪(美国BD公司,FACScalibur型),酶标仪(美国BIO-RAD公司,3550UV型),小鼠抗人单克隆抗体CD3FITC、CD56-PE均由美国BD公司生产,二抗均购自美天旎生物科技公司,IFN-γ、IL-2、IL-6、IL-10酶联免疫法(ELISA)试剂盒购自美国R&D公司,淋巴细胞分离液由加拿大Norgen Biotek生产,乙二胺四乙酸(EDTA)、聚丁二酸丁二醇酯(PBS)缓冲液由北京索莱宝科技有限公司生产,试验操作均按试剂说明书执行。
1.2.2 外周血CD3+CD56+NKT测定 采集受试者空腹静脉血3 mL,EDTA抗凝,取5μL加入流式管,加入单抗CD3FITC、CD56-PE,室温避光孵育 20 min,再经PBS缓冲液洗涤2次,1200 r/min 离心(离心半径:10 cm)10 min后收集细胞,上流式细胞仪检测,使用 Cellquest 软件获取并进行数据分析。
1.2.3 外周血相关细胞因子测定 取上述血液2 mL,2000 r/min离心(离心半径:10 cm)10 min后取血清层,采用酶联免疫法测定血清中IFN-γ、IL-4浓度,并在酶标仪450 nm处测定吸光度值,通过绘制标准曲线计算出相应指标的浓度。
1.2.4 资料收集 收集患者SLE疾病活动指数(SLEDAI)评分、24 h尿蛋白定量(24 hUPQ)等其他临床参数。
2 结果
2.1 两组一般资料比较 SLE组:男34例,女78例;年龄21~63岁,平均(28.41±6.37)岁;体质量指数21~25 kg/m2,平均(23.05±3.28)kg/m2;病程0.5~15年,平均(5.37±1.20)年,按SLEDAI[7]评分分为非活动期(SLEDAI<5分)72例,活动期(SLEDAI≥5分)40例。健康组:男16例,女34例;年龄20~62岁,平均(28.26±6.51)岁;体质量指数21~24 kg/m2,平均(23.12±3.31)kg/m2。两组受试对象上述临床资料比较,差异均无统计学意义(P>0.05)。
2.2 两组CD3+CD56+NKT细胞水平比较 SLE组外周血CD3+CD56+NKT细胞计数及占比均较健康组明显减小,差异有统计学意义(P<0.05),见表1。

表1 健康组与SLE组外周血CD3+CD56+NKT细胞水平比较
2.3 SLE不同疾病活动度CD3+CD56+NKT细胞水平及其他参数比较 SLE活动期组CD3+CD56+NKT细胞水平及其占比、IFN-γ、IFN-γ/IL-4均明显低于非活动期组(P<0.05),而SLEDAI评分、24 hUPQ、IL-4明显高于非活动期组,差异有统计学意义(P<0.05),见表2。

表2 不同疾病活动度SLE患者CD3+CD56+NKT细胞水平及其他参数比较
2.4 CD3+CD56+NKT与SLE临床参数的相关性分析 Pearson相关分析结果显示,CD3+CD56+NKT细胞与SLE患者SLEDAI评分、24hUPQ及IL-4呈负相关(r=-0.573、-0.682、-0.374,P<0.05),而与IFN-γ无显著相关性(r=0.016,P>0.05),见表3。
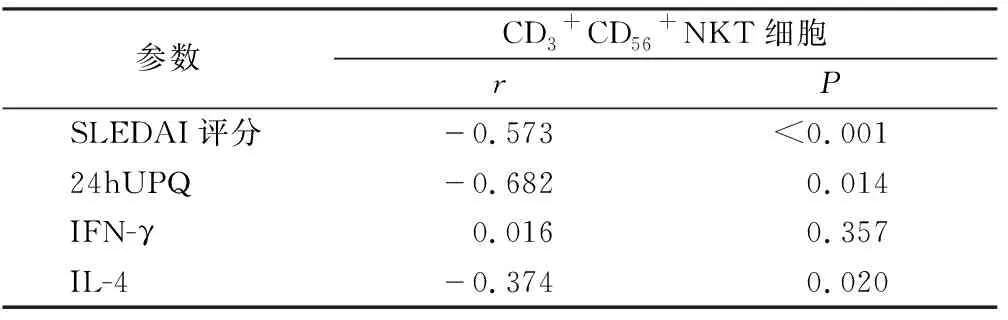
表3 CD3+CD56+NKT与SLE临床参数的相关性分析
3 讨论
SLE是一种好发于青壮年的自身免疫性疾病,我国SLE年新发约70~100/10万例,呈逐年增长趋势,其中女性患病率约为男性的10倍[8-10]。免疫系统紊乱为SLE的重要病理机制,病情未得到控制常累及血液、关节、皮肤等多器官系统,严重危害机体健康。目前SLE的诊断主要依据临床症状、自身抗体指标、免疫学指标及影像学检查等,但易与类风湿关节炎、系统性血管炎等病症混淆,造成漏诊或误诊[11-13]。随着近年来对SLE免疫机制研究的不断深入,学者发现NKT细胞与SLE的发病关系密切,有望成为SLE诊断和病情严重程度评估的新指标[14-15]。
本研究结果显示,SLE组外周血CD3+CD56+NKT细胞计数及占比均明显小于健康组,且SLE活动期CD3+CD56+NKT细胞水平及其占比明显低于非活动期组,同时Pearson相关分析发现,CD3+CD56+NKT细胞与SLE患者SLEDAI评分呈显著负相关,提示CD3+CD56+NKT细胞参与了SLE的发病过程,SLE患者机体存在外周血CD3+CD56+NKT细胞数量及占比降低,且活动期其表达水平更低,与王锡携[16]报道结果一致。NKT细胞广泛分布在胸腺、骨髓及肝脏等多个组织器官中,在外周血中的水平较低,其可同时表达T细胞的表明标志(CD3、T细胞受体等)和NK细胞的表明标志(CD16、CD56等),兼有T细胞与NK细胞的生物功能,并可连接固有免疫与适应性免疫,参与机体免疫应答过程,调节自身防御网络[17-19]。邹原方等[20-21]研究发现,SLE患者存在CD3+CD56+NKT细胞数量减少和细胞功能缺陷,并认为其原因可能与机体分泌干扰素诱导NKT细胞凋亡有关。本研究分析认为,SLE活动期患者机体存在的大量抗体与免疫复合物可能诱导NK细胞减少和NK细胞功能抑制,导致SLE患者适应性免疫与固有免疫调节失衡,造成机体免疫系统紊乱;同时,CD3+CD56+NKT细胞可能在杀伤靶细胞作用时与其功能凋亡,在SLE进展过程中,CD3+CD56+NKT细胞数量较少,SLEDAI增加,病情越重,免疫紊乱程度愈加严重。值得注意的是, SLE活动期24 h尿蛋白定量高于非活动期,CD3+CD56+NKT细胞与SLE患者24 hUPQ呈负相关,表明SLE活动期肾功能损害更严重,CD3+CD56+NKT细胞可能成为SLE早期肾损伤的诊断标志物,有待进一步探讨。
Th1 /Th2细胞平衡向Th2细胞漂移是SLE发病重要病理机制[22],在NKT细胞发挥免疫过程中可分泌IL-4促进Th2细胞功能增强,使SLE活动度增加[23]。并有研究证实[24-25],CD3+CD56+NKT细胞可通过分泌IL-2、IL-6、IL-10等相关因子参与Th0转化为Th1/Th2细胞的过程。本次研究中测定的外周血IFN-γ、IL-4,其分别由Th1细胞、Th2细胞分泌,SLE活动期IFN-γ、IFN-γ/IL-4均明显低于非活动期组,而IL-4明显高于非活动期组,且Pearson相关分析结果显示,CD3+CD56+NKT细胞与SLE患者IL-4均呈显著负相关,而与IFN-γ无显著相关性,提示CD3+CD56+NKT细胞可能参与了Th1/Th2平衡调节。原因分析,CD3+CD56+NKT细胞受刺激活化后,通过分泌IL-4等细胞因子,引发Th2型免疫反应,Th2细胞功能亢进并释放特异性细胞因子的功能,抑制T细胞成熟和分化,导致机体免疫调节机制破坏,自身反应细胞过表达,出现自身免疫反应损伤,加重病情。
4 结论
CD3+CD56+NKT细胞参与了SLE免疫调节过程,其水平与患者SLEDAI评分呈显著负相关,CD3+CD56+NKT细胞可能通过分泌Th1/Th2细胞相关因子发挥SLE免疫调节作用,值得临床借鉴。
