PM2.5诱导大鼠肺组织miRNAs表达谱失调及相关信号通路变化研究
2022-07-23潘柏如张海军王杨杨娟
潘柏如 张海军 王杨 杨娟
(达州市中心医院胸外科,四川 达州 635000)
细颗粒物指环境空气中空气动力学当量直径小于等于 2.5 μm的颗粒物[1],PM2.5能够避开呼吸系统屏障进入血液循环,扰乱先天免疫机制[2]。能较长时间悬浮于空气中,其在空气中含量浓度越高,就代表空气污染越严重[3]。2010年~2015年,全球总体PM2.5水平由每平方米39.7 mg增加至每平方米44.2 mg,同时期可归因于PM2.5的死亡人数估计增加了约20%[4]。临床和实验研究都已经证实,PM2.5暴露与肺癌,特别是非小细胞肺癌(Non small cell lung cancer,NSCLC)之间存在因果关系[5]。一项针对1890万人进行的流行病学研究表明,接触PM2.5后12个月和60个月,肺癌死亡风险分别增加1.13倍和1.33倍[6]。大鼠经气管内注入PM2.5后,异常变化的miRNAs会通过调节免疫细胞导致大鼠免疫功能失衡[7]。英国的一项实验研究发现,对行走在污染街道上2 h的非吸烟人群的循环miRNA基因组进行了分析,结果显示,54种miRNA在血浆中有高表达,其中7种miRNA在肺中高表达[8]。本研究通过建立PM2.5暴露大鼠模型,检测大鼠血清及肺组织中miRNA的表达,探讨PM2.5对表观遗传学及肺组织损伤的影响,以期为PM2.5诱发肺癌的早期诊断提供更多策略,并对PM2.5诱发肺癌的可能机制进行研究。
1 材料与方法
1.1 主要细胞、试剂与仪器 苏木精-伊红(HE)染色试剂盒购自上海碧云天生物技术有限公司,人支气管上皮细胞16HBE购自上海拜力生物科技有限公司,CCK-8检测试剂盒购自上海科艾博生物技术有限公司,CD34免疫荧光染色试剂盒购自北京瑟斯腾环境科技有限公司,兔抗大鼠Notch1、兔抗大鼠HES1、兔抗大鼠Beclin1(1:800,美国Abcam)、兔抗大鼠Hes1、兔抗大鼠cleaved-Caspase3、兔抗大鼠GAPDH抗体购自美国Abcam公司、辣根过氧化物酶(HRP)标记的二抗购自Sigma公司,RIPA 裂解液购自北京索莱宝科技有限公司。凝胶成像扫描仪购自上海信帆生物科技有限公司,酶标仪购自美国Thermo公司,微粒空气过滤器(Heap过滤器)购于苏州威洛斯特过滤设备有限公司,PM2.5特氟龙滤膜购于美国TISCH公司。
1.2 实验动物 40只6周龄雄性Wistar大鼠,体重180~220 g,购于成都中医药大学[生产许可证号:SCXK(川)2019-11]。所有大鼠均饲养在SPF级动物房中,室温(22±1)℃,相对湿度40%~70%,昼夜循环12 h,大鼠可自由进食、饮水。本研究符合动物伦理要求,并经医院伦理委员会审核批准。
1.3 方法
1.3.1 PM2.5采集与纯化 利用Heap过滤器采集本市繁华路段空气中颗粒物,采用滤膜进行采样。将载有PM2.5的特氟龙滤膜剪成3 cm×3 cm大小后放入锥形瓶,加入200 mL蒸馏水后超声震荡30 min,医用纱布过滤5次,在4℃、12000 rpm条件下离心30 min,干燥处理得到的细颗粒物,-20℃保存备用。根据实验要求,在实验开始前配置PM2.5溶液。
1.3.2 动物分组及模型制备 适应性喂养一周后,将大鼠随机分为对照组和PM2.5干预组:低剂量组(2.5 mg/kg)、中剂量组(10 mg/kg)、高剂量组(20 mg/kg),每组10只。麻醉满意后,PM2.5干预组大鼠分别经气管内滴注PM2.5混悬液2.5、10、20 mg/kg,对照组注射50 μL生理盐水,每3 d一次,连续70 d,模拟慢性PM2.5暴露。气管内滴注后第70天处死大鼠,取双侧肺作进一步研究。之后,矢状面切除左肺中间带进行病理检查。右肺保存在液氮中,用于RNA和蛋白质的提取和定量。
1.3.3 肺组织病理学检查 取大鼠左肺门附近肺组织进行病理检查,光镜观察。光镜下,将肺组织固定在4%多聚甲醛溶液中。石蜡包埋后,取4 μm切片,进行苏木精-伊红(HE)染色,观察肺组织病理改变。
1.3.4 miRNA的RNA-seq高通量测序和数据分析 采用TRLzol试剂(Invitrogen,USA)提肺大鼠脏组织中总RNA。对RNA的浓度和质量进行测定。利用琼脂糖凝胶电泳法测定RNA完整性。应用安捷伦微RNA芯片对肺脏中miRNA进行分析。选择不同的index标签建库后。采用TruSeq PE Cluster Kit v3-cBot-HS试剂在cBot上生成簇,而后利用测序平台进行单端测序。
1.3.5 人支气管上皮细胞16 HBE培养及CCK-8检测 人支气管上皮细胞16HBE在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的Dulbecco's改良Eagle's培养基中培养,并在含5% CO2的37℃孵育箱中培养。用100 μg/mL浓度的PM2.5处理16 HBE细胞24~48 h,连续5代,模拟慢性暴露。miR-296-5p inhibitor及其阴性对照转染16 HBE细胞12 h后,每代加PM2.5(100 μg/mL),连续传5代。细胞干预完毕后,加入含CCK-8的培养基,CCK-8溶液约占细胞培养基体积的1/10。放入孵箱培养40 min,观察颜色变为橙色开始检测。将孔板取出,放入酶标仪检测,波长设为450 nm。处理分析数据。
1.3.6 CD34免疫荧光染色 将制备好的大鼠肺脏切片放入湿盒中,湿盒底部加水,注意防止干片。 在玻片标本中央滴加50 μL的CD34一抗,室温孵育1 h,PBS洗三遍,每次5 min。小心吸去PBS,加入二抗,室温孵育45 min,PBS洗四遍,每次5 min。小心吸去PBS,加入0.5 μg/mL DAPI染色10 min,用PBS洗三遍,去除多余的DAPI。加入20 μL封片剂封片。立即在荧光显微镜下观察。
1.3.7 Western blot检测 用RIPA裂解缓冲液处理细胞后提取总蛋白,细胞裂解液在4℃、12000 rpm条件下离心15min,收集上清液。采用BCA蛋白检测试剂盒,测定蛋白浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质。将蛋白质样品转移到NC膜上,用5%脱脂牛奶封闭。然后,用Notch1(1∶1000,美国Abcam)、HES1(1∶1000,美国Abcam)、Beclin1(1∶800,美国Abcam)、Hes1(1∶1000,美国Abcam)、cleaved-Caspase3(1∶1000,美国Abcam)、GAPDH抗体(1∶1000,美国Abcam)在4℃的摇床上孵育过夜,然后在室温下与二抗孵育2 h,对蛋白质进行量化和可视化。
2 结果
2.1 各组大鼠体重及精神状态 在实验期间的各个时间点,与对照组相比,低、中、高剂量组大鼠的体重始终较低,且PM2.5干预剂量越高,大鼠体重越低(P<0.05)。对照组大鼠精神状态活跃,二便正常,皮毛有光泽,反应灵敏,活泼好动。PM2.5干预组精神状态差,活动减少,毛色灰暗,对刺激的反应性下降。见图1。

图1 各组大鼠实验期间体重变化
2.2 大鼠肺脏大体观及HE染色 对照组大鼠肺脏呈均匀粉红色,质地柔软,表面无明显异常;干预组大鼠肺脏颜色灰暗无光泽,可见多处白色隆起,质地不均匀、不光滑。其中高剂量组大鼠肺切片HE染色可见大量巨噬细胞浸润并有颗粒物沉积,细支气管上皮不典型增生,部分腺体乳头状增生,部分管腔腺体拥挤、紊乱。见图2。
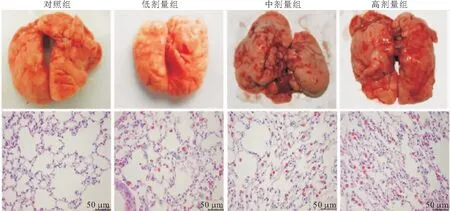
图2 各组大鼠肺脏大体观及HE染色
2.3 免疫荧光染色检测 与对照组相比,PM2.5干预组大鼠肺组织中CD34表达升高,干预浓度越高,CD34表达密度越高。表明PM2.5可诱导大鼠肺部血管增生活跃,微血管密度增加。见图3。
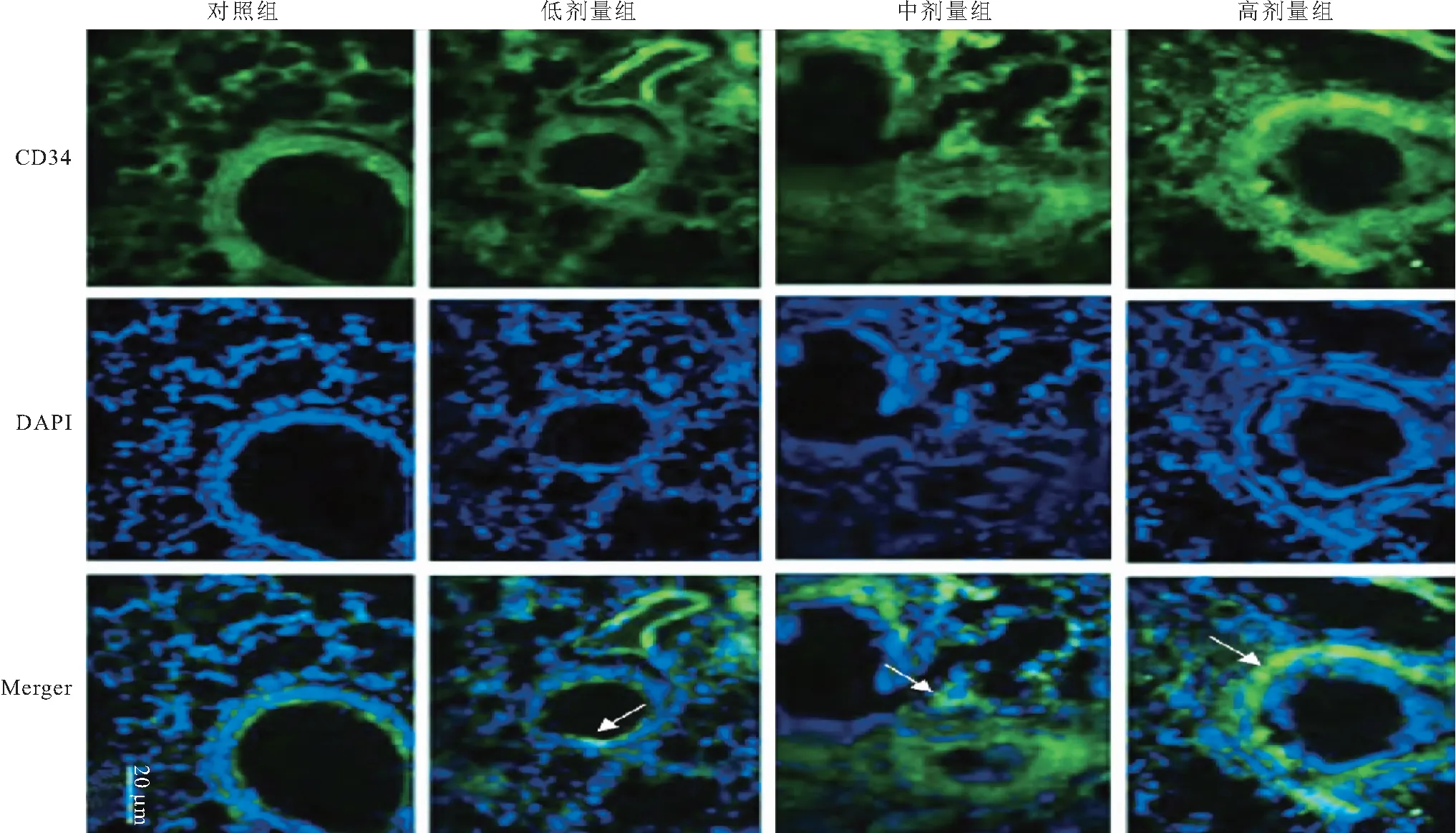
图3 大鼠肺组织CD34免疫荧光染色
2.4 各组大鼠肺组织差异性表达的miRNA miRNA的RNA-seq 高通量测序显示,与对照组比较,PM2.5干预组大鼠肺组织差异表达 miRNAs有67个,其中上调48个,下调的19个,表达量差异倍数高于5倍的有4个,即miR-296-5p、miR-27a、miR-182、miR-92a-1-p5。其中miR-296-5p上调了7.85倍,是表达差异最大的miRNA。见图4。

图4 四组大鼠肺组织差异性miRNA表达热图
2.5 CCK-8检测 正常对照组、PM2.5干预组、miRNA阴性对照组、miR-296-5p inhibitor组的OD值分别为0.76±0.13、0.38±0.08、0.41±0.09、0.59±0.12。与正常对照组相比,PM2.5干预组的细胞活性显著下降(P<0.05),经miR-296-5p inhibitor干预后,细胞活性明显升高(P<0.05)。 见图5。
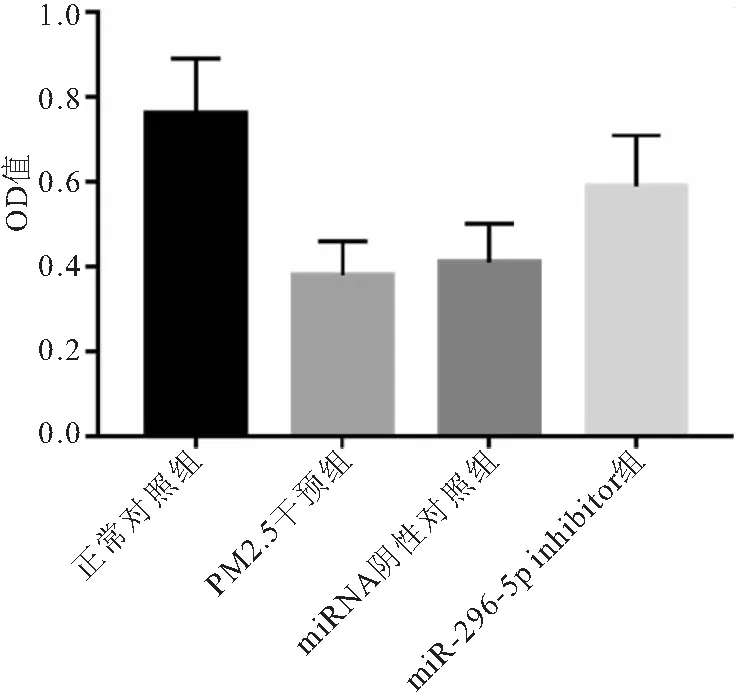
图5 各组细胞CCK-8活性检测
2.6 Western blot检测 与对照组比较,经PM2.5干预后,细胞中的Notch1蛋白、HES1蛋白表达量降低,Beclin1蛋白、cleaved-Caspase3蛋白表达量升高(P<0.05);与miRNA阴性对照组比较,转染miR-296-5p inhibitor后,细胞中的Notch1蛋白,HES1蛋白、Beclin1蛋白的相对表达量均明显升高(P<0.05)。表明在肺上皮细胞中,抑制miR-296-5p表达,可抑制Notch1信号通路激活。见图6。

图6 Western blot检测肺上皮细胞中Notch通路相关蛋白表达
3 讨论
流行病学的证据表明,肺癌与PM2.5暴露之间存在正相关关系[9]。现已证实PM2.5致肺部癌变的机制与肺上皮细胞释放细胞因子、产生活性氧、DNA损伤[10]和细胞骨架重塑[11]有关。本研究中,大鼠在PM2.5暴露10W后,在肺组织中发现与肿瘤相关的病理改变,包括肺泡间隔增厚和肺组织细支气管上皮增生。
PM2.5暴露影响血液、唾液、心脏和肺等不同组织/器官的miRNAs表达调控[12]。此外,血清miRNA可作为非小细胞肺癌、结直肠癌和糖尿病早期检测和诊断的生物标志物[13]。在本研究中,我们发现血清和肺中miRNAs表达异常,这些miRNAs与PM2.5暴露8周诱发的肺癌等肺部疾病有关。以往的研究表明[14],PM2.5及其组分可以进入血液循环,诱导表观遗传学改变,在不改变核苷酸序列的情况下影响基因表达。英国学者发现,在实验中仅仅吸入汽车尾气2 h,志愿者细胞的基因组DNA上约有2800个位点的DNA甲基化过程发生了改变,影响了大约400个基因的表达,其中包含了与过敏性疾病、炎症、氧化应激有关的基因。同时,这项实验显示,受试者在离开尾气环境后,尾气带来的DNA甲基化改变至少持续30 h,这与其它研究的结果一致。PM2.5的组成和含量十分复杂,包括金属、多环芳烃、多氯二苯并二恶二苯并呋喃和多氯联苯等,这些都是造成基因组不稳定的原因[15]。高水平的PM2.5结合的多环芳烃可能具有诱变和致癌的潜力[16]。接触多环芳烃与DNA损伤增加、微核形成增加和异常细胞周期停滞有关[11]。在本研究中,PM2.5暴露后针对Bax和RASSF5基因的miR-296-5p和miR-27a表达增加,这可能与DNA修复和细胞增殖失控有关。以往的研究表明[17],PM2.5的金属含量和组成通过直接或间接诱导活性氧产生和增加氧化应激来促进DNA损伤[18]。PM2.5来源的多环芳烃引起的脂质代谢反应可能与大鼠或人的肺部病变有关[19]。同时,PM2.5对机体基因表达有显著的调控作用[20]。有研究者收集PM2.5污染物后,让小鼠暴露在这些PM2.5污染的空气中,检测对小鼠基因的影响。结果发现,PM2.5暴露并不改变基因的序列,即并不引起DNA突变,但是会影响DNA上化学修饰的变化,主要是DNA甲基化,进而影响了基因的表达[21]。
在本研究中,miRNA 的RNA-seq 高通量测序显示,干预组大鼠肺组织差异表达 miRNAs有67个,其中上调48个,下调的19个,表达量差异倍数高于5倍的有4个,即miR-296-5p、miR-27a、miR-182、miR-92a-1-p5。在固体组织中高丰度的miRNAs通常也存在于血液中,但总是有显著的变异[22]。全血中miRNAs的总体模式不仅由特定的实体器官决定,还受其他因素的影响。有必要考虑到血清和肺组织中miRNAs的丰度差异,靶器官中的miRNAs反映了特定组织的损伤[23]。肺组织中miRNAs的差异表达也可提示PM2.5暴露后肺外组织可能存在损伤[16]。
Notch基因编码一类高度保守的细胞表面受体[24],它们调节从海胆到人等多种生物细胞的发育[25]。Notch基因编码一种膜蛋白受体,由Notch受体、Notch配体(DSL蛋白)及细胞内效应器分子(CSL-DNA结合蛋白)三部分组成[26]。本研究发现,与对照组比较,经PM2.5干预后,细胞中的Notch1蛋白、HES1蛋白表达量降低,Beclin1蛋白、cleaved-Caspase3蛋白表达量升高,表明PM2.5可显著激活肺上皮细胞中Notch信号通路。不同于其他信号通路,Notch信号通路中Notch的受体和配体都是膜蛋白[27],它介导的是两个细胞相互靠近接触之后的活化效应,而不是由分泌型的蛋白作为配体[26]。有研究表明[28],miRNA可通过抑制Notch信号中DII1受体表达而促进小鼠胚胎干细胞向心肌细胞分化。同时在本研究中,经miR-296-5p inhibitor干预后,细胞中的Notch1蛋白,HES1蛋白、Beclin1蛋白的相对表达量均明显升高。表明在肺上皮细胞中,抑制miR-296-5p表达,可抑制Notch1信号通路激活。因此我们推测,miR-296-5p可能是通过与Notch受体结合后触发Notch信号的活化,导致Notch受体发生蛋白水解,并进一步转移到细胞核,从而激活靶基因的转录,发挥生物学功能。Notch信号调节机体正常发育的一些关键步骤,所以,该通路的某些分子发生突变,或者其下游事件发生改变,都会导致细胞生物学功能的显著变化,影响上皮细胞功能。
4 结论
暴露于PM2.5环境中,大鼠肺组织中miRNAs的表达谱发生了紊乱,以miR-296-5p的表达失衡最明显,且miR-296-5p的表达失衡可通过Notch信号通路发挥效应,影响上皮细胞功能。
