邻苯二甲酸二环己酯与牛血清白蛋白相互作用研究
2022-07-23吴明火李尚春王丽梅韩知峡王艳芳张青碧
吴明火, 李尚春, 王丽梅, 韩知峡, 王艳芳, 张青碧
(西南医科大学公共卫生学院,四川泸州 646000)
邻苯二甲酸酯(Phthalate Esters,PAEs)作为常见的一类增塑剂,广泛应用于塑料和聚氯乙烯等工业产品,以增强其可塑性和多功能性[1],其中邻苯二甲酸二环己酯(Dicyclohexyl phthalate,DCHP)的使用量也逐渐增加[2]。由于PAEs通过非共价键与母体材料结合,因此很容易从产品中迁出,并转化为有害化合物释放到环境中。研究表明PAEs广泛存在于水、土壤以及空气中[3]。人类可能通过摄入、吸入和皮肤吸收等多种方式接触到PAEs[4],长期接触PAEs后会对人类的神经和生殖系统产生负面影响[5]。Sheikh等研究表明,PAEs可导致男性活动精子数量减少和DNA损伤[6]。Li等研究表明,DCHP可影响胎儿Leydig细胞类固醇生成,并导致多核生殖细胞和Leydig细胞聚集的发生,影响睾丸的发育[7]。目前PAEs的研究主要集中在邻苯二甲酸二(2-乙基己基)酯(Di(2-ethylhexyl)phthalate,DEHP)等邻苯二甲酸酯类物质,而DCHP在体内运输以及代谢的研究相对较少。
牛血清白蛋白(Bovine Serum Albumin,BSA)作为血液当中重要的一种成分,可以结合与运输内源性和外源性物质,确保血液渗透压的稳定,具有载体以及调节酸碱度的作用[8]。因BSA的氨基酸序列与人血清白蛋白极为相似,并且价格便宜、易获取,因此BSA被用于外源小分子与生物大分子间相互作用的研究中[9]。顾佳丽等以BSA为模型蛋白,研究甲苯达唑与BSA的相互作用[10]。本研究将BSA作为模型蛋白,采用光谱学以及分子对接技术对DCHP和BSA之间的相互作用机制进行研究。本研究结果有助于深入了解DCHP在生物体内运输机制。
1 实验部分
1.1 仪器与试剂
Cary Eclipse荧光光谱仪(美国,Agilent公司);F-4500荧光光度计(日本,日立公司);UV-5500PC紫外-可见分光光度仪(上海元析公司);JASCO J-815圆二色谱仪(日本,JASCO公司);FE20/EL20实验室pH计(梅特勒-托利多仪器(上海)公司)。
牛血清白蛋白(BSA,西亚试剂):配制成1.67×10-3mol/L储备溶液,使用时根据需要稀释。邻苯二甲酸二环己酯(DCHP,纯度为99%,百灵威科技有限公司,北京)配制成1.67×10-2mol/L储备溶液。布洛芬(Ibuprofen,纯度为98%,上海源叶生物科技有限公司)、华法林(Warfarin,纯度为98%,上海阿拉丁生化科技股份有限公司),均配制为1.67×10-3mol/L储备溶液,使用时根据需要稀释。pH=7.4的三羟甲基氨基甲烷(Tris)-HCl缓冲溶液,浓度为0.05 mol/L(0.15 mol/L NaCl)。所用试剂均为分析纯,实验用水均为超纯水。
1.2 实验方法
1.2.1 荧光光谱于比色皿中准确加入3 mL Tris-HCl缓冲溶液(pH=7.4),固定BSA浓度为1.67×10-6mol/L,然后加入不同浓度DCHP(0、3.30×10-7、6.70×10-7、10.00×10-7、13.30×10-7、16.70×10-7mol/L)。以280 nm为激发波长,在发射波长为300~450 nm的范围内测定BSA的荧光强度。参照文献公式[11]对光谱数据进行校正,从而排除内滤效应。设定Δλ=15 nm及Δλ=60 nm,240~400 nm范围扫描得同步荧光光谱。
1.2.2 位点竞争选用华法林和布洛芬两种位点竞争剂。比色皿中准确加入3 mL Tris-HCl缓冲溶液(pH=7.4),固定BSA浓度为1.67×10-6mol/L,华法林和布洛芬的浓度均为2.51×10-7mol/L,石英比色皿中加入不同浓度DCHP(0、3.30×10-7、6.70×10-7、10.00×10-7、13.30×10-7、16.70×10-7mol/L)。固定激发波长为280 nm,在温度298 K的条件下分别测定不同探针下的荧光光谱。
1.2.3 圆二色谱溶液中BSA浓度为1.67×10-5mol/L,DCHP的浓度为1.67×10-5mol/L。参数设置:扫描范围为190~250 nm,石英样品池的光径为1 mm,扫描速度为500 nm/min,扫描间隔为0.1 nm,测量时BSA与DCHP的浓度比为1∶0和1∶1,以1%磷酸盐缓冲溶液(PBS)为参比。所有数据经过3次扫描后取平均值。
1.2.4 分子对接DCHP的结构通过ChemBio3D Ultra14.0生成,并通过MMFF94对分子力场做优化设计,BSA的蛋白结构来源于RCSB数据库(编号:1H9Z)[12]。使用Autodock 4.2程序完成分子对接。对接算法采取Lamarckian遗传算法,将参数设定为默认设置。筛选出结合自由能最小的构象,应用LigPlus+软件分析。
2 结果与讨论
2.1 猝灭方式
荧光猝灭可分为静态猝灭与动态猝灭,静态猝灭常数随着温度增高而不断降低,而动态猝灭常数与温度之间呈现正相关[13]。依照Stern-Volmer方程能够计算出DCHP对BSA的荧光猝灭常数KSV,从而判断猝灭类别[14]。其结果如图1A以及表1所示。随着研究体系中DCHP浓度的升高,BSA的荧光强度逐渐降低,说明DCHP对BSA的内源荧光产生猝灭作用,表明DCHP与BSA发生了作用并使BSA的构象发生了改变。通过表1能够了解到,由于体系温度不断增高,KSV数值在不断降低,在体系温度T=298 K时,两种物质的双分子猝灭速率常数可达到1.24×1013L/(mol·s),和最大扩散常数2.0×1010L/(mol·s)相比,高出3个数量级,表明DCHP诱导BSA的荧光产生静态猝灭。
2.2 结合常数和结合位点
按照双对数方程[16](公式1),将不同体系温度下的荧光强度进行计算,计算结果如图1B与表1所示,随着温度提升,DCHP与BSA的结合常数(Ka)逐渐降低,表明DCHP对BSA的猝灭程度随着温度的升高而逐渐降低,进一步证实DCHP对BSA有静态猝灭效应[17]。T=298 K时,结合常数(Ka)为2.45×105L/mol,说明DCHP与BSA之间存在较强的作用力;由拟合直线的斜率可知,不同温度条件下BSA-DCHP体系的斜率(n)均接近于1(表1),说明BSA与DCHP之间有一个结合位点[18]。
lg[(F0-F)/F]=lgKa+nlg[Q]
(1)
式(1)中,F0和F分别为未加入和已加入DCHP时BSA的荧光强度;Ka为结合常数;n为结合位点数;[Q]为DCHP的浓度[18]。
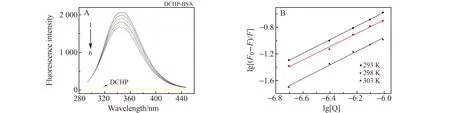
图1 不同浓度DCHP条件下BSA的荧光光谱(A)和不同温度条件下的双对数曲线(B)Fig.1 Fluorescence spectra of BSA at different concentrations of DCHP(A) and double logarithm curves at different temperatures(B)1 - 6,cDCHP(×10-7 mol/L):0,3.30,6.70,10.00,13.30,16.70;cBSA=1.67×10-6 mol/L;T=298 K.
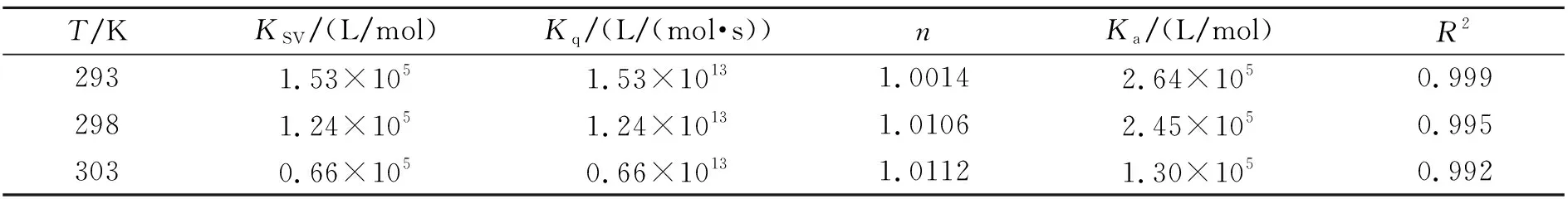
表1 不同温度条件下DCHP与BSA结合参数及Stern-Volmer猝灭常数
目前研究表明,BSA与小分子物质的结合位点有两个,分别位于BSA的子域ⅡA(位点Ⅰ)和ⅢA(位点Ⅱ)的疏水空腔中,其中位点Ⅰ含有Trp残基和Tyr残基,而位点Ⅱ只含有Tyr残基[12]。当激发波长设置为280 nm时可以同时激发Trp和Tyr的荧光,但是将激发波长调整为295 nm时只能激发Tyr的荧光。因此对比激发波长分别为280 nm和295 nm时,DCHP对BSA荧光的猝灭程度,可以判断DCHP与BSA的结合位点。如图2,在激发波长为280 nm时,DCHP对BSA的荧光猝灭程度显著高于激发波长为295 nm,这就证实Trp和Tyr两个残基都参加到了猝灭阶段,并且DCHP与BSA结合位置更偏向于Trp残基。
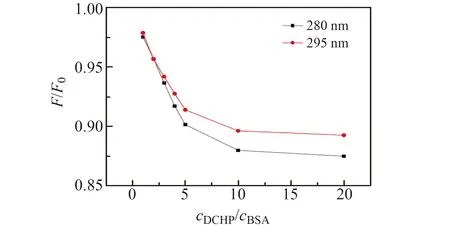
图2 不同激发波长下DCHP对BSA的荧光强度影响Fig.2 Effect of DCHP on fluorescence intensity of BSA at different excitation wavelengthscDCHP(×10-6 mol/L):1.67,3.30,5.01,6.68,8.35,16.7,33.0;cBSA=1.67×10-6 mol/L;T=298 K.
为进一步探究DCHP与BSA的结合位点,本实验选用荧光探针竞争试剂华法林和布洛芬。研究表明华法林作为中性杂环化合物的荧光型探针,布洛芬作为芳香族化合物的荧光探针,分别可以与BSA位点Ⅰ和位点Ⅱ特异性结合[19]。加入华法林后结合常数下降的幅度更明显,说明华法林与DCHP共存时产生竞争,华法林探针对DCHP与BSA作用的影响效果更强,表明DCHP与BSA的结合位点是位点Ⅰ。
2.3 作用力类型
各种类别的药物小分子能够通过氢键和范德华力等[20]与蛋白质结合,形成复合物。根据热力学原理,体系的吉布斯自由能ΔG、热力学熵变ΔS以及焓变ΔH的相对大小,能够判断反应是不是自发进行和复合物的作用力种类[21]。在温度改变不大时,反应的焓变ΔH能够当做一个常数进行处理。针对于DCHP-BSA体系,按照Van’t Hoff公式对不同温度情况下的K值进行计算,其结果如表2所示。ΔG<0证实反应属于自发进行,ΔH<0、ΔS<0,结果证实BSA和DCHP间的作用力是氢键与范德华力。
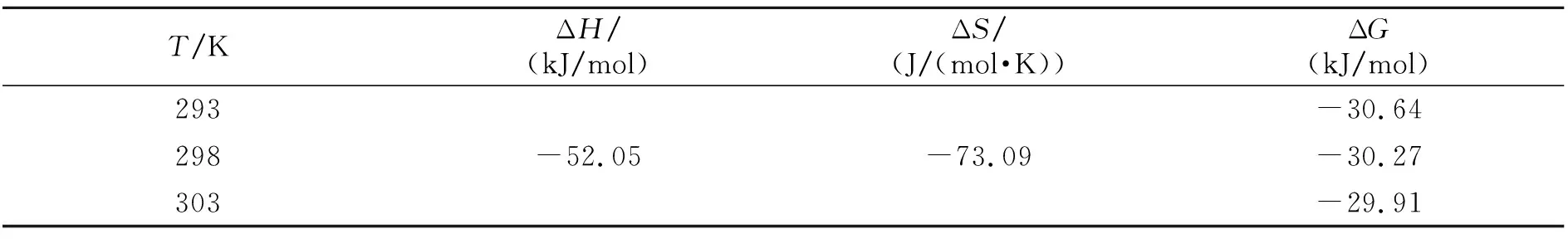
表2 不同温度条件下DCHP-BSA体系热力学参数
2.4 分子对接实验
为进一步研究DCHP与BSA之间的相互作用,利用Autodock 4.2软件对DCHP与BSA形成的1∶1非共价结合复合物进行了研究。DCHP与BSA对接结果的最佳构象如图3(A),从图3(B)可以看出它们之间的结合位点位于位点Ⅰ[22]。通过LigPlus+软件分析DCHP与BSA之间最优构象的氢键及疏水作用(图3(C)),可以发现DCHP与16种氨基酸残基具有疏水作用,其中大多数是疏水氨基酸(Ala212,Ala209,Val481,Val342,Trp213,Leu197,Leu454,Leu480,Leu346),DCHP与Ser343之间存在氢键作用,键长0.332 nm。对接实验的结果同样表明,BSA与DCHP之间的作用力是疏水作用力,并且结合位点位于BSA结合位点Ⅰ,与荧光光谱实验一致。
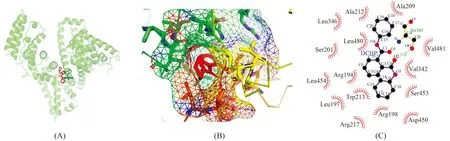
图3 DCHP与BSA的分子对接结果Fig.3 Molecular docking results of DCHP and BSA(A)The best conformation of DCHP and BSA docking results;(B)The docking site of DCHP and BSA;(C)The result of LigPlus+.
2.5 BSA二级结构的改变
2.5.1 同步荧光光谱BSA构象中酪氨酸(Tyr)以及色氨酸(Trp)残基的荧光特点,分别能够从激发、发射波长差Δλ为15 nm以及60 nm时表现出来[23]。与此同时,最大发射波长向短波方向或长波方向移动,即蓝移或红移,说明氨基酸残基周围微环境疏水性增强或极性增强[9]。实验结果如图4所示,由于DCHP-BSA研究体系中随着DCHP浓度的增加,Tyr残基以及Trp残基的荧光强度都有所下降,证实上述两个残基都参与到了结合过程,Δλ为60 nm时BSA的荧光强度下降幅度更大,说明了DCHP与BSA发生了结合并且结合位置较为靠近Trp残基。最大发射波长向短波方向移动,表明DCHP-BSA复合物发生了蓝移,Trp残基周围微环境疏水性增强。即BSA的构象发生了改变。
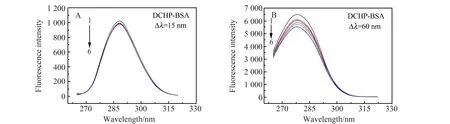
图4 Δλ=15 nm(A)和Δλ=60 nm(B)时,不同DCHP浓度下BSA的同步荧光光谱Fig.4 Synchronous fluorescence spectra of BSA at different DCHP concentrations,Δλ=15 nm(A)and Δλ=60 nm(B)1 - 6,cDCHP(×10-7 mol/L):0,3.30,6.70,10.0,13.30,16.70;cBSA=1.67×10-6 mol/L;T=298 K.
2.5.2 三维荧光光谱三维荧光光谱是研究化学小分子对蛋白质的构象能否产生改变的有效途径[24]。如图5所示,BSA有两个指纹峰(Peak 1和Peak 2),位置分别位于228 nm/344 nm(λex/λem)、280 nm/342 nm(λex/λem)。Peak 1主要反映蛋白质二级结构(多肽骨架结构特征)的变化情况,Peak 2反映Trp残基和Tyr残基的光谱特征[25]。加入DCHP后,Peak 1和Peak 2的荧光强度都有所降低,该现象说明DCHP和BSA之间存在相互作用。Peak 1的Stokes位移发生蓝移(116减少到113),表明DCHP的存在诱导BSA的二级结构发生改变。Peak 2的Stokes位移从62减少到60,说明DCHP进入了BSA的疏水空腔并导致芳香族氨基酸残基的微环境发生改变。

图5 游离态(A)和结合态(B)的BSA的三维荧光光谱图Fig.5 Three dimensional fluorescence spectra of free(A) and bound(B) BSA
2.5.3 圆二色谱圆二色谱如图6所示,BSA在208 nm处和224 nm处出现两个负峰,它们是BSA中α-螺旋(α-Helix)结构的特征峰[25]。DCHP对BSA的圆二色谱峰形基本无影响,但可导致其强度减弱。对实验结果进行计算和分析可知,单纯BSA的α-螺旋含量为57.09%,加入DCHP后BSA的α-螺旋含量下降至53.43%。该结果表明DCHP与BSA发生了相互作用,并使得BSA的二级结构发生了改变。该结果与三维荧光结果一致。
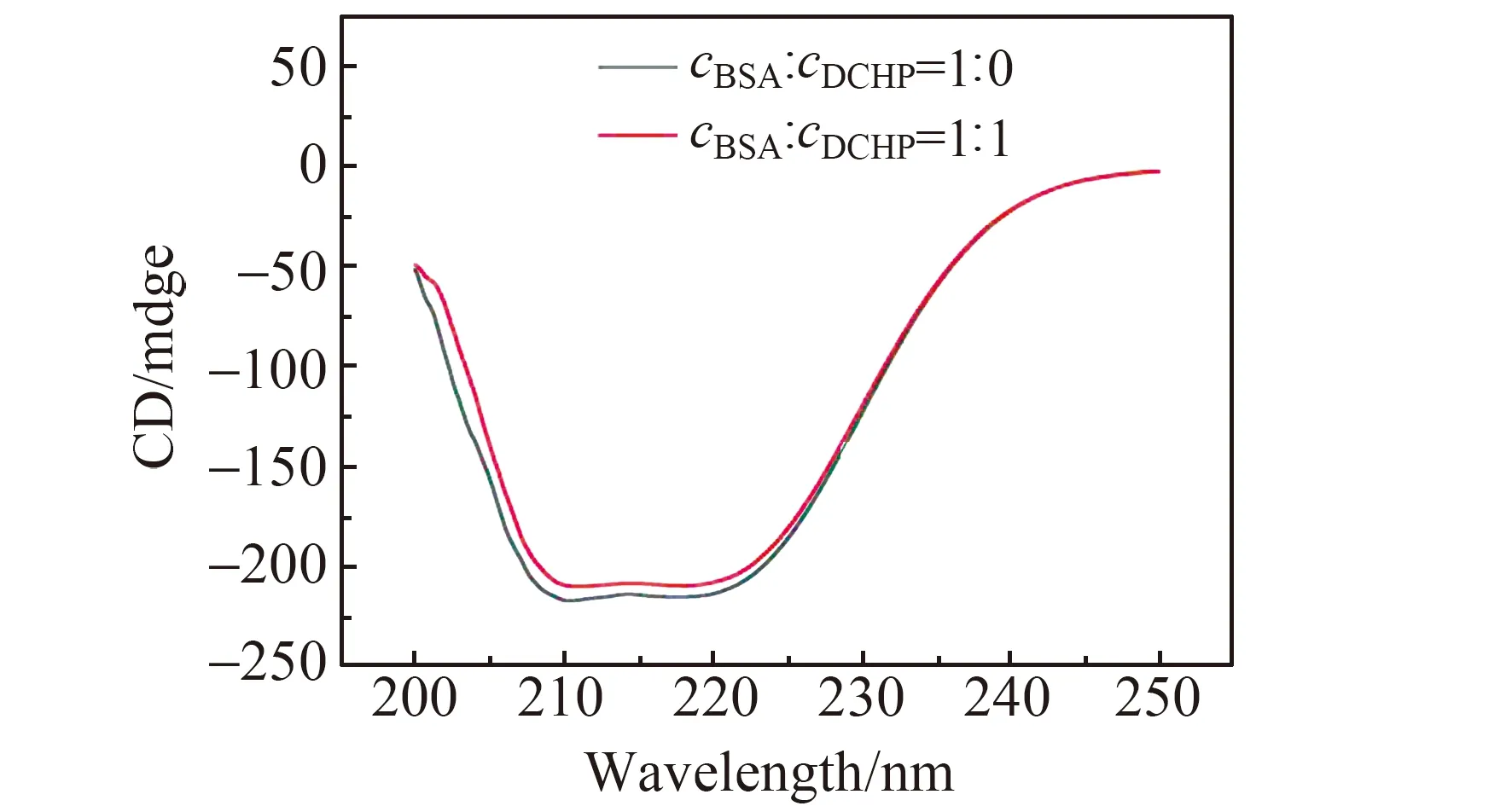
图6 BSA和DCHP-BSA复合物的圆二色谱图Fig.6 Circular dichroism spectra of BSA and DCHP-BSA complexcBSA=1.67×10-5 mol/L;cDCHP=1.67×10-5 mol/L;T=298 K.
3 结论
实验利用光谱法与分子对接技术对DCHP和BSA的相互作用情况进行探究,其中包含结合模式、结合常数以及结合位点。实验数据证实,DCHP和BSA结合位点Ⅰ相结合,并出现了比较稳定的复合物。DCHP-BSA复合物中起到作用的是范德华力与氢键两种结合力。总体而言,本研究结果提供了有关DCHP与BSA之间的相互作用的详细信息,有助于我们更好地了解PAEs的毒性。
