极谱法检测环境水体中的全氟辛烷磺酸
2022-07-23高燕梅张之琛
高燕梅, 陈 文*, 张之琛
(1.成都理工大学材料与化学化工学院,四川成都 610059;2.四川省矿产资源化学高校重点实验室,四川成都 610059)
全氟辛烷磺酸(Perfluorooctane Sulphonate,PFOS),以及它与金属离子、酰胺和其它衍生物的结合物,都属于全氟化合物(Perfluorinated Chemicals,PFCs),是由全氟化酸性硫酸基酸中完全氟化的阴离子组成,为多种PFCs在环境中的最终产物[1],结构如图1所示。由其结构可得知,C-F键键能很高,具有着很强的稳定性,兼具两疏性,很难被降解,并可以经受一定强度的光、热、微生物以及化学作用。PFOS凭借自身良好的稳定性和疏水疏油性,广泛应用于纺织、医药、表面活性剂、阻燃剂、石油化工、食品包装等多个领域。针对PFOS的毒性研究发现,PFOS主要对肝脏具有毒性,为肝致癌物质,人体摄取后分布于肝脏及血液中,且PFOS由于其自身的稳定性难以通过新陈代谢分解。在后续研究中表明,PFOS的危害不止是对于人体的肝脏,还包括血清、生殖系统、内分泌系统以及免疫系统。除此之外,PFOS还会引起关于生物在体脂肪代谢和能量代谢这两方面的紊乱和障碍等问题,是一种全身多脏器毒性的环境污染物[2,3]。因此,建立一个简便、快速测定水环境中PFOS残留的方法具有十分重要的意义。
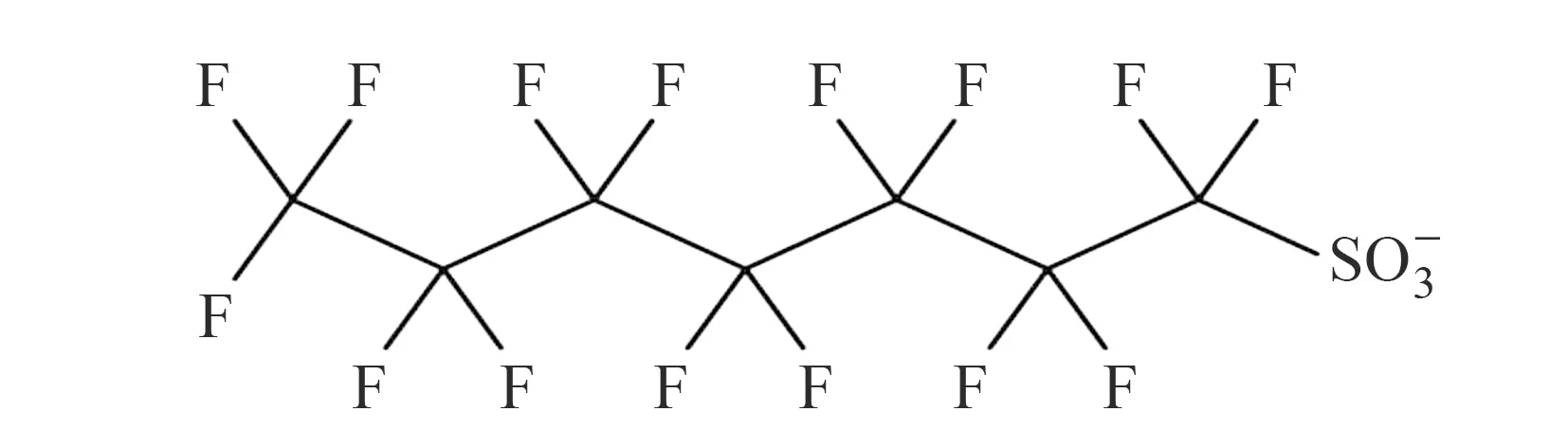
图1 PFOS结构示意图Fig.1 Molecular structure of PFOS
目前国内外检测PFOS主要采用色谱-质谱法[4],而其他检测方法,如光谱法[5]、电化学方法[6,7],酶联免疫法[8]等也有文献报道。然而色谱-质谱联用技术存在样品前处理复杂,技术人员要求高,仪器昂贵较难普及的问题。现有的光谱法、电化学法、酶联免疫法等对于PFOS一定程度上避免了上述问题,有着更加快速便捷等优点,但是对于环境样品的分析,其灵敏度有待进一步提高。本研究基于盐酸檗碱(BBR)在pH=6.09的B-R缓冲溶液中,于电位-1.3~-1.4 V(vs.SCE)处有一灵敏的还原峰,而PFOS与BBR可通过静电作用形成离子缔合物[9],导致其峰电流下降(图2),其改变值在一定PFOS浓度范围与之呈良好的相关性。由此提出并建立一种间接检测PFOS的极谱新方法。该方法反应体系简单,具备检测灵敏度较高、分析成本低、准确度较好、操作简便等优点,为PFOS分析新方法研究建立,提供了一定的参考。

图2 BBR及其加入PFOS后的二阶导数极谱图Fig.2 Second-order derivate polarograms of BBR and BBR+PFOS system
1 实验方法
1.1 仪器与试剂
JP-303型极谱仪(成都仪器厂),三电极体系:滴汞电极为工作电极,铂微电极(直径1 mm,成都仪器厂)为辅助电极,饱和甘汞电极(单盐桥,成都仪器厂)为参比电极;实验中均采用10 mL小烧杯为电解池;数控超声波清洗器(昆山市超声仪器有限公司);电子分析天平(上海舜宇恒平科技仪器有限公司)。
全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟己酸(PFHeA)、全氟葵酸(PFDeA)、全氟戊酸(PFPeA)(成都科龙化工试剂厂)。盐酸小檗碱(97%,四川维克奇生物科技有限公司);全氟辛烷磺酸钾盐(98%,河北百灵威超精细材料有限公司)。全氟辛烷磺酸标准储备液(1.0×10-4mol/L):准确称取5.38 mg全氟辛烷磺酸钾盐,使用超纯水溶解后,转移至100 mL容量瓶中定容,浓度为1.0×10-5mol/L、1.0×10-6mol/L的标准溶液可由上述储备液稀释而得。BBR标准溶液(1.0×10-4mol/L):准确称取9.47 mg BBR,使用超纯水溶解后,转移到250 mL容量瓶中定容,摇匀备用。Clark-Lubs缓冲溶液,Srensen缓冲溶液,Kolthoff缓冲溶液,Mcllvaine缓冲溶液,B-R缓冲溶液,pH均为6.09。所用试剂均为分析纯。实验用水均为Milli-Q(18.2 MΩ·cm)超纯水。
1.2 实验方法
在25 mL的比色管中,先准确移取3.0 mL B-R缓冲溶液(pH=6.09),再依次准确加入1.0×10-4mol/L的BBR溶液6.0 mL和PFOS标准溶液或适量的样品溶液,并用超纯水定容至10 mL,摇匀。静置放置反应20 min后,将溶液倒入10 mL小烧杯中,在仪器条件为起始电位-0.700 V(vs.SCE),静止时间11 s,汞柱高度为43 cm,使用400 mV/s扫描速率扫描4次,量程为0~6×102nA,于常温下进行测定,并且记录电位-1.3 V(vs.SCE)左右处的二阶导峰电流与峰电位的值。
2 结果与讨论
2.1 实验条件的选择
2.1.1 BBR的浓度研究发现,对于仅有BBR的体系,在BBR浓度小于12 μmol/L或者大于2 μmol/L时,峰电流均无明显的变化,所以在进行BBR浓度优化时,将BBR浓度范围定为2~12 μmol/L。实验结果如表1,低浓度PFOS在BBR浓度为6 μmol/L时,峰电流变化值(ΔIp″)最大;高浓度PFOS的ΔIp″ 于BBR浓度为10 μmol/L时最大。鉴于实际样品中PFOS的含量很低,而高浓度的PFOS在BBR浓度为6 μmol/L时ΔIp″ 也很明显,故选择浓度为6 μmol/L为指示探针BBR的浓度。
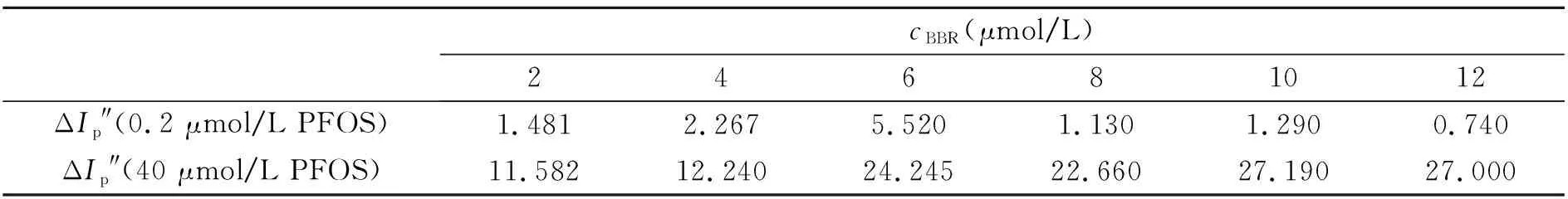
表1 BBR浓度的选择
2.1.2 体系的酸度按照实验方法,使用0.01 mol/L HCl和0.01 mol/L NaOH溶液调节溶液pH,考察体系酸度对峰电流的影响,结果如图3所示。在pH<2.0时,峰电位发生了明显的偏移且峰形相较于其他pH出现明显的变形,pH为3.0~10.0的范围内,峰形稳定。在pH为6.0时,高、低浓度的PFOS的ΔIp″ 最大,因此本研究选择pH=6.0为最佳酸度。
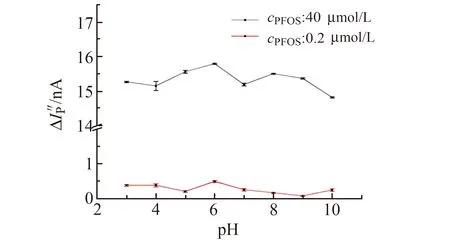
图3 pH对ΔIp″ 的影响Fig.3 The influence of pH on ΔIp″
2.1.3 缓冲溶液种类及用量研究考察了pH为6.09的B-R缓冲溶液、Clark-Lubs缓冲溶液、Srensen缓冲溶液、Kolthoff缓冲溶液以及Mcllvaine缓冲溶液对体系灵敏度的影响,结果如表2所示。以B-R作为缓冲溶液,体系检测的灵敏度最高,结果的稳定性最好。所以选择pH为6.09的B-R缓冲溶液作为本研究的底液。

表2 缓冲溶液种类对ΔIp″ 的影响
按照实验方法,探讨了B-R缓冲溶液用量为1.0~5.0 mL时对0.2 μmol/L(低)和40 μmol/L(高)PFOS溶液峰电流变化值的影响,结果如图4所示。图4显示,低浓度的PFOS在B-R缓冲溶液用量为3.0 mL时ΔIp″ 最大;高浓度PFOS的ΔIp″ 在1.0 mL为最优。综合考虑,选择3.0 mL为B-R缓冲溶液的最佳用量。
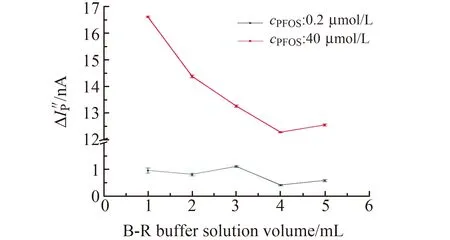
图4 缓冲溶液体积对ΔIp″ 的影响Fig.4 The influence of buffer solution volume on the ΔIp″
2.1.4 反应时间及体系的稳定性实验在上述所得的最佳条件下,考察了高、低浓度PFOS的分析体系在2~24 min间峰电流变化,以及PFOS浓度为20 μmol/L的BBR+PFOS体系,在24 h以内敞开体系和封闭体系峰电流值的变化。结果显示:对于高、低浓度的PFOS,反应达到平衡的时间分别为20 min和10 min,而在24 h内,体系ΔIp″ 稳定,但封闭体系ΔI″p较敞开体系明显大。因此综合考虑,选择20 min为本实验最佳反应时间,BBR+PFOS体系反应完全后封闭保存,并在24 h内完成分析检测。
2.1.5 温度的影响本研究考察了温度对ΔIp″ 的影响。固定PFOS浓度为20 μmol/L,测定在10~46 ℃下加入PFOS后体系峰电流的变化,结果表明在20~24 ℃范围内,加入PFOS的体系ΔIp″ 最大。综合考虑温度的控制等因素,选择在室温下进行分析。
2.1.6 仪器条件优化采用单因素变量法,固定PFOS的浓度为20 μmol/L,测定BBR+PFOS体系的ΔIp″。分别考察了测试波型、汞柱高度、扫描速率、起始电位、静止时间对其的影响。调节导数值为0阶、1阶和2阶,在31~46 cm范围内改变汞柱高度,在100~ 600 mV/s范围内改变电极扫描速率,在-500 mV至-1 000 mV范围内改变起始电位,在0~12 s内改变滴汞静止时间。本研究最佳的仪器条件为:导数值:2阶;汞柱高度:43 cm;扫描速率:400 mV/s;起始电位:-700m V;静止时间:11 s。
2.2 PFOS的标准曲线与检出限
配制一系列不同PFOS浓度的BBR+PFOS标准溶液体系,以体系峰电流(y)为纵坐标,以PFOS的浓度(x,μmol/L)为横坐标作图,绘制指数曲线,结果如图5所示。图5显示,PFOS在0.2~60 μmol/L浓度范围与峰电流有良好的指数关系,拟合方程为:y=17.504e-0.037x(R2=0.9979)。
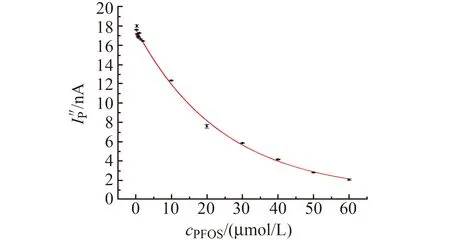
图5 PFOS的含量与体系峰电流的指数拟合曲线Fig.5 Exponential fitting curve of PFOS content and peak current
在最佳实验条件下,配制浓度为0.1 μmol/L的BBR+PFOS溶液,连续测定10次。图6为体系的峰电流与低浓度范围内PFOS的线性曲线。
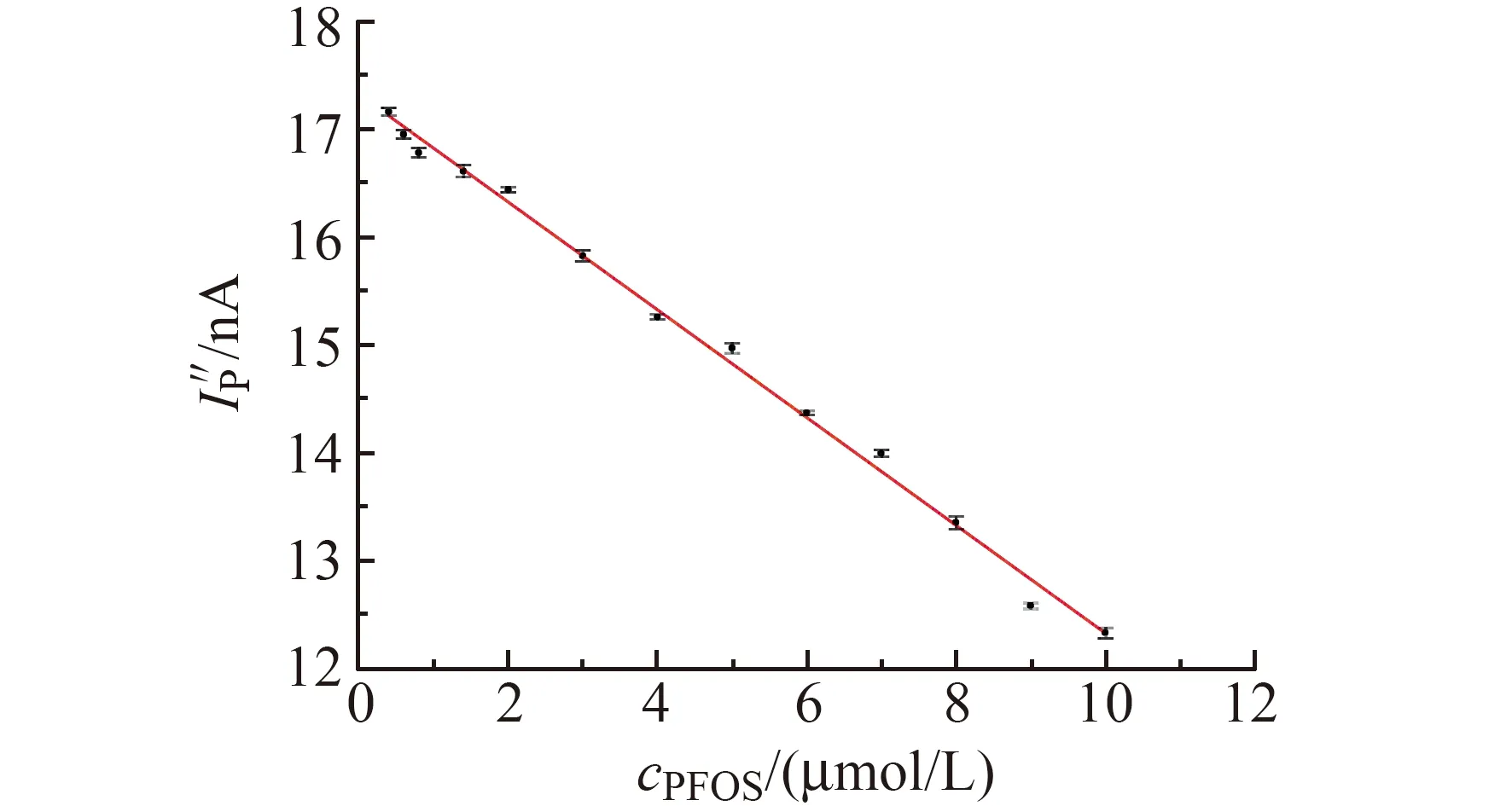
图6 体系峰电流与低浓度范围内PFOS的线性曲线Fig.6 Linear curve of PFOS and peak current in low concentration range
2.3 精密度实验
分别配制6组含有低浓度0.2 μmol/L PFOS以及含有高浓度40 μmol/L PFOS的标准溶液,低浓度下RSD为0.80%,高浓度下RSD为1.26%。说明本方法重现性较好,有着较高的精密度。
2.4 选择性和共存物质的影响
为了考察该检测PFOS方法的选择性,实验考察了PFOS的同系物全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟己酸(PFHeA)、全氟葵酸(PFDeA)、全氟戊酸(PFPeA)对BBR体系以及BBR+PFOS体系峰电流的影响。实验结果表明,该体系对于上述全氟化合物无响应,对BBR及BBR+PFOS体系峰电流均无影响,表明以该法检测PFOS,具有较好的选择性。
此外,考察了水体中可能存在的共存离子对于PFOS分析检测的影响,固定PFOS为0.6 μmol/L,干扰组分均为6 000 μmol/L,设定5%的误差范围内,实验结果如表3所示。从表中可得出,各离子的相对误差大多数在5%以内,说明水体中常见离子对该法均无明显影响。
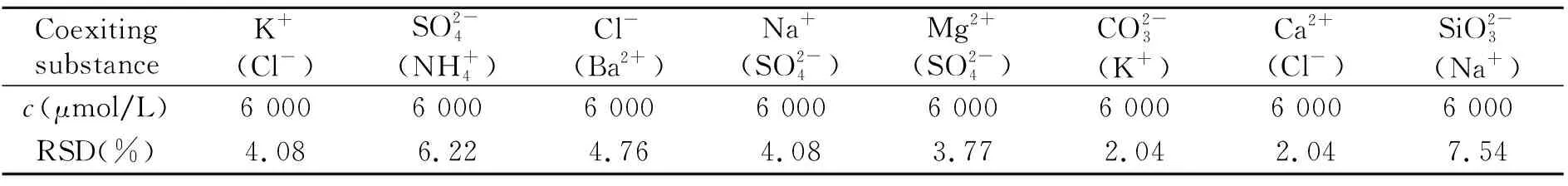
表3 共存物质的影响
2.5 样品分析
2.5.1 样品的采集选用玻璃器皿为采样器,对玻璃器皿进行清洗,先用HCl浸泡,再以流水冲洗,最后再用超纯水清洗3次,晾干备用。采集实验室自来水、成都理工大学的砚湖以及东风渠(成都理工大学河段),砚湖采样点为湖四周和湖心,东风渠采样点为不同河流流段的水样。分别将三份水样静置待悬浮物质沉淀,再使用0.45 μm滤膜过滤两次,备用。
2.5.2 加标回收实验按照实验方法,检测实际水样中的PFOS及加标回收实验,实验结果如表4所示。在三种水样中,PFOS均为未检出,加标回收率为95.00%~105.50%。说明本实验建立的测定环境水体中PFOS含量的极谱新法,具有较高的准确度,为PFOS的检测提供了可选择的方法。
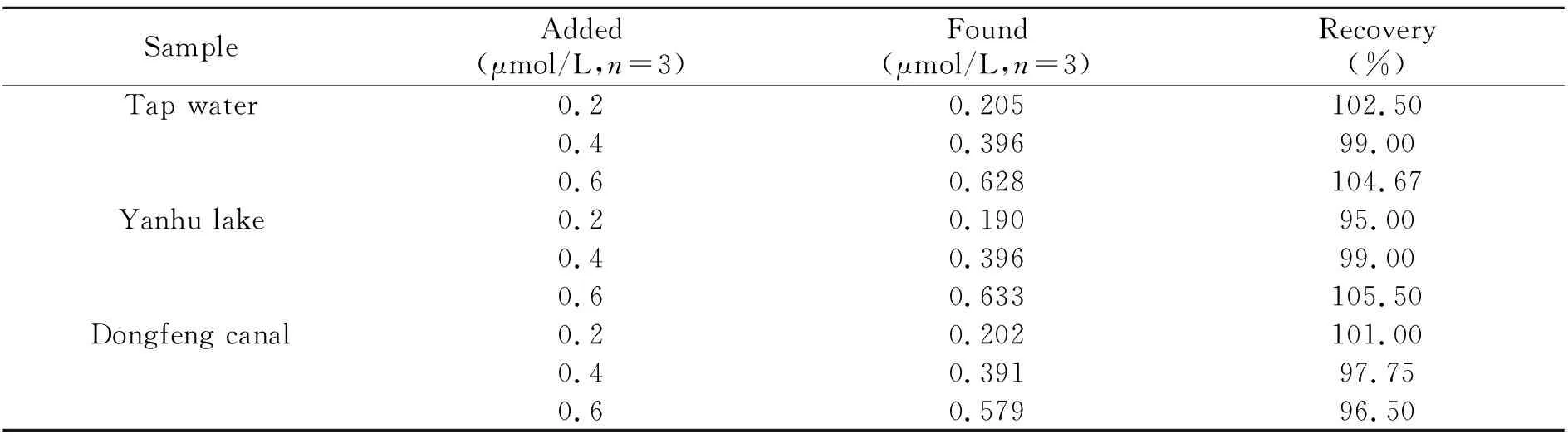
表4 水样中PFOS加标回收实验
3 反应机理
3.1 极谱测定机理
BBR在水溶液中以季铵氮正离子形式存在,季铵氮和C-8之间有一个C=N双键,该双键具有电化学活性,可以在电极上还原。该还原过程分为两步:第一步为C=N双键接受一个电子生产中间体自由基;第二步为该中间体自由基接受一个单电子还原[10]。
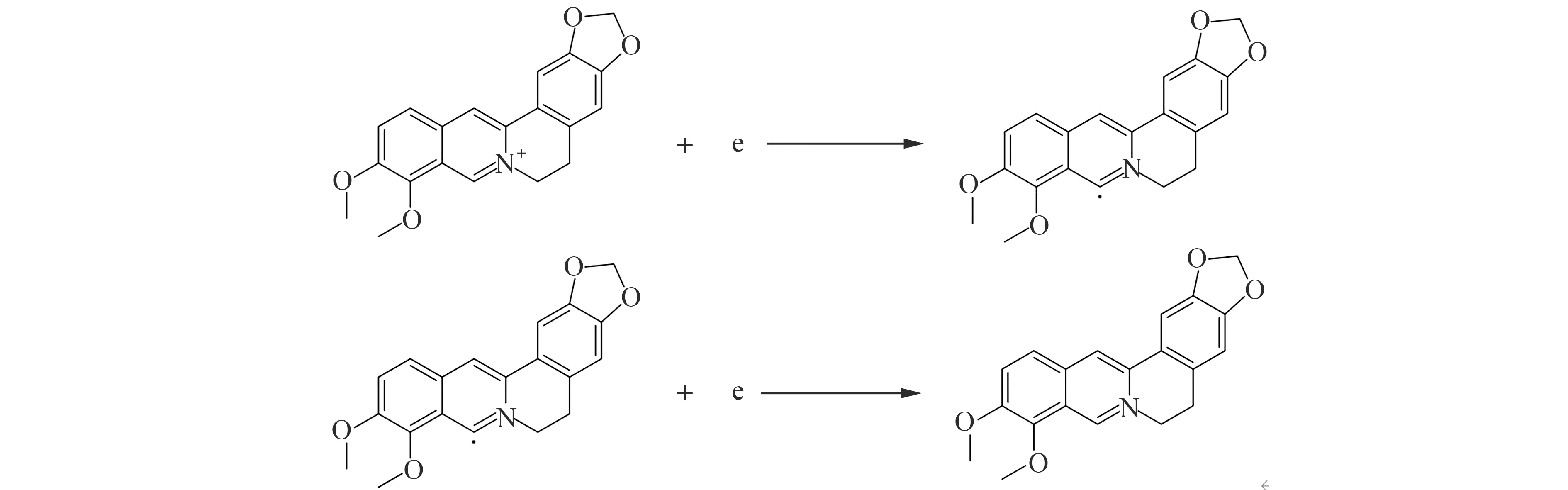
图7 BBR还原反应Fig.7 Reduction reaction of BBR
3.2 PFOS间接测定机理
BBR为异喹啉类生物碱,其异喹啉分子骨架上含有季铵氮,在水溶液中变成季铵氮阳离子,此阳离子可与PFOS上带负电荷的磺酸基团相互作用从而形成离子缔合物。体系中BBR的量减少导致峰电流的下降,而峰电流的变化值与PFOS的浓度呈显著相关性,从而可以间接检测PFOS。
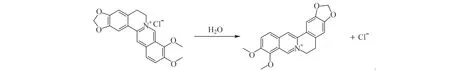
图8 BBR在水中的解离Fig.8 Dissociation of BBR in water
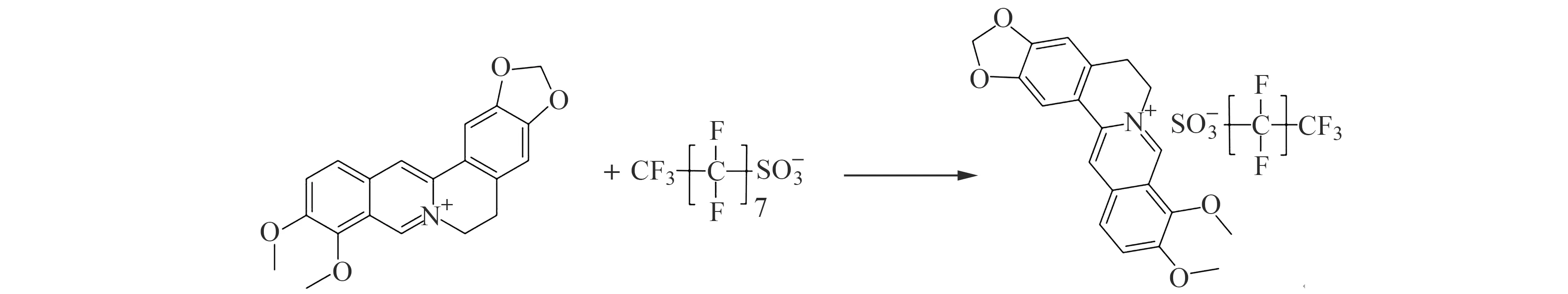
图9 BBR和PFOS反应式Fig.9 Reaction between BBR and PFOS
4 结论
本研究基于带负电的PFOS与带正电的BBR通过静电作用形成稳定的离子缔合物,建立了一种使用单扫描极谱检测体系中BBR的峰电流从而间接检测PFOS的新方法。在最优条件下,当PFOS浓度处于0.2~60 μmol/L范围内,峰电流与PFOS浓度呈良好的指数关系(R2=0.9979),检测限为0.13 μmol/L。相对标准偏差为0.80%~1.26%,该方法具有较高的精密度和稳定性。将本方法用于对实际样品的分析测定,加标回收率在95.00%~105.50%之间,符合分析要求。
