耐酸性及抗离子干扰氮掺杂碳量子点检测Fe(Ⅲ)
2022-07-23黄永俊黄加玲曹功勋刘凤娇骆嘉燚黄昭景李顺兴
黄永俊, 黄加玲, 曹功勋, 刘凤娇, 满 珊,骆嘉燚, 黄昭景, 李顺兴*,2
(1.闽南师范大学化学化工与环境学院,福建漳州 363000;2.现代分离分析科学与技术福建省重点实验室,福建漳州 363000)
碳量子点(CQDs)拥有成本低廉、环境友好、抗光漂白、易于合成、生物相容性优异[1],以及可通过修饰CQDs表面以提高缺陷的稳定性,提升荧光量子产率和发光性能[2]等优势,在荧光传感[3]、生物成像等方面有广泛的应用。由于其对生物体无毒无害,是一种理想的荧光成像材料[4]。
铁是生物体必需的微量元素,其摄取不足或过量均危及生物体健康[5 - 8]。生物体主要通过水圈,特别是地表水体,摄取铁及其它金属,并通过水圈实现铁的生物可利用[9,10]、生物累积和生物地球化学循环[11],而富含金属的酸性废水是水体铁污染重要来源,因此酸性环境水体中Fe(Ⅲ)的检测是生物圈安全评价的必然要求。虽有在极端pH、离子强度和光辐照下表现出优异的稳定性的CQDs[12],但许多Fe(Ⅲ) 选择性荧光传感器应用受制于与水环境不兼容,或只能在中性溶液中保持良好荧光性能,无法适用于低pH环境中[13]。以多巴胺合成的CQDs在pH=7.0时,对Fe(Ⅲ)的检测有良好的性能,但随pH值由7.0降至4.0时荧光出现减弱的情况;以海藻酸和乙二胺为原料合成的氮掺杂碳量子点(N-CQDs)[14],虽可在pH=4.0条件下检测Fe(Ⅲ),然而在水体中分散性较差,对Fe(Ⅲ)检测线性范围较窄;用绿藻Dunaliellasalina为前驱体合成的氮、硫共掺杂碳量子点(N,S-CQDs)[15],由于水体中存在易干扰的离子Cu(Ⅱ)、Hg(Ⅱ)和Cr(Ⅵ)等,需添加EDTA掩蔽才能实现准确识别和检测Fe(Ⅲ)。
本文通过简易的水热法,以含羧基的柠檬酸为碳源,含苯环、羧基、偶氮、胺基的甲基红为氮源,合成酸碱性表面基团共存、选择性高、Fe(Ⅲ)选择性强的Fe -N-CQDs,制备耐酸性和高选择性Fe(Ⅲ)荧光探针。
1 实验部分
1.1 主要仪器与试剂
pHS-3E型pH计(上海雷磁仪器有限公司);JEM-2100场发射透射电子显微镜(日本,JEOL公司);Thermo Scientific Escalab 250Xi型X射线光电子能谱仪(美国,Thermo Fisher Scientific公司);Nicolet iS5傅立叶变换红外光谱仪(美国,Thermo Fisher Scientific公司);WFH-203C四用紫外分析仪(上海驰唐实业有限公司);UV-5800PC型紫外-可见分光光度计(上海元析仪器有限公司);Cary Eclipse荧光分光光度计(美国,Agilent公司)。
柠檬酸购买于上海阿拉丁生化科技股份有限公司;硫酸奎宁(98%)购自生工生物工程(上海)股份有限公司;甲基红购自美国Sigma-Aldrich;Na2HPO4、NaH2PO4、NaOH、HCl、Zn(NO3)2、CrCl3、CaCl2、HgCl2、NiCl2、NaCl、MgCl2、AlCl3、CdCl2、CoCl2、Fe(NO3)3、FeCl2、Pb(NO3)2、Mg(SO4)2、MnCl2均购买于西陇化工股份有限公司;透析袋购于美国联合碳化Viskase公司。实验用水由Millipore -Q超纯水机(美国Millipore公司)制备(18.2 MΩ·cm)。
1.2 实验方法
1.2.1 Fe -N-CQDs制备以水热法一锅一步制备Fe -N-CQDs。将柠檬酸(3 g)和甲基红(0.25 g)于超纯水(30 mL)中搅拌均匀,密封于内衬聚四氟乙烯的不锈钢高压釜中,于干燥箱中200 ℃水热处理8 h,自然冷却至室温,10 000 r/min离心10 min,取上清液,用0.22 μm滤膜除去大颗粒,得透明浅黄色溶液,放入透析袋(截留分子量2 000 Da)用超纯水透析24 h后,冷冻干燥,于4 ℃冰箱中保存,备用。
1.2.2 荧光量子产率计算鉴于Fe(Ⅲ)敏感荧光激发波长为双激发,其中波长334 nm与硫酸奎宁的350 nm激发相近,硫酸奎宁在350 nm荧光激发下量子产率为0.58,以硫酸奎宁为荧光量子产率标准参照物:Yu=Ys(FuAs/AuFs)。式中Yu,Ys分别表示Fe -N-CQDs和硫酸奎宁荧光量子产率;Fu,Fs分别表示Fe -N-CQDs和硫酸奎宁峰面积;As,Au分别表示硫酸喹啉和Fe -N-CQDs的吸光度值。
1.2.3 Fe(Ⅲ)的检测分别配制Fe(Ⅲ)标准储备溶液,6 μg/mL Fe -N-CQDs储备溶液。取Fe -N-CQDs储备溶液100 μL,分别加入不同量Fe(Ⅲ)标准储备液,并以pH=1.5的HNO3定容到10 mL容量瓶中,获得浓度为0、25、50、75、100、125、150、200 μmol/L的Fe(Ⅲ)标准系列溶液,在激发波长267 nm下分别测定并记录发射波长449 nm处的荧光强度,得到一系列F0-F值,计算得标准曲线方程式、相关系数R2。据3σ/S(σ代表空白样品测量21次的标准偏差,S代表方法灵敏度即标准曲线斜率)求得检出限。
所有检测均在室温下相同条件中进行。为了评估基于Fe -N-CQDs的传感器对天然水体中Fe(Ⅲ)精准识别及检测能力、对酸度和盐度变化的适应性,以酸化水样验证方法性能。江水取自九龙江,池塘水取自闽南师范大学,以0.22 μm滤膜过滤,以10 000 r/min离心10 min,去除不溶性物,测定Fe(Ⅲ)的浓度。
2 结果与讨论
2.1 Fe -N-CQDs表征及性质研究
Fe -N-CQDs的高分辨透射电镜(HRTEM)见图1a。所制备Fe -N-CQDs尺寸均匀,分散良好;粒径分布在2~6 nm之间,据粒径分布图可推算其平均粒径为3.99 nm(图 1b),尺寸分布大致符合正态分布。图1a显示了分辨率良好的晶格条纹,平均间距为0.32 nm,与石墨(002)衍射面相近,这可能与甲基红的苯环结构对石墨碳点的形成相关。
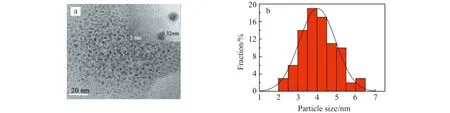
图1 Fe -N-CQDs高分辨透射电镜HRTEM图(a)和粒度分布图(b)Fig.1 HRTEM diagram(a) and particle size distribution diagram(b) of Fe -N-CQDs
Fe -N-CQDs的傅里叶变换红外光谱见图2。分别在3 407、3 070、1 516和2 931 cm-1附近出现吸收带,分别对应于O-H,N-H,C=C和C-H的伸缩振动。1 710 cm-1对应C=O伸缩振动峰,和C-O在1 000~1 400 cm-1处的伸缩振动归结于羧酸和其他含氧官能团的存在。此外,还观察到1 609、1 452 cm-1处另外两个峰,为杂环中C=N 和C-N的典型伸缩模式,表明氮原子不仅以酰胺形式存在于颗粒表面,且以吡啶多芳香族结构存在于CQDs。
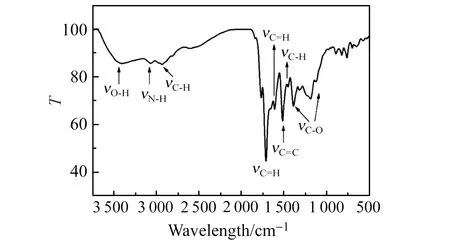
图2 Fe -N-CQDs的傅里叶变换红外光谱Fig.2 Fourier transform infrared(FTIR) spectra of Fe -N-CQDs
用X射线光电子能谱(XPS)测定Fe -N-CQDs表面组成和原子含量。XPS全谱(图3a)在285.17、400.17和532.59 eV处的3个吸收峰,分别归属于C 1s、N 1s和O 1s,含量对应为52.81%、1.08%、46.11%。C 1s的高分辨率XPS(图3b)证实C-C(sp3,284.89 eV),C-N(sp3,285.45 eV),C-O(sp2,286.77 eV)和C=O(sp2,289.11 eV)键的存在,表明Fe -N-CQDs表面含有丰富的亲水基团,这与红外光谱一致。图3c所示的399.5 eV和400.6 eV处N 1s峰表明,氮主要以N-(C)3和N-H存在,这意味着N已经部分掺杂到CQDs中。O 1s谱(图3d)中532.18 eV和533.33 eV处两个拟合峰,分别归属于C=O和C-OH/C-O-C基团。XPS与FTIR同时证明所合成CQDs属N掺杂。
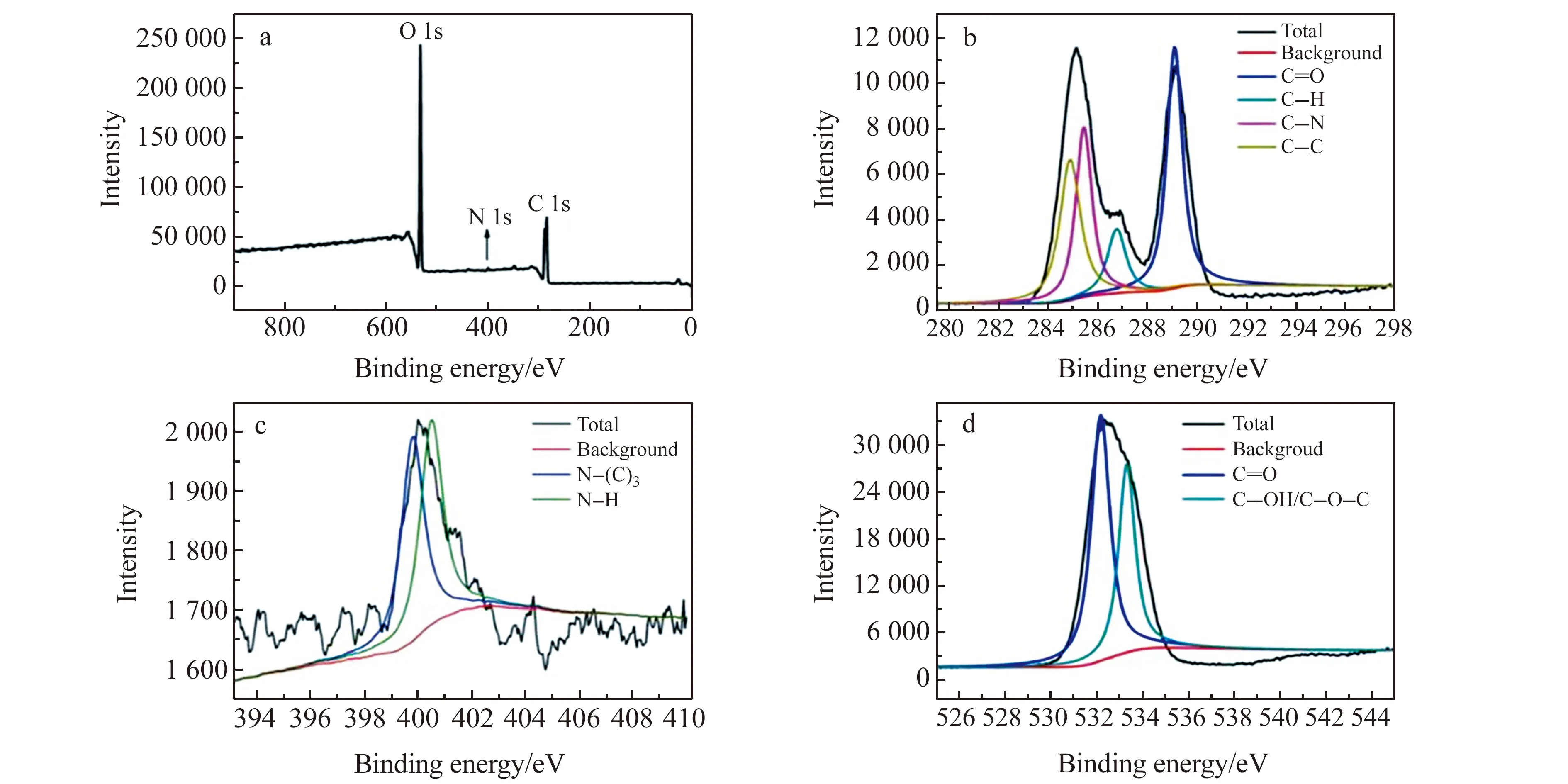
图3 Fe -N-CQDs的X射线光电子能谱(全谱(a)、C 1s谱(b)、N 1s谱(C)、O 1s谱(d))Fig.3 X-ray photoelectron spectroscopy (a),C 1s spectra(b),N 1s spectra(c) and O 1s spectra(d)) of Fe -N-CQDs
2.2 Fe -N-CQDs的光学性质
从荧光激发及发射光谱(图4a)可知,该Fe -N-CQDs有两个激发峰,分别位于267和334 nm处,在两种激发光激发下发射波长分别为449 nm和424 nm。参考荧光发射光谱(图4b)可得Fe -N-CQDs悬浮液在日光和365 nm紫外光照射下分别呈无色偏淡黄色和蓝色荧光;荧光峰位置及强度随着激发波长从237 nm增加到287 nm发生变化,当激发波长为267 nm时发射光谱强度最大,相关荧光行为反映了Fe -N-CQDs不同粒径和不同表面态分布的影响,与大多数碳点和石墨烯量子点情况相同,由于其尺寸分布较窄,Fe -N-CQDs荧光光谱轮廓较窄且对称,荧光量子产率约为10.1%。由紫外-可见光谱(图4c)在219 nm Fe -N-CQDs有最大吸收峰。
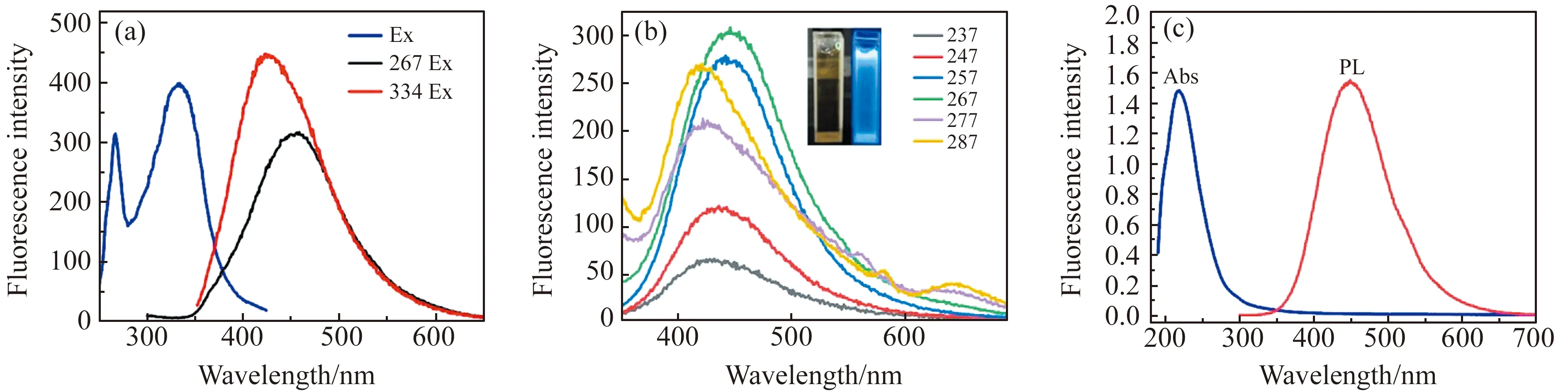
图4 (a)Fe -N-CQDs的荧光激发和发射光谱;(b)不同激发波长下Fe -N-CQDs的荧光光谱;(c)UV/Vis峰处激发的荧光发射光谱Fig.4 (a) Fluorescence excition and emission spectra of Fe -N-CQDs;(b) Fluorescence spectra of Fe -N-CQDs exited at different wavelength;(c) UV/Vis and PL spectra excited at 219 nm of Fe -N-CQDs
Fe -N-CQDs表面含有富氧官能团,因此水溶性好,在水环境中稳定性强。为测试Fe -N-CQDs对水体中pH值和盐度变化的耐受性,测量了Fe -N-CQDs在不同pH值溶液中的荧光强度,如图5所示。对于Fe(Ⅲ)的检测为防止水解往往需要在酸性的条件下测定,本文所合成的Fe -N-CQDs在pH=1~7范围内荧光强度受pH值影响不大,但于pH=1.5处荧光强度最强,因此在酸性环境仍然适用,这归因于Fe -N-CQDs酸碱性表面基团(酚羟基、羧基、氨基)共存,既具备酸碱缓冲性能,解决耐酸性问题,可很好的应用于Fe(Ⅲ)的检测。此外在光照1 h后,Fe -N-CQDs荧光强度没有明显降低,表明Fe -N-CQDs具有良好的光稳定性。
2.3 Fe -N-CQDs对Fe(Ⅲ)选择性荧光检测
将水体中常见金属阳离子(0.5 mmol/L,Mn2+、Pb2+、Cu2+、Zn2+、Cr3+、Ca2+、Hg2+、Ni2+、Na+、Mg2+、Al3+、Cd2+、Co2+、Fe2+、Fe3+)作为测试对象,考察他们与Fe -N-CQDs共存时的荧光强度变化,如图6所示。在浓度相同的情况下,Fe(Ⅲ)对Fe -N-CQDs溶液荧光猝灭效果明显,其它常见金属离子均未观察到明显变化,即可实现精准识别Fe(Ⅲ)。Fe -N-CQDs对Fe(Ⅲ)具有高选择,这可能归因于N掺杂对CQDs的化学和电学特性的诱导效应,特别是表面酚羟基、氨基和羧基等与Fe(Ⅲ)配位,形成配合物,以选择性键合解决共存金属阳离子干扰,辐射跃迁被破坏,导致荧光猝灭。
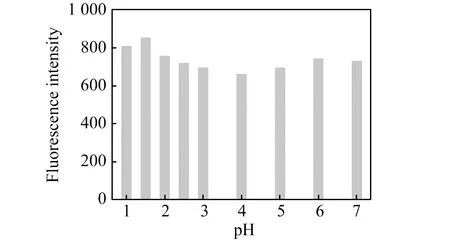
图5 pH值对Fe -N-CQDs荧光强度的影响Fig.5 Effect of pH value on fluorescence intensity of Fe -N-CQDs
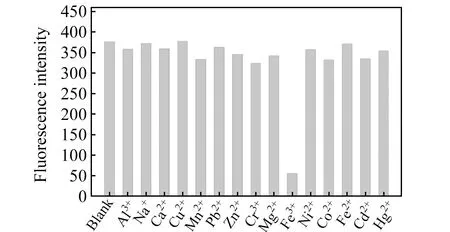
图6 金属离子(0.5 mmol/L)对Fe -N-CQDs荧光强度的影响Fig.6 Effect of metal ions(0.5 mmol/L) on fluorescence intensity of Fe -N-CQDs
2.4 Fe -N-CQDs检测Fe(Ⅲ)的工作曲线及检出限
配制浓度为0~200 μmol/L的Fe(Ⅲ)系列标准溶液,在pH=1.5,激发波长为334 nm下,测试Fe -N-CQDs 对Fe(Ⅲ)的荧光猝灭情况。如图7a所示,荧光强度在Fe(Ⅲ)浓度为0~200 μmol/L范围无显著的减弱,荧光情况与Fe(Ⅲ)浓度的关系如图7b所示。
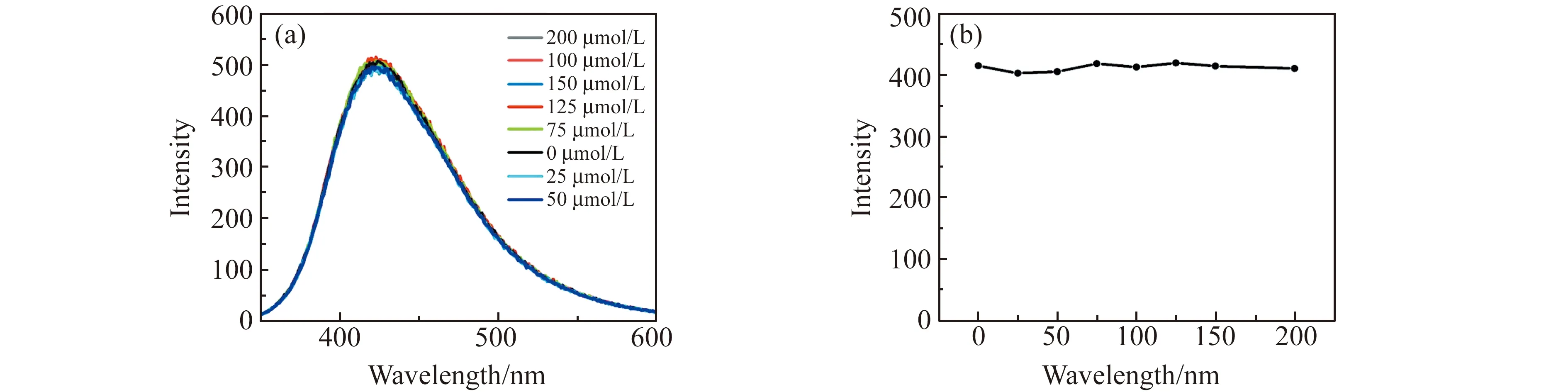
图7 334 nm波长激发下Fe(Ⅲ)的荧光发射光谱Fig.7 Fluorescence emission of Fe(Ⅲ) excited at 334 nm
改变激发波长为267 nm,在相同条件下,测试Fe -N-CQDs对Fe(Ⅲ)检测的灵敏度及线性范围。将不同浓度Fe(Ⅲ)加入到Fe -N-CQDs溶液中,测量其荧光强度。如图8(a)所示,随Fe(Ⅲ)浓度增加,荧光强度逐渐减弱,相对荧光强度(F0-F)与Fe(Ⅲ)浓度的关系如图8(b)所示。Fe(Ⅲ)在2.3~200 μmol/L范围内具有良好的线性关系(R2=0.9917),可实现对Fe(Ⅲ)的定量检测,检出限为2.3 μmol/L。
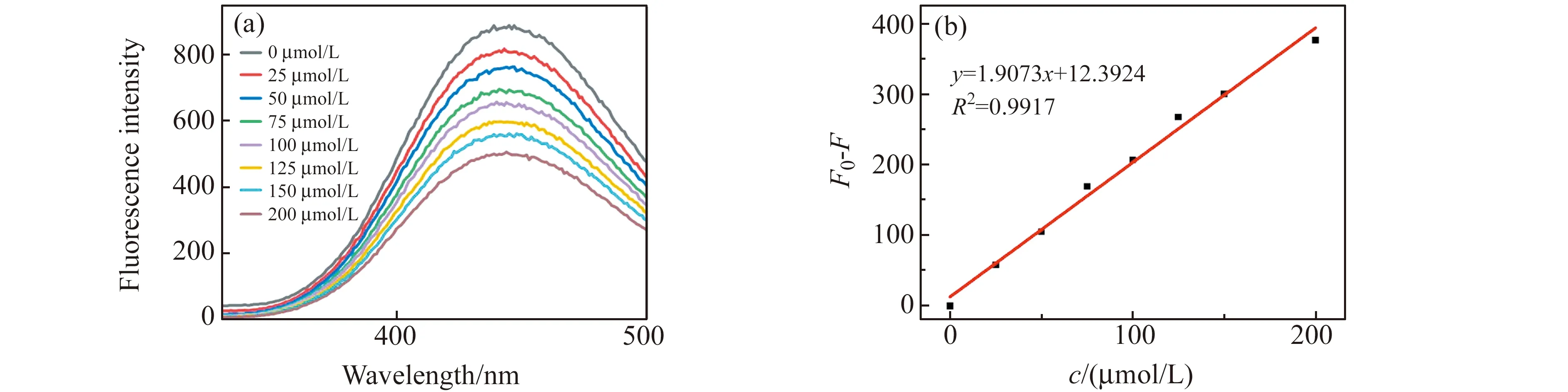
图8 (a)Fe -N-CQDs对不同浓度Fe(Ⅲ)的荧光强度,Fe(Ⅲ)浓度-荧光猝灭相关曲线Fig.8 (a) Fluorescence intensity of Fe -N-CQDS to different Fe(Ⅲ) concentrations;(b)Correlation curve of Fe(Ⅲ) concentration and fluorescence quenching
与不同碳源所制备的CQDs对Fe(Ⅲ)的检测性能相比较如表1。
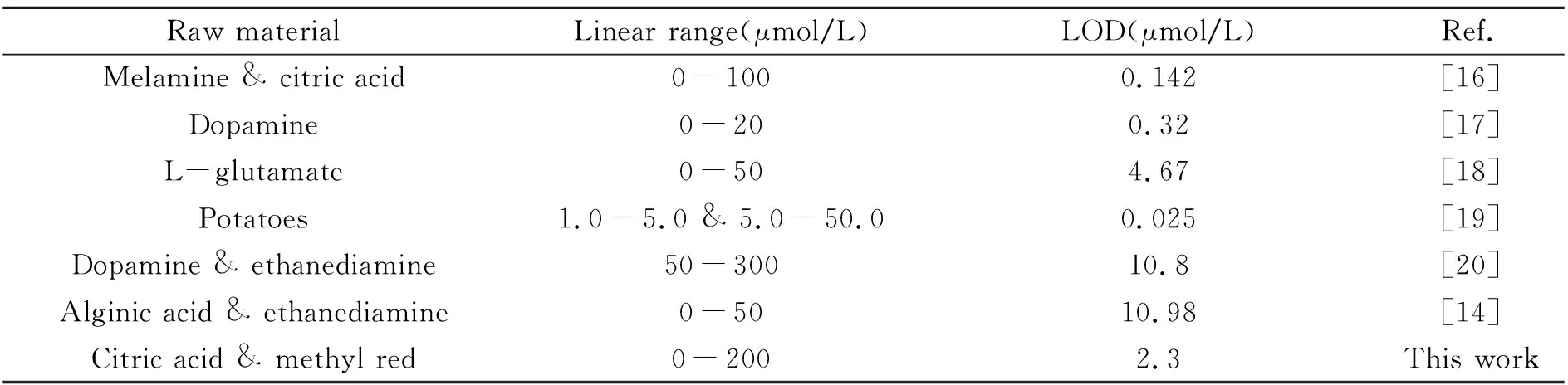
表1 不同碳源制备的CQDs对Fe(Ⅲ)检测性能比较
2.5 水样中Fe(Ⅲ)的检测
将采集的九龙江水样和学校池塘水水样经酸化预处理为pH值1.5后,应用所建立的荧光方法检测,同时采用电感耦合等离子体质谱(ICP-MS)法检测水样中Fe(Ⅲ)浓度。结果如表2所示,基于Fe -N-CQDs荧光检测技术与ICP-MS法结果相近。

表2 水样中Fe(Ⅲ)的测定(n=3)
3 结论
以柠檬酸和甲基红作为前驱体,通过一锅一步水热法制备尺寸均一、水中分散性良好、双波长激发、抗金属阳离子干扰、耐酸性、对Fe(Ⅲ)选择性和灵敏度高的Fe -N-CQDs。该方法适用于酸性环境中的Fe(Ⅲ) 检测,具有成本低、灵敏度高、线性范围宽等特点。
