小麦麸皮粗多糖的基本结构特征、流变特性及其对体外消化酶抑制初探
2022-07-23陈什康柳芳伟宋萧萧殷军艺
王 鑫,陈什康,张 婷,柳芳伟,宋萧萧,殷军艺
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
小麦麸皮是小麦加工过程中的主要副产物,约占谷物总重量的14%~19%[1],具有丰富的蛋白质、维生素、矿物质等营养物质,每年产量可达3000万吨以上。因原料价格低廉,主要用于猪饲料加工,很少用于食品深加工和再利用。小麦麸皮作为一种重要的膳食纤维来源,其主要活性物质是非淀粉多糖,包括阿拉伯木聚糖(52%~70%)、纤维素(20%~24%)和β-葡聚糖(6%)[1]。相对于β-葡聚糖,阿拉伯木聚糖(Arabinoxylan,AX)因其溶解性较低,结构复杂多样,且易与其他细胞壁组分如蛋白质、木质素、木酚素等相互作用,研究更为复杂,AX的深入研究对小麦麸皮的加工与利用有着重要的意义。
AX广泛存在于谷物细胞壁中,是谷物细胞壁的重要组成成分,具有降血糖血脂[3]、抗氧化[4]、抗肿瘤[5]、免疫调节[6]和保护肠道[7]等生物活性,特别是缓解肝脏损伤以及促进肠道中益生菌的数量增长[8]。多糖的结构特征对其生物活性有着重要影响,包括分子量、单糖组成、连接方式、聚合度以及分支程度等[8]。此外,不同提取方式对多糖的结构特征有重要影响,AX的提取方式主要有热水浸提、酶法提取与碱提法。AX通常以结合态的形式与蛋白质和纤维素连接,不易提取,碱溶剂可以断裂AX与细胞壁其他成分之间的酯键和氢键,释放水相半纤维,除去糖醛酸和乙酰基,将分子间牢固的共价结合打断,故碱液常用来提取小麦麸皮、米糠、玉米皮等谷物中的AX[10]。AX是以β-(1→4)糖苷键连接的D-吡喃木糖残基为主链,α-1,2和α-1,3糖苷键连接的α-L-阿拉伯呋喃木糖基为侧链连接而成的多糖,如图1所示,A/X代表AX的支链化程度,表示AX中阿拉伯糖基无规则的连接在木聚糖主链上,A/X值越大代表支链化程度越高。
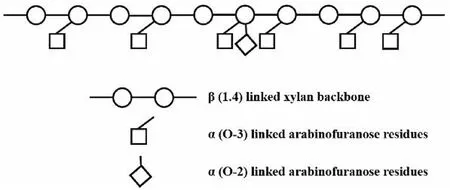
图1 阿拉伯木聚糖的结构示意图[11]Fig.1 Structural diagram of Arabinoxylan[11]
有研究表明,不同植物来源多糖具有不同的抑制α-葡萄糖苷酶和α-淀粉酶活性[12]。袁平川等[13]人研究发现牛蒡水提多糖具有良好的抑制α-葡萄糖苷酶活性,且动物实验也表明具有量好的降血糖活性。因此,体外消化酶抑制实验的研究有助于从食品角度开发降血糖产品。
目前,关于小麦麸皮阿拉伯木聚糖(Wheat bran arabinoxylan,WBAX)提取与结构分析的研究有很多,但基于黏度分析与体外消化酶抑制研究较少,同时,WBAX具有很好的降血糖功能,但其降血糖功能是否是通过抑制消化酶活性进而调节血糖目前尚未可知,因此,本研究旨在研究小麦麸皮阿拉伯木聚糖基本特征、流变特性、热稳定性和体外消化酶抑制,为今后相关研究提供理论指导。
1 材料与方法
1.1 材料与试剂
小麦麸皮购于陕西省延安市,购买后再次干燥密封保存。
耐高温α-淀粉酶和胰蛋白酶购于阿拉丁试剂有限公司;单糖标准品(L-鼠李糖、D-阿拉伯糖、D-甘露糖、D-葡萄糖、D-半乳糖、木糖、D-果糖、D-核糖、L-岩藻糖、D-半乳糖醛酸和D-葡萄糖醛酸)购于美国Sigma-Aldrich公司;不同分子量的葡聚糖标准品(T-10、T-40、T-70、T-500、T-2000)购于美国Pharmacia公司;考马斯亮蓝G-250购于上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
E2695高效液相色谱仪,美国Waters公司;Dionex ICS 5000离子交换色谱仪、Nicolet 5700傅里叶变换红外光谱仪、高速冷冻离心机、低温保存箱,美国赛默飞世尔科技公司;Milli-Q超纯水仪,美国密理博公司;ARES-G2型流变仪,美国TA公司;JSM 6701F场发射扫描电子显微镜(SEM)(配有能谱仪),日本电子株式会社;T-9普析通分光光度计,北京普析通用有限公司。
1.3 方法
1.3.1 WBAX的制备
参考黎芳[14]的方法提取多糖,稍作修改。称取一定量小麦麸皮经82%乙醇溶液(料液比为1:10,m:v)于室温条件下浸泡24 h,冷却后挥干乙醇得到小麦麸皮,再将小麦麸皮转移至水中(料液比为1:10,m:v)并于52 ℃进行提取(2 h,重复3次),冷却后离心(4800 r·min-1,10 min),收集固体残渣,乙醇洗脱后烘干,得到脱脂小麦麸皮。将脱脂小麦麸皮置于0.5 mol NaOH溶液中(料液比为1:10,m:v),60 ℃匀速搅拌2 h,离心分离(4800 r·min-1,10 min)后,收集上层清液用1 M HCl调节pH值至7,加入耐高温α-淀粉酶(1%,w/w,酶活力:10万 u·mL-1)于95 ℃下酶解3 h,离心分离混合液,收集上层清液,旋蒸浓缩后用95%乙醇进行沉淀,使其终浓度为80%,4 ℃静置12 h,离心收集多糖沉淀(10000 r·min-1,10 min),复溶旋蒸后采用蒸馏水于4 ℃下透析72 h,冷冻干燥得到WBAX。
1.3.2 基本化学组成分析
本研究多糖WBAX以葡萄糖为标准品,采用苯酚-硫酸法测定中性糖含量[16];以半乳糖醛酸为标准品,采用硫酸-咔唑法测定糖醛酸的含量[15];以牛血清蛋白为标准品,采用考马斯亮蓝法测定总蛋白的含量[17];采用Megazyme Tolal Srarch试剂盒中的AOAC official Method 996.11的方法测定淀粉含量。
1.3.3 均一性相对分子质量测定
采用高效液相凝胶渗透色谱法(HPGPC)对WBAX的均一性及相对分子质量进行分析。准确称取适量样品,将多糖样品用0.02%的NaCl水溶液完全溶解配置成1 mg·mL-1的糖溶液,过0.22 μm水系滤膜后进样检测。同时,以Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500、Dextran T-2000和Glc为标准品绘制标准曲线来计算样品的相对分子质量。
色谱条件:色谱柱采用UltrahydrogelTM保护柱(6 mm×40 mm)和UltrahydrogelTM线性凝胶柱(7.8 mm×300 mm)联用;检测器为示差检测器(RID,2414)和紫外检测器(VWD,2489)联用,紫外波长设为280 nm;柱温为35 ℃;流速为0.6 mL·min-1;进样体积20 μL;数据采集时间为30 min。
1.3.4 单糖组成分析
单糖组成的方法参考以前的相关研究进行了一些修改[18]。采用高效阴离子交换色谱-脉冲安培法(HPAEC-PAD)测定单糖组成。准确称取5 mg多糖样品,于冰浴条件下加入0.5 mL 12 mol·L-1硫酸溶液,搅拌30 min后,加入2.5 mL去离子水稀释,然后转移至100 ℃油浴锅中并搅拌水解2 h。水解完全后进行充分冷却,将水解液定容至50 mL容量瓶并稀释5倍,过0.22 μm水系滤膜后进Dionex ICS 5000离子交换色谱系统进行检测。
色谱条件:采用Dionex Carbo Pac PA20分析柱(3×150 mm)和Dionex Carbo Pac PA20保护柱(3×30 mm)串联使用;采用三元梯度洗脱,流动相A、B、C分别为250 mmol·L-1NaOH溶液、超纯水、1 mol·L-1NaOAc和10 mmol·L-1NaOH溶液混合液,流速为0.5 mL·min-1;柱温为30 ℃,系统温度25 ℃,进样体积10 μL。
1.3.5 傅里叶变换红外光谱分析
将多糖样品置于真空干燥12 h以上,取经干燥的1~2 mg多糖样品与KBr粉末研磨混合压片,采用Thermo Nicolet 5700 FT-IR傅里叶红外光谱仪在4000~400 cm-1范围内进行扫描,分辨率为4 cm-1。
1.3.6 WBAX表观黏度分析
将WBAX样品充分溶解于去离子水中,磁力搅拌均匀后静置12 h以上。测定不同浓度(1%,2%,3%,4%和5%,w/v)和不同温度(5 ℃,15 ℃,25 ℃,35 ℃,45 ℃和55 ℃)下流体类型和稳定流动行为。用ARES-G2流变仪测定多糖的表观黏度(夹具直径为40 mm,间隙为0.046 mm),剪切速率为0.1~1000 s-1测试。设有平行实验,平行测定3次。
1.3.7 热稳定性分析
称取适量样品放入热重分析仪中进行测试,分析不同温度处理多糖的热稳定性。测试条件:扫描温度:20 ℃~600 ℃;升温速度:10 ℃/min;N2流速:20 mL·min-1。
1.3.8 固体形貌分析
称取一定量的多糖样品,将样品配制成0.5 mg·mL-1的溶液,充分溶解后于液氮中预冻10 min,立刻转移至-80 ℃超低温冰箱,冷冻干燥得到多糖样品,喷金后于扫描电镜下观察,通过XT Microscope Control软件采集图谱。
1.3.9 体外消化酶抑制效果初探
1.3.9.1 α-葡萄糖苷酶抑制活性测定
参考李安琪[19]等的方法并进行适当修改。于96孔板中加入40 μL样品或阳性对照阿卡波糖,加入α-葡萄糖苷酶20 μL,于恒温摇床中37 ℃孵育5 min后,加入50 μL底物,于恒温摇床中37 ℃孵育60 min,结束后加入50 μL碳酸钠溶液即可终止反应,于405 nm处测定吸光度值。A-葡萄糖苷酶抑制试验重复3次,抑制率计算公式如下:
式中:A1,A2,A3和 A4分别为405 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.3.9.2 α-淀粉酶抑制活性测定
参考Sun[20]等的方法并进行部分修改。于0.5 mL冻存管中加入25 μL样品或阳性对照阿卡波糖,加入耐高温的α-淀粉酶25 μL,于恒温摇床中37 ℃孵育10 min后,加入25 μL底物,于恒温摇床中37 ℃孵育10 min,加入25 μL显色剂DNS,沸水浴5 min,冷却至室温,反应液用蒸馏水稀释2.5倍,于540 nm处测定吸光度值。抑制率计算公式如下:
式中:A1、A2、A3和 A4分别为540 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.4 数据处理与分析
样品进行平行测定3次,采用SPSS软件进行数据统计,对独立样本进行单因素方差分析,采用Tukey法进行两两比较,P<0.05认为数据间具有显著性差异。
2 结果分析
2.1 WBAX基本理化性质
对WBAX的基本理化性质进行分析,结果如表1所示。由表可知,小麦麸皮阿拉伯木聚糖的中性糖含量为83.4%,整体的纯度较高。

表1 小麦麸皮阿拉伯木聚糖WBAX基本理化分析(平均值±标准偏差,n=3)Tab.1 Physicochemical properties of WBAX (mean±SD,n=3)
2.2 相对分子质量
采用HPGPC测定多糖的相对分子质量。多糖的相对分子量Mw与分配系数Kαv存在如下关系:
Kav=-blogMw+C(式中b、C为常数)
以T-2000、T-500、T-70、T-50、T-10的葡聚糖以及Glc标准品为标样,得到标准曲线方程为Kav=-0.242 0 logMw+1.5642,R2=0.993 6。
如图2所示,WBAX具有较宽的相对分子量分布,出现两个明显的洗脱峰Peak-Ⅰ和Peak-Ⅱ,且Peak-Ⅰ的含量比Peak-Ⅱ更高,根据不同组分的保留时间,依据葡聚糖标准曲线方程求得两个峰的相对分子质量分别为112和51 kDa,这个结果与Lv[12]等所报道的碱提小麦麸皮阿拉伯木聚糖分子量基本一致(107 kDa),但不同种属和产地均会造成不同差异。
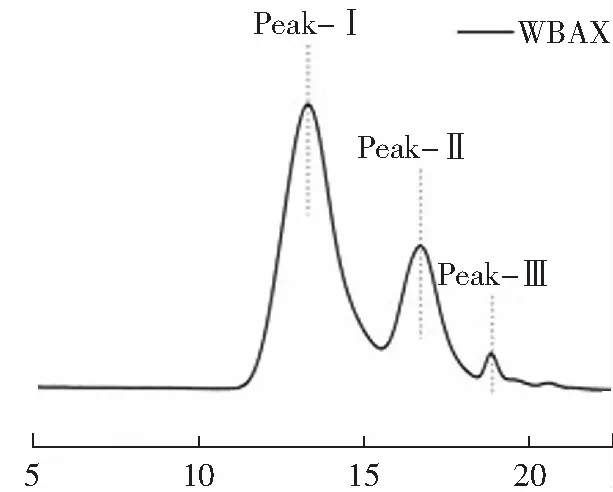
t/min图2 WBAX高效凝胶渗透色谱Fig.2 HPGPC profiles of WBAX
2.3 单糖组成分析
单糖组成结果如表2所示,WBAX中主要为阿拉伯糖和木糖,含量分别为30.3%和37.8%,另有极少量的葡萄糖(1.6%)、半乳糖(2.8%)、葡萄糖醛酸(1.9%)和半乳糖醛酸(0.5%)。阿拉伯糖与木糖的摩尔比(A/X)为0.8,代表了阿拉伯木聚糖高度支化[21]。Revanappa[11]等人研究发现不同来源小麦麸皮中阿拉伯木聚糖的分支程度有较大差异,A/X值分别为1.16,1.14,0.80,0.65,且A/X的大小主要取决于小麦麸皮的种类和来源以及提取方法[22,23]。通常,碱法提取得到的多糖的A/X值高于热水提取法得到的A/X值[24]。

表2 小麦麸皮阿拉伯木聚糖WBAX的单糖组成(平均值±标准偏差,n=3)Tab.2 Monosaccharide copmpositions of WBAX (mean±SD,n=3)
2.4 红外光谱分析
WBAX的红外光谱如图3所示,WBAX在3400和2924 cm-1处有明显的吸收峰,分别为多糖羟基的伸缩振动峰[25-26]和甲基或亚甲基碳氢的伸缩振动峰[27];1411 cm-1处的吸收峰为C-H的弯曲振动,由此推断WBAX是糖类化合物[27]。1044 cm-1处的吸收峰为阿拉伯木聚糖的典型特征峰,上述结果表明,WBAX为典型的阿拉伯木聚糖[29]。
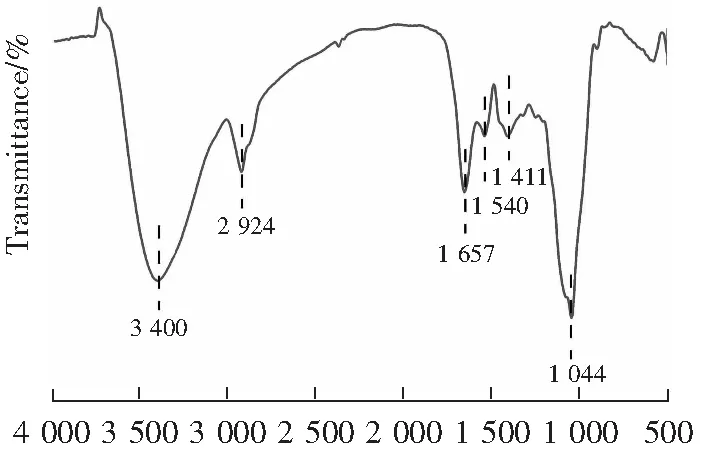
λ/cm-1图3 WBAX傅里叶变换红外光谱图Fig.3 FT-IR spectrum of WBAX
2.5 表观黏度分析
2.5.1 质量分数对WBAX表观黏度的影响
WBAX的表观黏度随剪切速率的变化如图4所示,WBAX是典型的非牛顿流体[30],具有剪切变稀的流体行为,这种现象归因于多糖的随机线圈的形成。当剪切速率增加时,多糖的分子链被破坏,导致分子链的取向变得更加随机[31],因此相邻链之间的相互作用减少,从而降低了黏度[32]。除此之外,随着多糖质量分数的增加,表观黏度逐渐增加,说明其表观黏度和流体行为受多糖浓度的影响[33],主要由于多糖浓度增加时,多糖的分子数量及分子间强度增大[34]。
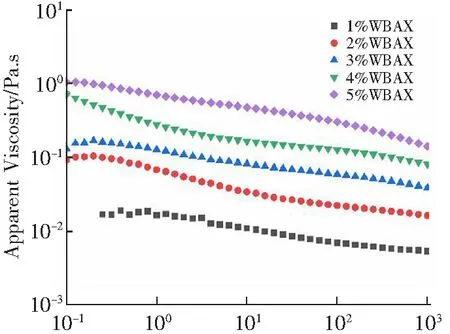
Shear rate/s-1图4 质量分数对WBAX的表观黏度的影响Fig.4 The effect of polysaccharide concentration on apparent viscosity of WBAX
2.5.2 温度对WBAX表观黏度的影响
由图5可知,当温度变化时,4%的多糖溶液均为具有剪切稀化的非牛顿流体[30]。多糖的表观黏度随温度的升高而降低,由于分子的动力学运动随温度的升高而更加活跃,从而促进了多糖链的解缠,分子间相互作用力减弱,因此导致样品黏度降低[35]。
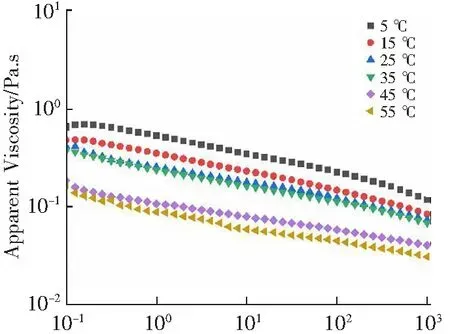
Shear rate/s-1图5 温度对4% WBAX的表观黏度的影响Fig.5 The effect of temperature on apparent viscosity of 4% WBAX
2.6 热稳定性分析
图6是小麦麸皮阿拉伯木聚糖的热解失重曲线。多糖中存在大量的亲水基团,可以吸附一定的水量,当温度升高时,水分蒸发,使得多糖样品质量有所减少[36]。30 ℃~132 ℃是WBAX热解过程中的失水阶段,质量损失缓慢,约为3.8%;第二阶段为热解准备阶段(132 ℃~244 ℃),失重率变化很小,约为3.2%;当温度在306 ℃时,有明显的失重台阶,失重率超过42.7%,表明样品在本阶段受热大量分解,生成挥发性物质,导致质量发生明显下降;第四阶段为碳化阶段(306 ℃~600 ℃),由于碳的热分解作用,使其质量逐渐降低。结果表明,WBAX在30 ℃~132 ℃温度范围内具有较好的稳定性,可用于高温加工的食品中。
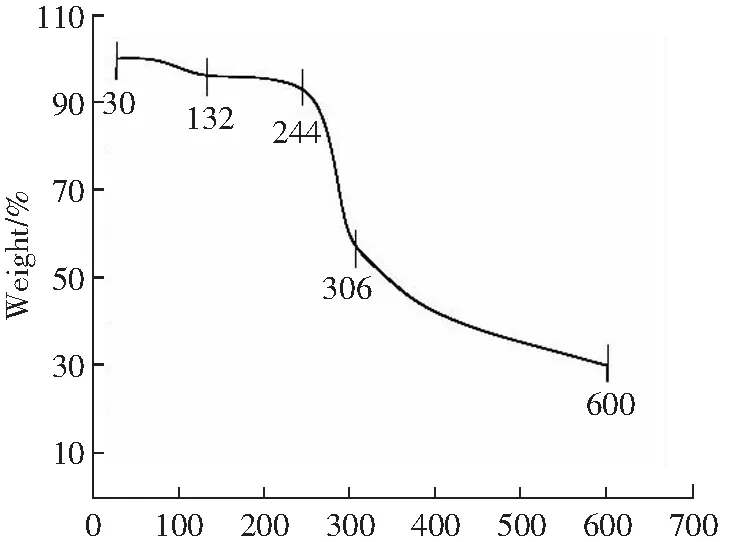
T/℃图6 WBAX的TG图Fig.6 Termal gravimetric spectrum of WBAX
2.7 SEM表征
为了获取多糖的固体形貌,采用扫描电镜的方法获取不同放大倍数下WBAX的表观形貌。图7为放大5000倍(A)和10000倍(B)的WBAX的SEM图。由图7可知,WBAX主要存在片状、球状和丝状等结构。

(a) 5 000×

(b) 10 000×图7 WBAX的SEM图Fig.7 SEM images of WBAX
2.8 体外消化酶抑制效果分析
2.8.1 α-葡萄糖苷酶抑制活性测定
图8为阳性对照阿卡波糖及WBAX对α-葡萄糖苷酶的抑制率折线图。由图可知,阳性对照阿卡波糖对α-葡萄糖苷酶抑制率曲线平滑,抑制率随浓度的增大而增大,呈现较强的规律性,运用SPSS软件计算其IC50(抑制率为50%时抑制剂的浓度)值为9.99 mg·mL-1,而WBAX对α-葡萄糖苷酶的活性有较弱的抑制效果,抑制率与多糖浓度关系的规律性不明显[19]。
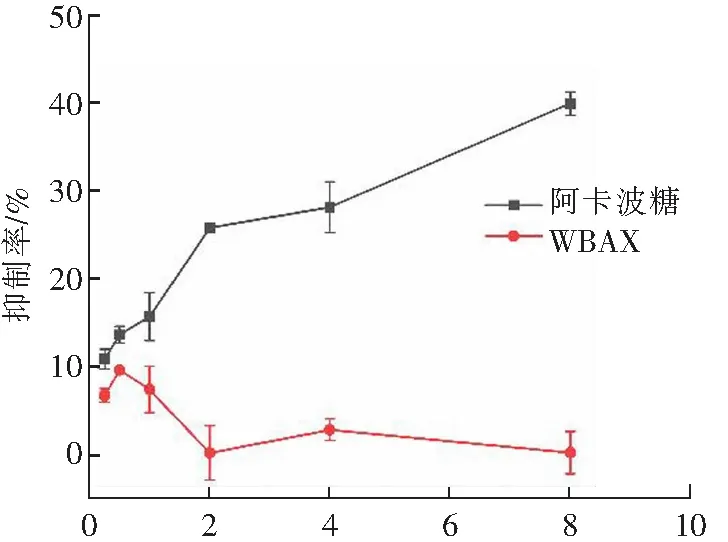
ρ/(mg·mL-1)图8 阿卡波糖及WBAX对α-葡萄糖苷酶活性的抑制效果Fig.8 Inhibitory effect of acarbose and WBAX on α-glucosidase activity
2.8.2 α-淀粉酶抑制活性测定
图9为阳性对照阿卡波糖和多糖WBAX对α-淀粉酶抑制率的折线图。由图可知,阳性对照阿卡波糖对α-淀粉酶抑制率曲线平滑,具有较强的规律性,抑制率随阿卡波糖浓度的增加而增大,其IC50为0.43 mg·mL-1。WBAX对α-淀粉酶的抑制率有一定的规律性,但较阳性对照阿卡波糖相比,抑制能力有限。有研究表明,小麦麸皮阿拉伯木聚糖具有降血糖活性,AX可通过促进胰岛素的分泌,上调脂肪磷酸甘油醛脱氢酶(GAPDH)和腺苷酸活化蛋白激酶(AMPK)的表达,促进线粒体脂肪酸氧化以及脂肪组织对葡萄糖的利用来降低血糖[37]。多糖的降血糖活性机制涉及多个方面,并不是简单的消化酶抑制。因此,与本研究结果结合,小麦麸皮阿拉伯木聚糖可能是从多个方面调节体内代谢,而不是简单地通过抑制α-葡萄糖苷酶和α-淀粉酶的活性来达到对血糖的调控[38]。
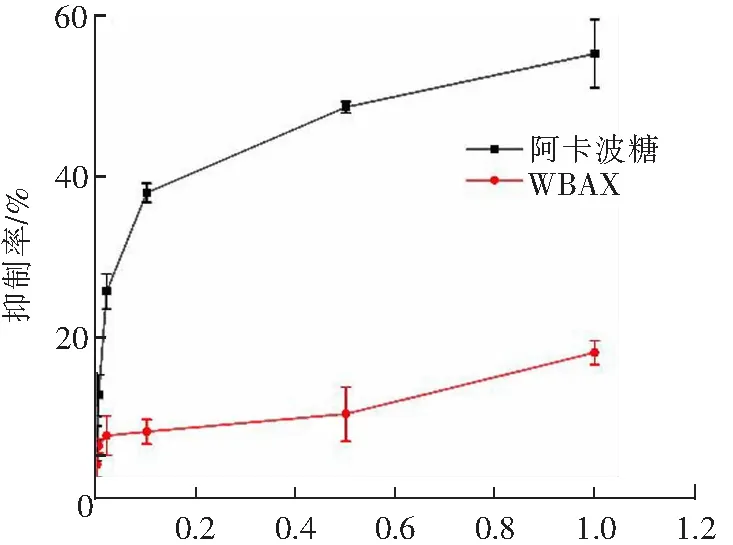
ρ/(mg·mL-1)图9 阿卡波糖及WBAX对α-淀粉酶活性的抑制效果Fig.9 Inhibitory effect of acarbose and WBAX on α-amylase activity
3 结论
本研究以WBAX为研究对象,系统研究了其基本结构特征、流变特性及体外消化酶抑制活性。结果表明,WBAX是以阿拉伯糖(30.3%)和木糖(37.8%)为主的非淀粉类中性糖,且具有较高的支化度(A/X=0.8);流变结果表明,WBAX的表观粘度随剪切速率的增大而减小,是典型的非牛顿流体,且随着温度的增加,表观黏度逐渐降低;热稳定性结果表明,WBAX在30 ℃~132 ℃范围内表现出良好的热稳定性,可为产品热加工提供数据支撑。同时,由体外消化酶抑制实验分析结果可知,WBAX对α-葡萄糖苷酶的抑制效果较弱,规律性不明显,α-淀粉酶抑制率曲线平滑,有较强的规律性,但抑制效果有限,可能由于多糖纯度、糖含量、单糖组成、分子质量等不同所导致。由于多糖结构的复杂性,WBAX的结构与活性之间的构效关系尚不清楚。因此,WBAX的特定结构和构象对其生物活性的影响研究成为重点,同时本研究可为WBAX深加工以及WBAX降血糖活性机制研究提供理论依据。
