益生菌联合谷氨酰胺在重型颅脑损伤中的应用效果分析
2022-07-23陈复起王向民
陈复起 王向民
重型颅脑损伤是暴力直接或间接作用于头部致使颅脑组织损伤后昏迷6 h以上或清醒后再次昏迷的急危重症损伤,具有高死亡率、高致残率等特点。重型颅脑损伤患者机体多处于高代谢状态,且患者长时间意识障碍,无法自主进食,易出现代谢紊乱、肠黏膜屏障功能障碍而导致免疫功能低下[1-2],甚至引发肠道菌群移位导致肠源性感染,危及患者生命安全。近年来临床研究证实,规范肠内营养治疗对提高重型颅脑损伤患者预后至关重要[3],且有研究指出益生菌能调节肠道菌群,保护肠黏膜屏障功能,增强肠黏膜免疫力,改善患者预后[4];谷氨酰胺作为人体肠道代谢的条件必需氨基酸,以及肠道损伤修复的重要营养物质,可有效改善肠道功能[5]。基于此,本研究笔者将益生菌与谷氨酰胺联合应用于重型颅脑损伤患者的治疗,并观察了其对肠黏膜屏障功能、营养状况、免疫功能的影响,现报道如下。
1 临床资料
1.1 一般资料
选取2019年3月至2021年3月西平县中医院收治的66例重型颅脑损伤患者作为研究对象,按照随机数表法将其随机分为观察组 (34例)和对照组 (32例)。观察组男性22例、女性12例,年龄28~65岁 [(47.65±10.62)岁],格拉斯哥昏迷指数 (Glasgow coma scale,GCS) 评分 (6.51±1.16)分,致伤原因为交通事故21例、高处坠落8例、跌倒5例;对照组男性21例、女性11例,年龄26~65岁 [(47.17±10.35) 岁],GCS评分(6.60±1.20)分,致伤原因为交通事故19例、高处坠落9例、跌倒4例。两组患者性别及致伤原因分布情况对比采用卡方检验,χ2=0.006、0.210,P=0.938、0.901,P均>0.05,差异无统计学意义,具有可比性;年龄及GCS评分对比采用独立样本 t检验, t=0.186、 0.310, P =0.853、 0.758,P均>0.05,差异无统计学意义,具有可比性。本研究经西平县中医院医学伦理委员会批准,且所有患者均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:经颅脑CT、MRI等影像学检查,符合重型颅脑损伤的诊断标准[6];入院时GCS评分≤8分;受伤至入院时间<6 h;预计生存期≥1个月;患者家属对本研究知情同意。排除标准:合并有严重心、肝、肾等重要脏器功能障碍;合并有严重消化系统疾病;合并有恶性肿瘤及自身免疫性疾病;合并有严重感染;肠内营养治疗不耐受;妊娠期或哺乳期女性。
2 方法
2.1 治疗方法
两组患者入院后均给予亚低温、机械通气、抗感染、纠正水电解质紊乱以及颅脑外伤开颅手术等治疗。
对照组患者在上述治疗的基础上行常规肠内营养治疗:入院后24~48 h内留置鼻胃管,取80 g肠内营养混悬液 [纽迪希亚制药 (无锡)有限公司生产,国药准字 H20010285]加温水配至600 ml,能量密度为0.5,经鼻胃管30 ml/h匀速泵注,使用加热器将营养液温度维持在36~40℃,若未出现腹胀、腹泻、胃潴留、反流等肠道不耐受情况,则逐渐加大营养液浓度、能量密度、泵注速度至3~6 d达到目标量 (每天所需总热量为25~30 kcal/kg、 蛋白质为 1.0 ~1.5 g/kg), 连续治疗14 d。
观察组患者在对照组治疗的基础上联合应用益生菌与谷氨酰胺:取2 g双歧杆菌四联活菌片 (杭州远大生物制药有限公司生产,国药准字S20060010)充分研磨水化后与20 g谷氨酰胺(Ajinomoto Co.Inc生产,批准文号H20110344)混匀,加入肠内营养液,经鼻胃管匀速泵注 (方法同对照组),连续治疗14 d。
2.2 观察指标及评价标准
对比两组患者治疗前后肠黏膜屏障功能、营养状况及免疫功能。 (1)分别于治疗前及治疗第3、7、14天,排空膀胱,向胃管中注入150 ml乳果糖溶液,于6 h内采集尿液,以高效液相色谱法检测尿乳果糖水平,计算乳果糖排泄率;抽取患者空腹肘静脉血5 ml,采用比色法检测血浆二胺氧化酶(diamine oxidase,DAO) 水平 (乳果糖、DAO试剂盒均由上海信帆生物科技有限公司生产)。 (2)分别于治疗前及治疗第14天抽取患者空腹肘静脉血5 ml,严格按照试剂盒说明书采用免疫比浊法检测血清白蛋白 (albumin,ALB)、转铁蛋白 (trans⁃ferrin,TRF)、前白蛋白 (prealbumin,PAB) 以及免疫球蛋白 (immunoglobulin,Ig)A、IgG、IgM水平 (ALB、TRF、PAB试剂盒均由深圳市生科源技术有限公司生产,IgA、IgG、IgM试剂盒均由上海申能生物技术有限公司生产)。
2.3 统计学处理
采用SPSS 22.0统计软件对所得数据进行统计学分析,其中计数资料以频数或百分比表示,采用卡方检验;符合正态分布的计量资料以均数±标准差 (±s)表示,组间两两比较采用独立样本t检验;均以P<0.05为差异具有统计学意义。
3 结果
3.1 两组患者肠黏膜屏障功能对比
治疗前,两组患者乳果糖排泄率、DAO水平均无明显差异 (P均>0.05),具有可比性。治疗后,观察组患者乳果糖排泄率、DAO水平均呈持续降低趋势,对照组患者乳果糖排泄率呈先升高后降低趋势、DAO水平呈持续降低趋势,且观察组患者乳果糖排泄率、DAO水平均明显低于对照组(P均<0.05), 详见表1。
表1 两组重型颅脑损伤患者乳果糖排泄率、DAO水平对比 (±s)Table 1 Comparison of Lactulose excretion rate and DAO level of patients with severe craniocerebral injury between the two groups(±s)
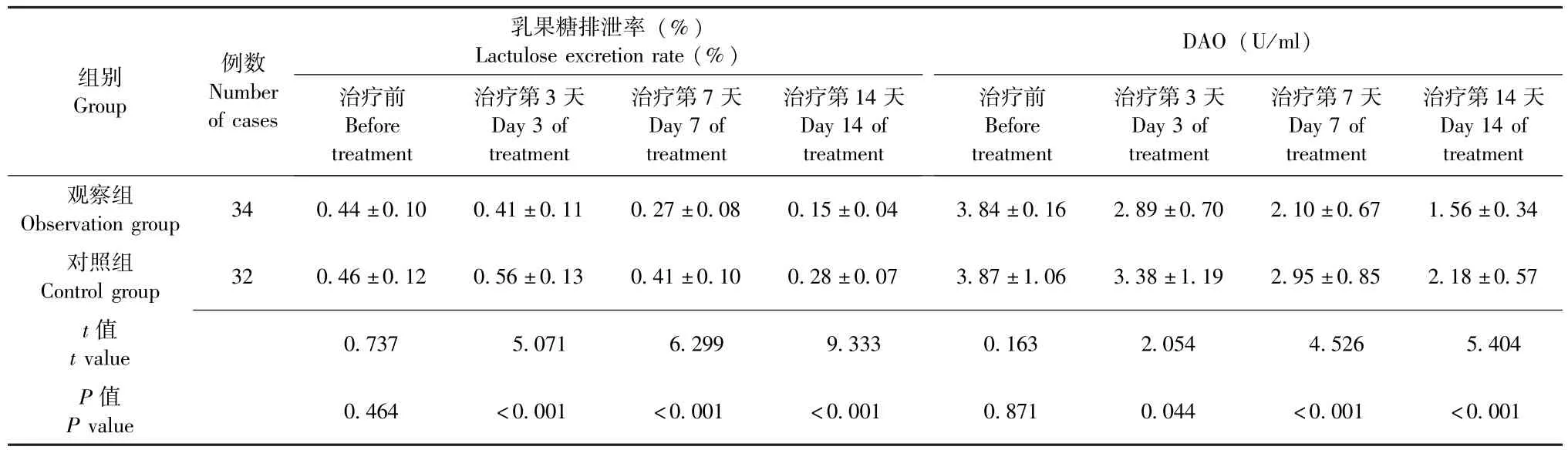
表1 两组重型颅脑损伤患者乳果糖排泄率、DAO水平对比 (±s)Table 1 Comparison of Lactulose excretion rate and DAO level of patients with severe craniocerebral injury between the two groups(±s)
注:DAO为二胺氧化酶;观察组患者在常规肠内营养治疗的基础上联合应用益生菌与谷氨酰胺,对照组患者单纯采用常规肠内营养治疗Note: DAO - diamine oxidase; Patients were treated with probiotics and glutamine in addition to the conventional enteral nutrition therapy in observa⁃tion group,while patients in control group were treated with the conventional enteral nutrition therapy alone
DAO (U/ml)组别Group例数Number of cases乳果糖排泄率 (%)Lactulose excretion rate(%)治疗前Before treatment治疗第3天Day 3 of treatment治疗第7天Day 7 of treatment治疗第14天Day 14 of treatment治疗前Before treatment治疗第3天Day 3 of treatment治疗第7天Day 7 of treatment治疗第14天Day 14 of treatment观察组Observation group 34 0.44±0.10 0.41±0.11 0.27±0.08 0.15±0.04 3.84±0.16 2.89±0.70 2.10±0.67 1.56±0.34对照组Control group 32 0.46±0.12 0.56±0.13 0.41±0.10 0.28±0.07 3.87±1.06 3.38±1.19 2.95±0.85 2.18±0.57 t值t value 0.737 5.071 6.299 9.333 0.163 2.054 4.526 5.404 P值P value 0.464 <0.001 <0.001 <0.001 0.871 0.044 <0.001 <0.001
3.2 两组患者营养状况对比
治疗前,两组患者ALB、TRF、PAB水平均无明显差异 (P均>0.05),具有可比性。治疗第14天,两组患者ALB、TRF、PAB水平均明显高于治疗前,且观察组均明显高于对照组 (P均<0.05),详见表2。
表2 两组重型颅脑损伤患者ALB、TRF、PAB水平对比 (g/L,±s)Table 2 Comparison of ALB,TRF and PAB levels of patients with severe craniocerebral injury between the two groups (g/L, ±s)

表2 两组重型颅脑损伤患者ALB、TRF、PAB水平对比 (g/L,±s)Table 2 Comparison of ALB,TRF and PAB levels of patients with severe craniocerebral injury between the two groups (g/L, ±s)
注:ALB为白蛋白,TRF为转铁蛋白,PAB为前白蛋白;观察组患者在常规肠内营养治疗的基础上联合应用益生菌与谷氨酰胺,对照组患者单纯采用常规肠内营养治疗Note:ALB-albumin,TRF-transferrin,PAB-prealbumin;Patients were treated with probiotics and glutamine in addition to the conventional enteral nutrition therapy in observation group,while patients in control group were treated with the conventional enteral nutrition therapy alone
组别Group例数Number of cases ALB TRF PAB治疗前Before treatment治疗第14天Day 14 of treatment治疗前Before treatment治疗第14天Day 14 of treatment治疗前Before treatment治疗第14天Day 14 of treatment观察组Observation group 34 25.24±3.45 37.81±4.28 1.75±0.29 2.41±0.43 0.22±0.04 0.51±0.08对照组Control group 32 26.21±3.53 32.78±4.32 1.79±0.37 2.06±0.35 0.21±0.03 0.35±0.06 t值t value 1.129 4.750 0.490 3.613 1.143 9.147 P值P value 0.263 <0.001 0.626 <0.001 0.257 <0.001
3.3 两组患者免疫功能对比
治疗前,两组患者IgA、IgG、IgM水平均无明显差异 (P均 >0.05),具有可比性;治疗第14天,两组患者IgA、IgG、IgM水平均明显高于治疗前,且观察组均明显高于对照组 (P均<0.05),详见表3。
表3 两组重型颅脑损伤患者IgA、IgG、IgM水平对比 (g/L,±s)Table 3 Comparison of IgA,IgG and IgM levels in patients with severe craniocerebral injury between the two groups (g/L, ±s)
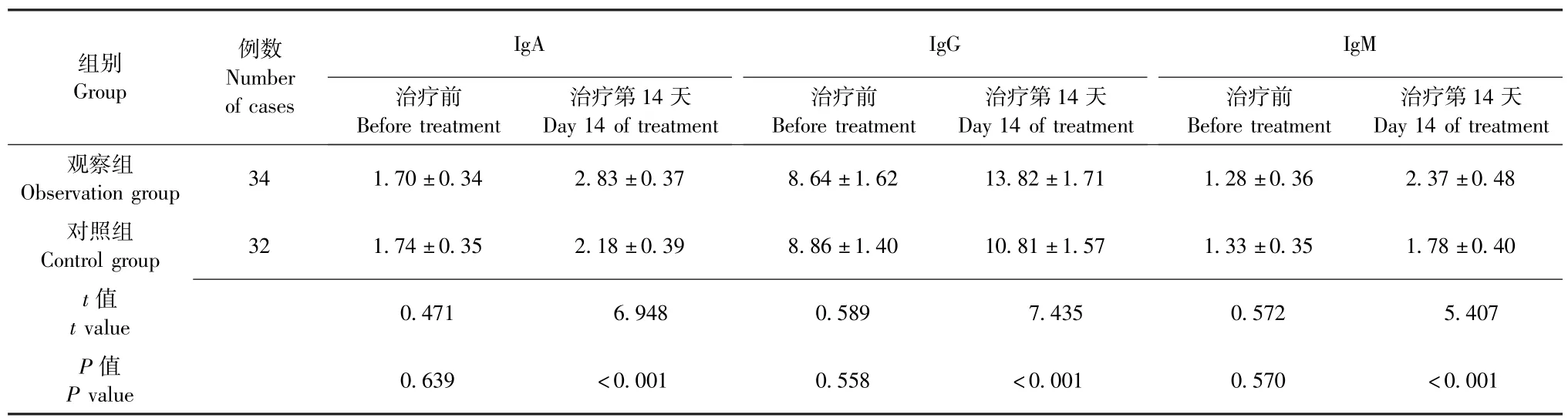
表3 两组重型颅脑损伤患者IgA、IgG、IgM水平对比 (g/L,±s)Table 3 Comparison of IgA,IgG and IgM levels in patients with severe craniocerebral injury between the two groups (g/L, ±s)
注:IgA为免疫球蛋白A,IgG为免疫球蛋白G,IgM为免疫球蛋白M;观察组患者在常规肠内营养治疗的基础上联合应用益生菌与谷氨酰胺,对照组患者单纯采用常规肠内营养治疗Note:IgA-immunoglobulin A,IgG-immunoglobulin G,IgM-immunoglobulin M;Patients were treated with probiotics and glutamine in addition to the conventional enteral nutrition therapy in observation group,while patients in control group were treated with the conventional enteral nutrition therapy alone
组别Group例数Number of cases IgA IgG IgM治疗前Before treatment治疗第14天Day 14 of treatment治疗前Before treatment治疗第14天Day 14 of treatment治疗前Before treatment治疗第14天Day 14 of treatment观察组Observation group 34 1.70±0.34 2.83±0.37 8.64±1.62 13.82±1.71 1.28±0.36 2.37±0.48对照组Control group 32 1.74±0.35 2.18±0.39 8.86±1.40 10.81±1.57 1.33±0.35 1.78±0.40 t值t value 0.471 6.948 0.589 7.435 0.572 5.407 P值P value 0.639 <0.001 0.558 <0.001 0.570 <0.001
4 讨论
重型颅脑损伤患者由于长期处于昏迷状态,合并有自主神经功能紊乱、应激反应增强、吞咽功能障碍以及神经内分泌异常引起的血流灌注不足,极易导致其出现营养不良、应激性溃疡、腹泻、胃潴留等而影响预后[7-8]。美国重症医学会和美国肠外肠内营养学会制定的重症患者营养指南[9]指出,重症患者应在24~48 h内早期予以肠内营养治疗。但有研究学者发现,常规肠内营养制剂营养素种类较少,对肠黏膜屏障功能保护效果不甚理想,而强化组件式非药物营养素在维持肠黏膜屏障功能完整、避免肠道菌群易位、改善肠道微生态方面发挥了较好的作用[10]。
相关研究显示,外源性益生菌可在肠黏膜表面形成一层菌膜屏障,通过抑制腐败菌生长调节肠道微生态平衡,避免肠道菌群及内毒素易位;其分泌的乳酸、醋酸可通过刺激肠壁促进肠蠕动,加速内毒素排出;可降低肠黏膜通透性,促进胃肠道吸收营养物质,增强胃肠道免疫功能[11]。谷氨酰胺作为人体可自身合成的非必需氨基酸,当发生应激反应时可转化成必需氨基酸为肠黏膜细胞提供能量,保证肠黏膜代谢水平,改善肠黏膜屏障功能[12-14]。本研究结果显示,治疗后,在常规肠内营养基础上联合应用益生菌与谷氨酰胺治疗的观察组患者乳果糖排泄率、DAO水平均呈持续降低趋势,而单纯采用常规肠内营养治疗的对照组患者乳果糖排泄率呈先升高后降低趋势、DAO水平呈持续降低趋势,且观察组患者乳果糖排泄率、DAO水平均明显低于对照组。另外本研究结果显示,观察组患者血清ALB、TRF、PAB、IgA、IgG、IgM水平均明显高于对照组。乳果糖排泄率是评价肠黏膜通透性的重要指标之一,其水平越低表示肠黏膜通透性越好;DAO是反映肠道机械屏障完整性和受损伤程度的指标之一,其水平越高表示肠黏膜损伤越重;ALB、TRF、PAB可反映患者的营养状态,是监测营养不良的敏感指标;IgA、IgG、IgM可反映患者的免疫功能,是监测免疫功能的敏感指标。本研究结果说明,益生菌联合谷氨酰胺可保护肠黏膜屏障功能,减轻肠黏膜损伤程度,改善营养状况,提高免疫功能。分析其原因可能与常规肠内营养随治疗时间延长,肠黏膜屏障功能才逐渐恢复[15],而益
生菌联合谷氨酰胺可激活并增强T细胞的抗氧化功能,减少细胞凋亡,直接改善患者肠内营养状况及机体免疫功能[16-17]有关。
综上所述,益生菌联合谷氨酰胺治疗重型颅脑损伤,可有效保护患者肠黏膜屏障功能,改善机体营养状况,提高免疫功能,临床应用价值较高。
