ABC转运蛋白结构及其在细菌致病性中的研究进展
2022-07-22陈福暖黄瑜蔡佳王忠良简纪常王蓓
陈福暖 黄瑜 蔡佳 王忠良 简纪常 王蓓
(广东海洋大学水产学院 广东省水产经济动物病原生物学及流行病学重点实验室 广东省水产经济动物病害控制重点实验室,湛江 524088)
ABC转运蛋白超家族是一个古老的膜蛋白家族,细胞膜作为细胞质与外界环境的结构性屏障,细胞实现内外的物质交流一般是由细胞膜上的蛋白来决定的。其中主要包括两种方式:(1)以离子通道及协助扩散的被动运输方式使得底物溶质顺着浓度梯度进行跨膜运输;(2)以消耗能量的主动运输方式进行底物溶质逆浓度梯度进行跨膜运输。现有研究证据表明,ABC转运蛋白长期演变过程中进化出多种主动运输模式,跨膜转运多种底物以满足物种不同的生理需求[1-2]。典型的ABC转运蛋白是一种单向底物转运体,可以通过结合ATP水解产生的能量来实现对各类底物分子的跨膜转运,包括某些金属离子、糖类、氨基酸、多肽、蛋白质、细菌分泌物及代谢产物和抗生素类药物等。根据底物分子运输方向,ABC 转运蛋白可分为内向转运蛋白和外向转运蛋白两类。ABC转运蛋白通常由跨膜结构域(transmembrane binding domain,TMD)和核苷酸结合结构域(nucleotide binding domains,NBD)组成。TMD 作用是形成识别并介导底物穿过细胞膜机械性通道,NBD 则是作用于ATP的结合和水解。
早期对ABC 转运蛋白研究表明,在细胞中ABC 转运蛋白对有毒物质的耐受性和抵抗力方面起着关键作用,可以将有毒疏水性化合物隔离到特定的细胞器中,也可以引导它们分泌到细胞质中,而后经主动运输排出体外[3]。正是由于需要运输底物多样性促使ABC转运蛋白参与细胞的多种生理过程,迄今为止,已知人类的ABC家族相关蛋白变异可以引起多种疾病,如冠心病、慢性特发性黄疸、肾上腺脑白质失养症、肺癌、免疫缺陷病、囊性纤维病、脂质代谢及免疫缺陷病等[4];ABC 家族蛋白中的多药耐药蛋白1(multidrug resistance,MDR1)的过量表达使得肿瘤细胞对部分化疗药物表现出较高的耐药性;在细菌中,ABC 超家族则参与细菌生长各阶段的营养物质的摄取、代谢产物与细菌毒性化合物的排出、细菌生物被膜的形成[5-6]。本综述拟从ABC转运体的结构、作用机制、细菌耐药性及其在致病性中的作用等几个方面来介绍ABC转运蛋白的转运机制及相应功能。
1 ABC转运蛋白的结构
ABC 转运蛋白核心结构由2个跨膜结合区和2个核苷酸结合区组成[7]。它们是通过形成同质或异质二聚体复合物来结合和水解ATP的一类转运蛋白。目前为止,大肠杆菌(Escherichia coli)MsbA、BtuCD 及霍乱弧菌(Vibrio cholerae)MsbA转运体NBD 和TMD 晶体结构已经被成功解析[8],其作用方式为位于脂质双分子层的TMD通过在细胞膜内形成识别并介导底物穿过细胞膜机械性通道;NBD则位于细胞质内,具有ATP结合位点,通过结合ATP水解产生的能量改变NBD蛋白的构象,二者相互协调以此完成对底物分子跨膜转运。从结构与功能来看,NBD与TMD共同组成ABC转运蛋白的核心部分,共同发挥ABC转运蛋白转运底物的功能。除此以外,有些亚家族比如CUTI(carbohydrate uptake transporter 1)和MOT1(modifier of Transcription 1),存在2个C端附加结构域,可能与NBDs二聚体的形态相关联。
1.1 核苷酸结合域
NBD通常由200-300个氨基酸组成,包括两个部分:Rec A-like亚结构域和螺旋亚结构域[9]。螺旋亚结构域是ABC转运蛋白所特有的,与ATP水解偶联底物跨膜转运相关。所有ABC转运体在NBD内有一个长约200个氨基酸的高度保守的片段(表1),包含3个模体(motif),分别是位于RecA-like亚结构域的WalkerA(GXXGXGKS/T,X代表氨基酸)、Walker B(ΦΦΦΦD,Φ代表疏水氨基酸残基)和Walker C即信号基序(signature motif)(LSGGQ),Walker C是ABC转运蛋白的特征性模体,比如ArsA转运蛋白参与砷酸盐的转运,其ATP结合结构域仅具有Walker A和Walker B模体,但是没有Walker C,因此不属于ABC转运蛋白家族成员[4]。

表1 核苷酸结合结构域保守基序的功能Table 1 Functions of conserved motifs in the nucleotide-binding domain
NBD中存在着几个环(loop)区,其中Q-环与ATP的γ磷酸基团结合,连接Rec A-like亚结构域和螺旋亚结构域,可调节NBD和TMD之间的相互作用[10];D-环则通过改变构象控制ATP水解,依托NBDs结构域实现细胞间信息的传递;H-环则在催化过程中形成一个活性的中心,连接水解过程中所需要的小分子以此加快催化水解ATP[11-13]。这些保守的基序在折叠的NBDs中聚集在一起形成ATP结合位点,并在ATP结合和水解以及能量传递中发挥重要作用[14](图1)。如Walker B基序的谷氨酸残基催化ATP水解[15]。此外,最近研究表明,X-环仅存在于外向转运蛋白中,位于TM螺旋亚结构域中的信号基序之前,在Sav1866中定义为TEVGERG序列[16]。
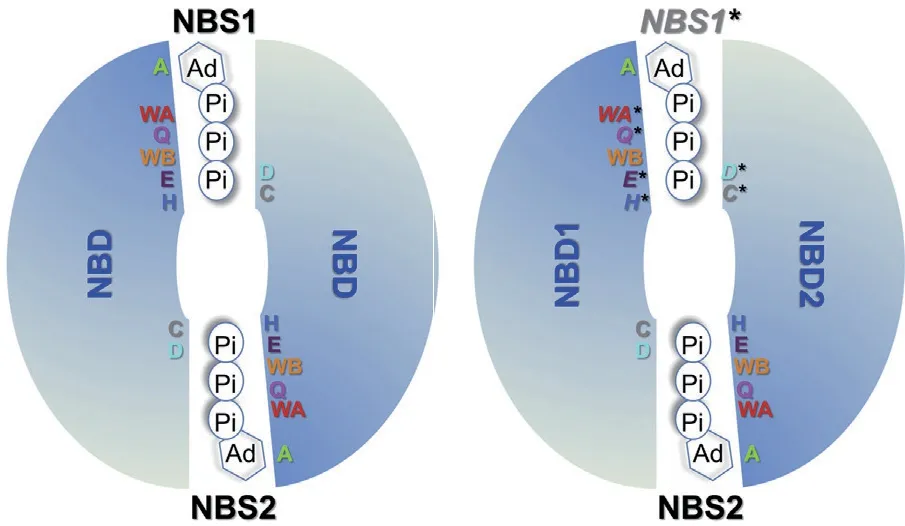
图1 NBD二聚体结构示意图(Orelle)Fig. 1 Schematic diagram of NBD dimer structure (Orelle)
1.2 跨膜结构域
相对于NBD,TMD保守性较差,这与TMD参与不同底物识别与转移的功能有关[17]。对于ABC家 族蛋白的单个TMD一般由6个TM(transmembrane)螺旋构成,但也存在由多个TM螺旋构成,如大肠杆菌的药物外向转运蛋白Ydd A由5个TM螺旋构成[18]。在ABC外向转运蛋白中,两个TMD结构域形成一个二聚体结构,包含12个跨膜的TM螺旋;ABC内向转运蛋白中则具有 10-20个TM螺旋。ABC外向转运蛋白的TMDs具有两个分别位于细胞外和细胞基质的环状结构。在金黄色葡萄球菌(Staphylococcus aureus)ABC外向转运蛋白Sav1866中,TMD 延伸到膜边界外,其偶联螺旋环ICL1(intracellular loops)向细胞质中突出约25Å,在细胞质基质内的偶联螺旋形成的环(ICL1和ICL2)与单个或两个NBD结合形成NBD-TMD界面,并以此从NBD传递信息给TMD[19-20]。Q-环提供了与偶联螺旋相互作用的氨基酸残基[21],同时有一个保守的位于X-环谷氨酸盐可以与两个偶联螺旋结合,在NBDs与TMDs的相互作用中起重要作用[22]。随着人们对这一大蛋白质家族结构和功能的认识,观察到4个类型ABC转运蛋白的3D结构[23](图2),产生了外向转运蛋白以及I型和II型内向转运蛋白分类[24-25]。近年来,又发现了一种结构上不同的蛋白质,存在于古细菌和细菌中的能量耦合因子(ECF)转运蛋白[26-27],被称为III型内向转运蛋白。

图2 ABC转运体结构(Locher)Fig. 2 Structure of ABC transporter(Locher)
2 ABC 转运蛋白的作用机制
原核和真核生物ABC转运蛋白结构的NBD保守性较高及其在结构功能方面的表现出的相似性,ABC转运蛋白在不同物种中发挥的作用也应具有一定的相似性。ABC转运蛋白中的外向转运蛋白存在于所有生物体内,而内向转运蛋白仅存在于细菌和植物中[28-29]。外向转运蛋白的转运过程是在胞内的底物分子直接与TMD结合启动整个转运过程,而内向转运蛋白则是外周蛋白捕获识别底物,进而形成底物-外周蛋白复合体,然后呈递给TMD转运蛋白结合形成SBP-TMD结构,处于外周蛋白中底物分子脱落通过TMD结构进入胞内。在细菌中,内向转运蛋白就这种底物结合蛋白(substrate-binding protein,SBP)先与底物结合,随后与TMD转运蛋白结合,从而完成底物转运过程。本节拟从ATP水解偶联机制及转运机制来介绍ABC 转运蛋白的作用机制。
2.1 ATP水解偶联机制
所有ABC蛋白通过NBD水解ATP为底物运输提供能量,尽管介导的生理作用各不相同,但NBD的结构却是高度保守的[30]。NBDs以二聚体形式头尾相接聚集并于Walker C与另一个NBD上的Walker A之间结合ATP成三明治结构进而水解ATP(图1)。NBD二聚体的聚合与ATP水解之间的这种关系是所有ABC蛋白中共有的保守特征,ABC转运体也可以通过利用ATP以外的核苷酸来驱动转运。多项研究表明,CTP、GTP和UTP与ATP的亲和力非常相似,如鼠伤寒沙门氏菌麦芽糖转运体MalK也可利用GTP和CTP作为能源物质,其中对GTP的亲和力几乎与ATP相同[31-33]。对于细胞内普遍核苷酸的浓度含量高,这一点值得重视。
对于外向运输的ABC 转运蛋白底物转运,膜内侧底物可被较高亲和力的结合位点识别并结合;而构象变化后,结合位点亲和力降低以至底物释放到胞外。ABC转运体的晶体结构为解析ATP水解耦合机制提供了依据。耦合过程需要利用底物并通过TM螺旋与NBDs的形成的沟槽相互作用将信号从NBDs传输到TMDs。已有研究表明,在未探明晶体结构的ABC转运体中也存在类似的耦合界面[34]。ABC转运体耦合螺旋与已知高分辨率结构的序列比对表明,耦合螺旋是一个功能上相似的基序但其序列并不保守的,这种现象解释为耦合螺旋与ABC转运体中的NBD的相互作用依赖于特定的侧链接触。
2.2 ABC转运蛋白转运机制
基于目前已经解析晶体结构的ABC转运蛋白可见,SBP与TMD,TMD之间是通过改变构象来完成对底物摄取、传输和释放[21](图3)。在不同的转运阶段,两个NBD的结合状态与开口方向是动态变化的,NBD通过控制TMD形成的通道来调节膜内外的开放,偶联ATP的水解产生能量对底物进行转运[23]。ABC内向转运蛋白转运过程是:两个TMD形成一个亲水性的底物分子通道,当内向转运蛋白处于静息状态时,靠近外周质且开口向外的通道处于开放状态,而朝向胞质面的通道则处于关闭状态;当膜外结合蛋白结合底物转运时,需要与底物结合蛋白(substrate binding protein,SBP)形成复合体,将底物分子传递到TMD形成SBP-TMD结构,并通过TMD将信号传递到NBD,NBD则激活启动结合ATP水解,随后NBD的构象发生改变形成SBPTMD-NBD结构,底物进入通道后最终被送到胞内。然而ABC外向转运蛋白则从胞内把底物,如代谢产物、细菌毒性化合物及药物转运到胞外。虽然已经报道了一些高分辨率结构,但还没有为ABC外向转运蛋白建立明确的共同的机制。其一,大多数结构因其疏水性以及低亲和力结合而不能揭示结合确切的底物分子。其二,当从膜上去除ATP等能源物质时,ABC外向转运蛋白NBDs显现开口向内的构象[35]。
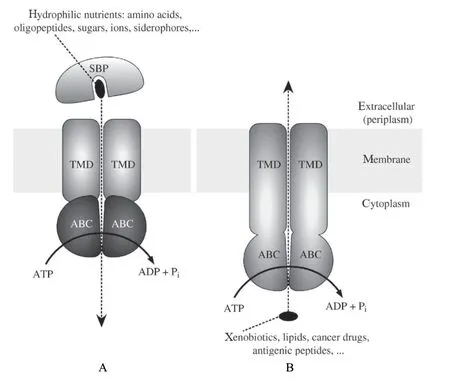
图3 ABC转运体功能示意图(Locher)Fig. 3 Schematic diagram of ABC transporter function(Locher)
3 细菌多药ABC转运体类别与功能
在细菌中存在多种药物转运能力的ABC转运蛋白,由于其功能具有重叠性,因此不易确定具体的ABC转运蛋白,如枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌和大肠杆菌可能携带多达30个药物外向转运蛋白[14,36-37]。除此之外,一些ABC转运体通常与双组分调节系统相关,使其对抗菌肽产生耐药性[38]。目前,对于确定多药ABC转运体的方法有3种:基因敲除、细菌分离培养以及大肠杆菌过表达转运蛋白。以下对于已确定多药ABC转运蛋白结构特点进行介绍。
3.1 具有相同NBD转运体/同源二聚体的ABC转运蛋白
乳酸乳球菌(Lactococcus lactis)中发现第一个同源二聚体多药ABC转运蛋白LmrA[39]。通过在大肠杆菌过表达lmrA的药敏实验中,LmrA的过表达导致了对多种的药物产生耐药性[40],如乙啡啶、罗丹明、道诺霉素和TPP+等,此外,道诺霉素在倒置膜泡中的积累依赖于ATP水解,并受到药物流出泵抑制剂利血平的抑制。此外对与LmrA的具有高度同源性的枯草芽孢杆菌的一个膜蛋白BrmA进行了研究,同样证明其运输多种药物的能力,如阿霉素和7-氨基放线菌素D,还有来自大肠杆菌的MacAB/TolC、波赛链霉菌(Streptomyces peucetius)的DrrAB[41-44]。
3.2 具有非对称NBD的转运体/异源二聚体ABC转运蛋白
非对称的NBD的多药转运体形成的主要原因是NBD的信号基序中的一些残基被其他残基取代。乳酸乳球菌中主要的多药耐药转运蛋白LmrCD,其表达受到名为LmrR的转录抑制因子的控制[45-46],药物结合LmrR降低其对LmrCD启动子的亲和力,从而诱导转运子的表达,BmrCD是枯草芽孢杆菌转运蛋白,抗生素靶向蛋白合成通过核糖体介导的转录衰减机制诱导其表达[47]。在大肠杆菌细胞膜中过表达时,BmrCD可转运多种药物,如阿霉素或米托蒽醌等,PatAB在肺炎链球菌(Streptococcus pneumoniae)多药耐药中的意义首次得到证实,其基因失活增加了细菌对几种药物的敏感性:溴化乙硫、小檗碱、吖啶黄和诺氟沙星[48]。将实验室所培育的菌株暴露于环丙沙星后,分离出一株多药耐药菌株,发现其PatA和PatB基因表达上调[49]。对大肠杆菌中过表达转运蛋白的研究表明,只有异源二聚体具有药物外排的功能,PatAB强烈倾向于将GTP作为能量来源来外排药物,特别是在37℃时[50]。
4 细菌致病过程中ABC转运蛋白发挥的的相应功能
4.1 外向转运蛋白与细菌致病性的联系
外向转运蛋白是ABC转运蛋白家族中普遍存在的一个分支,其存在于几乎所有生命体中。目前原核生物中已确认的外向转运蛋白亚族有40种,这些蛋白密切参与生物合成途径[51](图4),如禾谷镰刀菌(Fusarium graminearum)ABC转运FgArb1通过调控病原菌对氧化和细胞壁胁迫的响应、DON毒素的合成,从而调控病菌在寄主组织中的侵染生长,现有研究表明对FgArb1进行基因敲除发现禾谷镰刀菌突变体完全丧失致病性[52];通过对变形假单胞杆菌(Pseudomonas plecoglossicida)ABC转运蛋白基因进行稳定沉默后侵染斜带石斑鱼转录组分析,病原菌的大量差异基因集中在新陈代谢的过程中,证明ABC转运蛋白确实起着重要的转运物质功能[53];同时参与糖缀合物的合成、磷壁酸、蛋白质分泌以及细胞表面蛋白等[12,54-55]。

图4 革兰氏阴性细胞中ABC转运蛋白参与细菌致病性的作用(Victoria)Fig. 4 Roles associated with ABC transporters involved in bacterial pathogenicity in a model Gram-negative cell(Victoria)
4.1.1 糖缀合物的合成 原核生物有3种细胞表面糖缀合生物合成途径,根据其内膜运输机制分为Wzx/Wzy依赖途径、ABC转运体依赖途径和合酶依赖途径。ABC转运蛋白依赖途径介导了所有主要类型的细胞表面糖缀合物的糖链的转运,包括糖蛋白、磷壁酸、荚膜多糖(CPS),这些糖缀合物在细胞内膜以糖基转移的方式完成聚合;然后,ABC转运蛋白以ATP依赖的方式将完整的糖缀合物转运到膜外。目前在大肠杆菌和流感嗜血杆菌(Haemophilus influenzae)中CPS生物合成的研究中,ABC外向转运蛋白参与了多聚糖外排[56-57]。向外分泌的多糖如O抗原、磷壁酸、CPS和EPS(Exopolysaccharide)都在致病菌的毒力中发挥重要作用,它们在细胞信号传递、生物被膜形成和逃避宿主免疫应答方面发挥着多种作用。
4.1.2 磷壁酸 在革兰氏阳性菌中,肽聚糖是细胞壁中重要组成部分,其周围密布着磷壁酸,磷壁酸通过ABC转运蛋白分泌到细胞表面,并以共价键的方式连接在肽聚糖中[12]。对于ABC转运蛋白对磷壁酸的转运,在枯草芽孢杆菌[58]和金黄色葡萄球菌[59]中被证明对细菌生存至关重要。磷壁酸在几种致病菌中是一种非蛋白黏附素毒力因子,在金黄色葡萄球菌中磷壁酸有助于其在宿主细胞内黏附与定植,最显著的是在宿主定植过程中对人类上皮细胞和内皮细胞的黏附,如在条件致病性的表皮葡萄球菌(Staphylococcus epidermidis)中,磷壁酸与纤维蛋白黏附有关[60-61],然而,尚未确定表皮葡萄球菌的磷壁酸分泌系统。
4.1.3 蛋白分泌 原核生物蛋白分泌主要通过II型分泌系统,但同时也存在I型、III型和VI型分泌系统[62-63]。其中I型分泌途径是依赖ABC转运体的机制。迄今为止,超过25个ABC外向转运蛋白家族(TCIDs:3.A.1.109-113,116,118,119,123,124,126-134)已被证实与I型蛋白分泌功能有关,它们分别对毒素、抗菌肽、铁载体蛋白、水解酶和细胞表面蛋白等均有转运功能。许多分泌蛋白在入侵或定植方面发挥作用,而抗菌肽在与其他细菌竞争中发挥作用,但目前研究中,此类蛋白分泌与它们的毒力的强弱没有直接关系。
4.1.4 细胞表面蛋白 细胞表面蛋白在蛋白质水解、肽聚糖分解代谢、黏附和免疫逃避中发挥重要作用[64]。其通常由单一蛋白或糖蛋白组成。大多数细菌的细胞表面蛋白是通过II型分泌途径输出的,但也发现了许有3种I型分泌细菌表面蛋白:Crs、CsxA和CsxB[65]。这些蛋白是毒力因子,与逃避宿主防御有关,如血清的吞噬和杀菌活性[66]。
4.1.5 毒素 最典型的I型分泌系统属于RTX(repeats-in-toxin)蛋白家族,位于蛋白质羧基末端区域富含重复的甘氨酸和天冬氨酸形成钙离子结合位点,蛋白家族成员大小从40-600 kD不等[67]。同时RTX毒素是一种I型分泌系统依赖性分泌蛋白,并且广泛存在于多种革兰氏阴性哺乳动物病原体中[68],如尿道致病性大肠杆菌α-hemolysin(Hly)分泌系统中的HlyA,hlyCABD操纵子编码 I 型分泌系统和 HlyA 合成所需的基因,而其所在的Hly转运子属于ABC转运蛋白,由HlyB、HlyD、TolC组成,HlyC则是参与HlyA成熟的酰基转移酶。在细胞内HlyA触发HlyB与HlyD相互作用在细胞膜上形成TMD-NAD通道,由TolC呈递到胞外,并通过自身空间折叠形成具有生物活性的毒素,以单体的形式嵌入细胞膜靶位形成亲水孔道,将细胞内K+和细胞外Ca+交换导致溶血,进而感染尿道,出现急性膀胱炎和肾盂肾炎,病情严重者可导致溶血性尿毒症发生[12,69]。
4.2 内向转运蛋白与细菌致病性的联系
ABC内向转运蛋白有助于从细菌从外环境中获得必需物质,这类ABC转运蛋白在原核生物、古细菌和植物中被发现,但在真核生物中却不存在。ABC内向转运蛋白根据结构特征被进一步细分为两类,I型内向转运蛋白和II型内向转运蛋白[21]。I型内向转运蛋白与小分子运输有关,如离子和氨基酸,在每个TMD亚基中有5-8个TM螺旋。II型内向转运蛋白与大分子运输有关,如金属螯合物和维生素,并且在每个TMD亚基中有10个TM螺旋[70]。现有研究表明,结核分枝杆菌(Mycobacterium tuberculosis)ABC内向转运蛋白LpqY/SugABC,转运二糖及海藻糖与细菌毒力有关联。海藻糖作为结核分枝杆菌(Mycobacterium tuberculosis)细胞被膜的关键组成部分,通过LpqY/SugABC介导海藻糖逆浓度运输进入胞内进而形成胞内外循环来维持结合分枝杆菌毒力[71];此外,在人感染无乳链球菌(Streptococcus agalactiae)CS101过程中,一类参与氨基酸摄入、血红素合成、孢子形成以及与主要毒力因子SpeB半胱氨酸蛋白酶的表达有关的Opp(oligopeptide)ABC内向转运蛋白,通过降低纤维蛋白原结合蛋白FbsA的表达观察到粘附上皮细胞的减少,证明肽摄取在病原菌入侵中起着重要作用,但其机制可能是通过环境感应[51]。
在宿主体内存在先天性防御机制限制病原微生物营养的利用,以防止病原微生物的定植。因此,一些ABC内向转运蛋白也在体内定植和传播中发挥重要作用。例如宿主体内维生素B12在自然杀伤细胞的激活和淋巴细胞的产生中起着重要作用,有人提出细菌通过清除体内维生素B12来增加在宿主体内生存率,现已在大肠杆菌里鉴定出依赖维生素B12内向转运蛋白BtuCED(TCID 3.A.1.13)[72],但是,尚未在体内感染中确定ABC内向转运蛋白利用转运维生素B12定植宿主体内这一作用机制;同样还有Mn/Zn/Fe螯合转运体家族,奈瑟氏菌FbpA的亲和力使其能够直接从载铁蛋白中剥离出Fe3+,供病原体使用[73-74]、锰转运蛋白是来自人类主要病原体链球菌肺炎的PsaBCA渗透酶缺失将导致体内毒力完全衰减[75-76]。
5 总结与展望
原核生物的ABC转运体表现出显著的功能多样性,其中一些功能是致病菌的毒力所必需的。然而,许多ABC转运系统的生理功能仍有待阐明。尽管ABC转运蛋白对毒力方面有明显的作用,但与在真核生物疾病中ABC转运蛋白的作用不同,原核生物ABC转运蛋白很少与多药外排相关。在致病菌中,ABC转运蛋白可发挥逃避或抵抗宿主防御的作用,同时还具有定殖在宿主体内功能,因此,与ABC转运蛋白相关的细胞表面或分泌因子很可能是抗菌疗法或疫苗开发的作用靶点,为细菌性疾病的预防提供了新的思路。然而,在这方面的应用依赖于对ABC转运体明确的生理功能和毒性作用机制,因此显然需要对ABC转运蛋白在细菌致病性中的作用这一前沿领域进行更多的研究。
