AtRGS1胞吞动态调控G蛋白参与拟南芥生长发育和 抗性反应
2022-07-22古盼齐学影李莉张曦单晓昳
古盼 齐学影 李莉 张曦 单晓昳,2
(1. 北京林业大学生物科学与技术学院,北京 100083;2. 清华大学生命科学学院,北京 100084)
异源三体G蛋白(heterotrimeric G protein)简称G蛋白,由Gα、Gβ和Gγ 3个亚基组成,是真核细胞中普遍存在的跨膜信号转导分子[1]。动物细胞中有关G蛋白的研究较为深入,多种胞外信号分子激活不同的G蛋白偶联受体(G protein-coupled receptors,GPCR),进而通过G蛋白向下游效应因子传递信号,引发不同的细胞反应[2]。植物细胞中G蛋白组成及分子结构虽然与动物细胞相似,但通过与动物细胞不同的非典型信号转导机制调控多种植物生长发育进程,并且在植物抵御多种非生物和生物胁迫过程中发挥重要作用[1]。本文综述了拟南芥中G蛋白信号调节子AtRGS1(Arabidopsis regulator of G protein signaling 1)通过胞吞作用调控G蛋白参与的生长发育和抗性反应的分子细胞学机制研究进展。
1 植物细胞中异源三体G蛋白调控机制
1.1 植物细胞中异源三体G蛋白
自1990年起,相继在模式植物拟南芥和水稻中克隆得到多个不同的G蛋白亚基。其中,拟南芥中具有1个Gα亚基AtGPA1(G protein alpha subunit 1)、1个Gβ亚 基 AGB1(GTP binding protein beta 1)、3个Gγ亚基 AGG1(G protein gamma subunit 1)、AGG2和AGG3,以及类似于Gα的3个大G蛋白XLG1(extra large G protein 1)、XLG2和XLG3[3-7]。 水稻中具有1个Gα亚基,1个Gβ亚基和5个Gγ亚基[8-10]。
目前,对模式植物拟南芥中异源三体G蛋白的分子结构了解比较清晰。拟南芥中的Gα亚基AtGPA1主要由螺旋结构域和Ras结构域组成,同时含有N端脂肪酰化修饰位点、GTP结合与水解位点以及构象调节位点等[11]。XLGs蛋白含有N端的核定位信号和半胱氨酸富集结构域以及类似于Gα亚基的C端结构域,同样具有结合和水解GTP的能力[7]。拟南芥中Gβ亚基AGB1的N端含有2个coil结构域,可以与Gγ亚基形成α螺旋相互缠绕的超二级结构[11]。Gα亚基可以单体形式存在,而Gβγ亚基通常以二聚体形式存在。Gα亚基和大G蛋白均可以与Gβγ二聚体发生相互作用形成异源三聚体。
以模式植物拟南芥和水稻为对象的研究表明,G蛋白不但调节种子萌发、幼苗生长、根系伸长以及花和果实发育等一系列植物营养生长和生殖生长过程,同时参与植物对干旱、盐碱和臭氧等非生物胁迫以及细菌和真菌等生物胁迫的响应过程[1]。另外,G蛋白还作为重要的调节因子在多种植物激素(脱落酸、赤霉素、生长素、油菜素甾醇和茉莉素)信号转导过程中发挥重要作用[1]。
1.2 植物细胞中RGS蛋白调控G蛋白活性
动物和真菌细胞中,7次跨膜受体蛋白GPCR负责调控G蛋白的活性[1]。GPCR主要由7个疏水肽段组成的跨膜α螺旋结构域组成,N端在细胞外,C端在细胞内,其中第5和第6个跨膜结构域之间的胞内环具有G蛋白结合位点。静息状态下,Gα亚基与GDP结合,并与Gβγ二聚体形成复合物,无法结合下游因子;外界信号刺激后,GPCR与相应配体结合,促进Gα亚基与GDP的解离及后续与GTP的结合。随后Gα-GTP与Gβγ二聚体解离,二者分别与下游靶蛋白互作,激活G蛋白介导的信号传递。同时,与配体结合的GPCR可被G蛋白受体激酶GRKs(G-protein receptor kinases)磷酸化。磷酸化的GPCR被β-抑制素识别经网格蛋白介导的胞吞途径进行胞吞。胞吞后的受体GPCR不再感知胞外信号,以避免细胞的过度反应。
迄今为止,植物细胞中尚未发现与动物和真菌细胞中GPCR结构和功能完全一致的G蛋白偶联受体。2003年,Chen等[12]在模式植物拟南芥中鉴定出G蛋白信号调节子AtRGS1,也是拟南芥中唯一一个RGS蛋白。AtRGS1蛋白主要结构与GPCR的7次跨膜螺旋结构相似,但其C端在胞内多出一个RGS结构域,具有促进Gα亚基GTP水解的功能[12-13]。AtRGS1定位于细胞质膜上,负责响应不同胞外信号,调控G蛋白的活性,进而影响植物生长发育和抗性反应过程[1]。静息状态下,Gα亚基可在GDP结合模式和GTP结合模式间自由切换。其中,Gα-GDP为非活性模式,与Gβγ亚基结合形成复合物,而Gα-GTP与AtRGS1结合后,GTP可被催化水解为GDP。当外界信号存在时,AtRGS1蛋白通过胞吞作用与Gα亚基解离,从而解除对活性Gα-GTP的抑制作用,Gα-GTP和游离的Gβγ亚基均可向下游传递信号[1]。通过序列比对分析发现,双子叶植物大豆和单子叶植物椰枣、云杉及卷柏中均存在RGS蛋白,但上述蛋白生物学功能研究尚不深入[1]。
2 植物细胞膜蛋白的胞吞调控
2.1 植物细胞膜蛋白的胞吞
细胞质膜是指围绕在细胞最外层,由脂质、蛋白质和糖类等生物大分子组成的生物膜。细胞质膜不但维护细胞内微环境的相对稳定,并且介导细胞与外界环境间的物质、能量交换和信息传递。磷脂双分子层是细胞质膜的骨架,为维持细胞质膜构象提供支撑。膜蛋白不仅是细胞质膜的重要结构组分,也是其生物学功能的主要承担者[14]。根据功能特点不同,膜蛋白可分为通道及载体蛋白、受体蛋白、酶蛋白和结构支撑蛋白等,分别在物质跨膜转运、信号感知和传递、能量代谢等方面发挥重要作用[15]。
膜蛋白一般在细胞质膜发挥作用,可通过胞吞胞吐循环调控其在质膜上的数量,以应答外界环境的刺激和自身生长发育阶段的变化[16]。胞吞作用是指膜蛋白或胞外物质,通过质膜包裹并向内折叠凹陷形成胞内独立囊泡,进而进行胞内转运的一系列过程[17]。植物细胞膜蛋白胞吞后,首先转运进入早期内含体(early endosome,EE),随后发育成晚期内含体/多泡体(late endosome/multivesicular body,LE/MVB)(植物细胞中也称为液泡前体prevacuolar compartment,PVC),进而转运至液泡中降解从而抑制其生物学功能,或者暂存在内含体中,待需要时通过循环内含体(recycling endosome,RE)运回质膜重新发挥其膜上功能[18]。近期研究表明,少数植物膜蛋白胞吞后在内含体积累,起始信号转导[19-20]。
植物细胞膜蛋白主要通过网格蛋白介导的胞吞途径(clathrin-mediated endocytosis,CME)和膜筏微区介导的胞吞途径(membrane microdomain-mediated endocytosis)2种方式进行胞吞[21-22]。其中,CME途径在植物和动物细胞中高度保守,均需要网格蛋白(clathrin)和衔接蛋白(adaptor)复合体的参与[21]。AtFlot1(flotillin 1)参与了植物细胞中膜筏微区介导的胞吞途径[23]。
2.2 磷酸化修饰调控植物细胞膜蛋白的胞吞
蛋白磷酸化修饰是指蛋白激酶将磷酸基团从ATP等转移到底物蛋白络氨酸、丝氨酸或苏氨酸残基上的过程。细胞质膜蛋白的磷酸化修饰不但可以调节其三级结构、寡聚程度和生物学活性等,还可通过多种方式影响其胞吞循环:调控膜蛋白与胞吞复合体的互作直接影响其胞吞,或改变膜蛋白的构象间接影响其胞吞[24]。
定位于植物细胞质膜的多种通道或载体蛋白的磷酸化修饰参与调控其胞吞转运。高盐胁迫下,磷酸化的水通道蛋白PIP2;1(plasma membrane intrinsic protein 2;1)更多地驻留在质膜上,胞吞程度明显下降[25]。低浓度硝酸根环境中,AtNRT1.1(nitrate transporter 1.1)发生磷酸化修饰,少量经CME途径进行胞吞,大部分驻留在细胞质膜上;高浓度硝酸根环境中,AtNRT1.1蛋白维持去磷酸化状态,大部分通过CME和膜筏微区介导的途径胞吞,并直接通过LE/MVB进入液泡降解,少量驻留在细胞质膜上[20]。磷酸化的生长素输出载体蛋白PIN(PIN-formed)与GNOM介导的向基循环途径的亲和性下降,从而更多地通过向顶循环途径招募回质膜顶部[24]。定位于细胞质膜的多种受体激酶,如细菌鞭毛蛋白flg22受体FLS2(flagellin sensing 2)、真菌细胞壁组分几丁质Chitin受体LYK5(lysin motifcontaining receptor like kinase 5)和蓝光受体Phot1(phototropin 1)等的磷酸化修饰均会促进上述受体经相应配体处理后的诱导型胞吞,但是与下游信号转导的关系仍需进一步明确[26-27]。
3 AtRGS1胞吞动态调控G蛋白参与的植物生长发育和抗性反应
当拟南芥细胞受到外界信号(葡萄糖、flg22、茉莉素和NaCl等)刺激时,AtRGS1胞吞进入细胞,解除其对下游G蛋白的抑制作用,游离的Gα-GTP、Gβγ亚基和定位于内含体的AtRGS1蛋白均可能调控相应的信号转导,进而影响生长发育进程和抗性反应。磷酸化修饰在多种信号诱导AtRGS1胞吞过程中发挥重要调控作用,目前,已鉴定多个参与磷酸化过程的蛋白激酶并明确其催化位点。
3.1 AtRGS1蛋白胞吞参与调控拟南芥中葡萄糖信号转导
植物细胞通过光合作用产生葡萄糖分子,不但为生命活动提供物质基础和能量来源,还可转运至胞外作为信号分子调控植物生长发育的各个过程。低浓度葡萄糖可促进植物的生长;高浓度葡萄糖则抑制种子的萌发和幼苗的早期发育,主要表现为胚后叶片缺失,主根变短,叶绿素缺乏和花色素苷积累等表型。正常糖浓度生长条件下,Gα亚基AtGPA1突变体gpa1暗中下胚轴生长和光下主根生长均受到抑制,而AtRGS1突变体表型与之相反,说明AtRGS1可能拮抗G蛋白的激活[12,28]。高浓度葡萄糖生长条件下,Gα亚基和Gβ亚基的突变均会导致对葡萄糖超敏的表型,例如种子萌发率更低,幼苗生长受抑制程度更高,而突变体rgs1-2表型与之相反,说明AtRGS1与G蛋白调控高浓度葡萄糖信号转导的机制截然不同[29]。
拟南芥中,不同浓度葡萄糖调控AtRGS1蛋白胞吞的分子机制不尽相同。葡萄糖特异性地以浓度和时间交互作用方式诱导AtRGS1蛋白的胞吞。2%葡萄糖处理3 d后,AtRGS1的胞吞程度达到60%,4 d后接近峰值70%;而6%葡萄糖处理30 min后,AtRGS1的胞吞程度即达到90%[19,30]。WNK(with no lysine kinases)家族的3个蛋白激酶AtWNK1、AtWNK8和AtWNK10在葡萄糖诱导的AtRGS1胞吞中发挥关键调控作用,其中AtWNK8和AtWNK10响应高浓度葡萄糖信号,而AtWNK1响应低浓度葡萄糖信号[31]。
高浓度葡萄糖处理后,处于游离状态的Gβγ二聚体将蛋白激酶AtWNK8和AtWNK10快速招募到细胞质膜(10 min以内),促进其与AtRGS1的互作,催化AtRGS1蛋白C末端Ser428、Ser435和Ser436等多个丝氨酸位点的磷酸化[19](图1-A)。磷酸化的AtRGS1蛋白胞吞进入细胞,游离的Gα-GTP单体及Gβγ二聚体均可能向下游传递信号[19](图1-A)。突变体wnk8-2和wnk8-2/wnk10-1经高浓度葡萄糖处理后TBL26(Trichome birefringence-like 26)的诱导表达受到抑制,同时幼苗生长受抑制的表型得到一定程度的缓解;而AtWNK8超表达植株生长受抑制程度更为严重,其超敏表型与Gα和Gβ亚基突变体一致,与AtRGS1突变体相反,说明胞吞进入细胞的AtRGS1也可能参与促进高浓度葡萄糖信号转导[19](图1-A)。
低浓度葡萄糖处理较长时间后(如2%葡萄糖5 h),蛋白激酶AtWNK1才会与AtRGS1互作并催化其磷酸化[31](图1-A)。磷酸化的AtRGS1蛋白同样胞吞进入细胞,解除对G蛋白信号传递的抑制作用[31](图1-A)。黑暗生长的突变体wnk1-1在低糖处理条件下下胚轴伸长明显变短,与Gα亚基AtGPA1突变体趋势一致,而与AtRGS1突变体相反,说明AtRGS1胞吞后游离的G蛋白可能参与促进低浓度葡萄糖信号的转导[12,31](图1-A)。
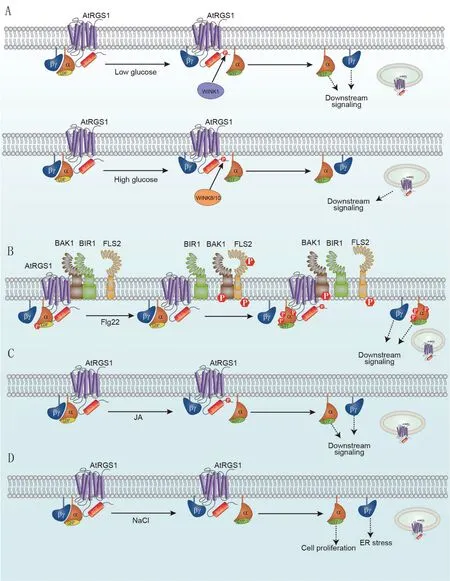
图1 AtRGS1调控G蛋白参与的植物生长发育和抗性反应Fig. 1 AtRGS1 is involved in G-protein-mediated plant development and stress responses
3.2 AtRGS1蛋白胞吞参与调控拟南芥中flg22信号转导
为了抵御病原菌的侵害,植物进化出病原菌保守相关分子模式触发的免疫反应(PAMP-triggered immunity,PTI)和病原菌效应因子触发的免疫反应(effector-triggered immunity,ETI)2个层次的先天免疫系统反应[32]。在PTI反应中,病原菌表面的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)可被定位于细胞质膜上的模式识别受体(pattern recognition receptors,PRRs)识别,并通过下游信号转导引发植物的防御反应。
细菌鞭毛蛋白N端22个氨基酸的保守域(flg22)是目前研究最为深入的PAMP之一。静息(未受外界信号刺激)状态下,受体激酶FLS2与胞质类受体激酶BSK1(BR signaling kinase 1)和BIK1(Botrytisinduced kinase 1)形成复合体,共受体激酶BAK1(brassinosteroid associated kinase 1)被与其互作的BIR1(BAK1 interaction receptor like kinases 1)抑制活性[33]。植物细胞感知flg22后,BIR1与BAK1解离,受体FLS2得以与共受体BAK1互作并相互磷酸化;BSK1和BIK1也被磷酸化并与FLS2解离[33]。BSK1通过磷酸化将蛋白激酶MAPKKK5(MAP kinase kinase kinase 5)激活启动PTI反应,BIK1通过磷酸化NADPH氧化酶RbohD(respiratory burst oxidase homolog D)调节ROS的迸发[33]。
拟南芥G蛋白是flg22信号转导中的正调控因子。Gα亚基的突变体gpa1-4中flg22诱导的活性氧ROS迸发以及对细菌Psm ES4326的抗性均受到抑制;Gβ亚基突变体agb1中NADPH氧化酶RbohD的磷酸化受到影响进而减弱了ROS的迸发,从而导致对细菌Pst DC3000的超敏表型[34-35]。AtRGS1通过flg22诱导的胞吞调控G蛋白参与到PTI反应中(图1-B)。静息状态下,AtRGS1、异源三体G蛋白和BAK1形成复合物,BIR1也与AtRGS1发生互作[34,36]。此时,BAK1通过其本底激酶活性催化AtGPA1 Thr19位点发生磷酸化[35]。Flg22诱导后,AtRGS1蛋白与BIR1解离,其C端被活化的BAK1催化发生磷酸化修饰,促进其胞吞[34,36]。与此同时,AtGPA1蛋白的Thr19位点发生去磷酸化,而其他丝氨酸或苏氨酸位点被BAK1激酶磷酸化,促进其与AtRGS1蛋白的解离[35]。游离的AtGPA1-GTP和Gβγ二聚体可参与调控钙离子内流和ROS迸发等PTI反应。
除了典型的异源三体G蛋白外,拟南芥中非典型的大G蛋白XLG2和XLG3也参与调控flg22诱导的PTI反应。单突变体xlg2和双突变体xlg2xlg3中flg22诱导的H2O2的产生以及对细菌Pst DC3000的抗性相较于野生型植株均有不同程度的减弱,而单突变体xlg3的表型则与野生型植株相似,说明XLG2蛋白在其中发挥主要作用[37-38]。AtRGS1蛋白同样参与调控大G蛋白介导的PTI反应。静息状态下,受体FLS2直接与AtRGS1互作,将XLG2蛋白维持在与GDP结合的非活性状态[37-38]。受到flg22刺激后,FLS2与BAK1发生二聚化和互磷酸化,紧接着磷酸化BIK1蛋白。活化的BIK1催化AtRGS1蛋白C端的Ser431和Ser428残基磷酸化,同时催化XLG2蛋白N端的S148和S150残基磷酸化,导致FLS2、AtRGS1与XLG2蛋白复合体的解体,其中是否涉及AtRGS1的胞吞尚未见明确报道[37-38]。磷酸化的XLG2最终在叶肉细胞中调控免疫反应。
3.3 AtRGS1蛋白胞吞参与调控拟南芥中茉莉素信号转导
茉莉素(jasmonate,JA)是一类重要植物激素,包括茉莉酸及其环戊酮衍生物等具有相似活性的化合物。JA不但调控植物种子萌发、根系发育、雄性育性和叶片衰老等多个生长发育进程,还参与植物对腐生型真菌和昆虫的抗性反应。异源三体G蛋白作为正调控因子参与JA信号转导。与野生型植株相比,拟南芥Gα亚基突变体gpa1-4、Gβ亚基突变体agb1-2和双突变体gpa1-4/agb1-2对JA抑制的主根伸长、JA诱导的花色素苷积累和抗性基因表达等多方面均呈现不同程度的低敏感性[39]。
AtRGS1的胞吞受到茉莉素的调控,从而影响G蛋白参与的茉莉素信号转导[39](图1-C)。静息状态下,AtRGS1与AtGPA1互作抑制其活性;外源活性茉莉素分子茉莉酸甲酯(methyl jasmonate,MeJA)以磷酸化和C端依赖的方式诱导AtRGS1的胞吞,其在膜上的驻留时间显著缩短。AtRGS1的胞吞促进其与AtGPA1的解离,游离的Gα亚基和Gβ亚基参与激活JA信号下游分子;而AtRGS1胞吞后并未发生明显降解,可能后续会循环上膜继续发挥功能。另外,MeJA处理可促进AtRGS1在膜上运动速率的提高,可能有助于其胞吞[39]。
3.4 AtRGS1蛋白胞吞参与调控拟南芥中盐信号 转导
土壤盐渍化可对植物造成离子胁迫、渗透胁迫和氧化胁迫等多种伤害,是影响植物生长和作物产量的主要环境因子之一。NaCl是盐碱土壤中最易溶、分布最广、含量最丰富的盐。中等盐浓度条件下(50 mmol/L NaCl),拟南芥生长已经受到严重影响,表现为地上部分生长受抑制,叶片加速衰老等表型[40]。较高盐浓度环境中(125 mmol/L NaCl),表现为幼苗生长完全受抑制,子叶花色素苷积累严重,无真叶萌出[40]。
Gα亚基AtGPA1和Gβ亚基AGB1分别作为细胞增殖促进因子和内质网胁迫释放因子正调控植物对盐胁迫的抗性[40]。与野生型植株相比,Gβ亚基突变体agb1-2在NaCl胁迫下幼苗更小,褪绿症状更显著[40]。AGB1蛋白的W109和S129残基突变后,Gα亚基与Gβγ二聚体的互作受到影响,但并不破坏其细胞膜定位,由此达到持续性激活Gα亚基和Gβγ二聚体的效果。在abg1-2突变体中表达AGB1W109A或AGB1S129A均可回补突变体盐敏感的表型[40]。相反,Gα亚基突变体gpa1-4生长受抑制的程度明显弱于Col-0[40]。这是由于即使AtGPA1缺失影响了植物细胞的增殖能力,却可使膜上游离的Gβγ二聚体数量增多,通过内质网胁迫诱导的未折叠蛋白质反应(unfolded protein response,UPR),一定程度提高了植物的耐盐性。
高浓度NaCl胁迫下,AtRGS1蛋白突变体rgs1-2存活程度显著高于野生型植株和gpa1-4突变体,而rgs1-2agb1-2双突表现出与agb1-2类似的超敏表型[40]。因此,AtRGS1作为上游负调控因子影响G蛋白的抗盐活性。Na+可以特异性地诱导AtRGS1蛋白的胞吞,进而解除对G蛋白的抑制作用,激活其抗盐能力[40](图1-D)。随着NaCl处理浓度的提高,AtRGS1蛋白的胞吞程度随之提升,即使添加蛋白合成抑制剂CHX(cycloheximide)处理也不会影响胞吞程度的变化;而KCl处理对AtRGS1蛋白的胞吞没有显著影响[40]。
4 总结与展望
近年来,综合分子遗传学和植物生理学等技术手段,对模式植物拟南芥和水稻中G蛋白生物学功能进行了较为深入和广泛的研究。结果表明,G蛋白参与植物营养生长和生殖生长、激素和糖信号转导以及抗性反应等一系列重要生物学过程。作为关键的G蛋白信号调节因子,定位于细胞质膜AtRGS1蛋白通过胞吞调控G蛋白的活性。葡萄糖、flg22、茉莉素和NaCl等多种外界信号诱导AtRGS1蛋白的胞吞,进而促进其与Gα亚基的解离。游离的Gα-GTP、Gβγ亚基和定位于内含体的AtRGS1蛋白均可能调控下游信号转导,影响相应生物学过程。但是,目前对茉莉素和NaCl诱导AtRGS1蛋白胞吞的调控机制尚不完全清晰。例如,茉莉素诱导的AtRGS1胞吞中,哪些蛋白激酶催化AtRGS1的磷酸化?其磷酸化位点又是什么?NaCl诱导的AtRGS1胞吞与G蛋白信号激活的具体调控关系是什么?上述机理仍有待于进一步解析。
除上述生物学过程外,AtRGS1还参与脱落酸(abscisic acid,ABA)介导的信号转导和干旱响应过程。ABA是一个 15 碳的倍半萜烯化合物,主要参与调节种子休眠和萌发、幼苗的生长和根系形态建成等生长发育过程,同时也调控保卫细胞运动从而影响植株的抗旱性。与野生型植株相比,外源ABA处理后AtRGS1超表达植株的种子萌发、子叶打开和变绿以及主根伸长等过程均受到显著抑制,而AtRGS1突变体rgs1-2植株种子的萌发率则略高于野生型植株[41-42]。同时,AtRGS1超表达植株耐旱性更强,干旱胁迫条件下气孔开度相对较小而干旱复水处理后存活率相对较高[41]。位于AtRGS1下游的G蛋白,在ABA抑制的种子萌发、幼苗生长和侧根形成等过程中发挥负调控作用,而在ABA介导的保卫细胞运动过程中发挥正调控作用[1]。在上述生物学过程中,AtRGS1是否也通过胞吞调控G蛋白参与的ABA信号转导?如果答案是肯定的,磷酸化修饰是否同样影响ABA或干旱处理后的AtRGS1的胞吞?上述科学问题也有待于进一步研究。
除拟南芥中的AtRGS1外,豆科植物中RGS蛋白调控G蛋白参与的结瘤过程,但并不发生亚细胞定位的变化,而是经磷酸化修饰后驻留在细胞膜上发挥作用[43]。因此,针对其他物种特异性的生物学功能,RGS蛋白可能存在与拟南芥中AtRGS1不同的G蛋白调控机制。其他物种中RGS蛋白如何调控G蛋白活性?相同生物学功能的调控机制在不同物种中是否相对保守?物种特异性生物学功能的调控机制是否与拟南芥和水稻等模式植物存在差异?上述一系列问题研究还有待于在不同物种中更加广泛地分析。对这些重要科学问题的探索,将使人们对RGS蛋白调控G蛋白的分子细胞学机制有更加全面和深入的认识,为理解植物G蛋白活性调节机制提供理论参考。
