慢病毒介导Occludin过表达影响BVDV感染BALB/c小鼠的研究
2022-07-22王万顺付强魏玉荣胡新艳陈俊贞李泽宇史慧君
王万顺 付强 魏玉荣 胡新艳 陈俊贞 李泽宇 史慧君
(新疆农业大学动物医学学院,乌鲁木齐 830052)
牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起的牛传染性疾病,我国农业农村部将其列为三类动物疫病。BVDV感染范围广泛,能够在牛、羊等多数偶蹄动物之间传播,甚至在野生动物中也出现感染。主要以幼龄动物表现明显,以高温发热、腹泻、黏膜出现病理性炎症为主要的临床症状[1-2]。目前该病呈现世界性分布,并在澳大利亚、美国、英国、中国等畜牧业发达国家传播迅速,非致细胞病变型(noncytopathogenic effect,NCP)BVDV感染早期妊娠母牛造成犊牛持续性感染(persistent infection,PI),PI牛成为潜在感染源,终身携带病毒并且通过自身的唾液、尿液以及乳汁传播[3-4]。BVDV还能够对牛源生物制品中如血清、冻精、胚胎、疫苗等造成污染,使得畜牧业之间的商业领域损伤严重[5-6]。
Piontek等[7]在20世纪60年代发现一种膜内多蛋白复合物,在上皮细胞和内皮细胞单层的相邻细胞之间提供顶端细胞间连接,这种复合物被称为紧密连接蛋白(tight junction proteins,TJs)。OCLN作为TJs蛋白重要蛋白之一,主要参与TJs的屏障作用和栅栏作用。OCLN的编码基因保守,通过对OCLN的cDNA和氨基酸序列的分析,在不同种属之间的同源性高达90%,在肺脏、肾脏、肝脏、睾丸及脑组织的上皮细胞中OCLN都能够高水平表达[8]。Liu等[9]研究发现利用小干扰RNA(small interference RNA,siRNA)干扰OCLN蛋白的表达,可抑制丙型肝炎病毒(hepatitis C virus,HCV)病毒进入人肝癌细胞Huh7.5.1,沉默OCLN蛋白的表达不会影响其他TJ蛋白JAM、CLDN1 和ZO-1的表达。
本课题组前期研究发现敲除OCLN能够有效抑制BVDV体外复制[10],然而OCLN是否影响BVDV体内复制尚不清楚,本研究采用慢病毒介导OCLN在BALB/c小鼠过表达,建立动物模型,感染BVDV后检测OCLN过表达对BVDV体内复制的影响,为研究BVDV的防控机制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞、动物和病毒 牛肾细胞(Madin-Darby bovine kidney,MDBK)和人胚肾细胞HEK-293T购自中国科学院典型培养物保藏委员会细胞库;4-5周龄健康BALB/c小鼠购自新疆医科大学医学动物中心;BVDV新疆分离株TC株由新疆农业大学病毒学实验室保存。
1.1.2 试剂和仪器 QuantiNova SYBR Green PCR Master Mix购自Qiagen公司;TRIzol细胞裂解液购自Ambion公司;D2000 DNA Marker(MD114)、无内毒素质粒大量提取试剂盒(DP120)、cDNA第一条链合成试剂盒(KR103)、DNA琼脂糖凝胶回收试 剂 盒(DP219)和Taq PCR Master Mix(KT201)购自天根生化科技(北京)有限公司;限制性内切酶Xho I(1094A)和Xba I(1093A)购自宝日医生物技术(北京)有限公司;Trypsin-EDTA、高糖DMEM、胎牛血清(fetal bovine serum,FBS)、马血清(horse serum,HS)均购自BI公司;辣根过氧化物酶标记山羊抗兔IgG(H+L)购自Proteintech公司;兔抗OCLN抗体购自Thermo公司;低温高速离心机Thermo Fisher Scientific公司;实时荧光定量PCR仪(Fast 7500)购自ABI公司。
1.2 方法
1.2.1 慢病毒表达载体构建
1.2.1.1 引物合成 参考GenBank数据库中牛OCLN的基因序列(登录号:NM_001082433.2)设计OCLN基因扩增引物:OCLN-F1:5′-CCGCTCGAGAT GTCATCCAGGCCTTTTGAAAG-3′和OCLN-R1:5′-T GCTCTAGATGTTTTCCGTCGGTCGTAATCTC-3′;引物均由苏州金唯智生物科技有限公司合成。
1.2.1.2 PCR基因扩增鉴定 收集MDBK细胞加入适量的TRIzol细胞裂解液,提取总RNA,测定RNA浓度,并使用cDNA第一条链合成试剂盒反转录成cDNA,以cDNA为模板,以引物OCLN-F和OCLN-R,PCR扩增基因OCLN。PCR反应体系为2×Taq PCR Master Mix 10.0 μL、OCLN-F1/R1(10 μmol/L)各0.6 μL、cDNA 2.0 μL、ddH2O 6.8 μL;PCR扩增程序:预变性94℃ min;变性94℃ 40 s、退火68℃ 40 s、延伸72℃ 90 s、循环40次;终延伸72℃ 10 min、终止4℃。使用1%琼脂糖凝胶电泳检测PCR结果,并使用DNA琼脂糖凝胶回收试剂盒回收目的基因。
1.2.1.3 慢病毒表达载体构建 Xho I和Xba I双酶切pLVML-Myc-MCS-linker-GFP-IRES-Puro和OLCN基因回收产物,电泳检测后回收载体和目的基因,使用T4 DNA连接酶连接目的基因和载体,置于4℃连接过夜,次日转化到大肠杆菌Stbl3感受态细胞中,置于37℃培养过夜,PCR检测阳性克隆菌落,PCR反应条件和程序同1.2.1.2;将阳性克隆菌落送至苏州金唯智生物科技有限公司进行测序鉴定,测序结果使用Blast进行比对分析并制作进化树。
1.2.2 慢病毒包装及滴度测定 使用无内毒素质粒大量提取试剂盒分别提取pLVML-Myc-bOCLN-linker-GFP-IRES、pLVML-Myc-Mcs-linker-GFP-IRES-Puro、pSPAX2、pMD2.G质 粒,将pLVML-Myc-bOCLNlinker-GFP-IRES-Puro/pLVML-Myc-Mcs-linker-GFPIRES-Puro与辅助质粒共转染至HEK-293T细胞;转染48 h后观察绿色荧光GFP表达情况,收集细胞培养液,2 000 r/min离心5 min后取上清,使用0.45 μmol/L滤器过滤细胞碎片,病毒悬液转移至Amicon超滤离心管,4℃ 7 800 r/min离心90 min,转移浓缩柱内病毒液至EP管,-80℃保存备用;按照每孔1.5×105个细胞的密度将HEK-293T接种至24孔细胞培养板中,分别加入0.5、1、2、5 μL浓缩病毒液,并加入聚凝胺溶液(终浓度为8 μg/mL),慢病毒感染48 h后加入适量4%多聚甲醛固定细胞10 min,DAPI 染色20 min,使用荧光显微镜随机选择不同视野进行拍照,用ImageJ软件统计DAPI阳性细胞及绿色荧光阳性细胞数量,按照如下公式计算病毒滴度:病毒滴度(IU/mL)=(绿色荧光细胞/蓝色荧光细胞)/加入的病毒液体积×1.5×105×103[11]。
1.2.3 慢病毒感染BALB/c小鼠和BVDV攻毒 将30只4-5周龄BALB/c随机分为A(0 d)、B(4 d)、C(8 d)、D(10 d)、E(15 d)五组,每组6只,3只为实验组,3只为对照组。尾静脉注射5×107IU慢病毒,注射剂量200 μL,连续注射两次,每次间隔48 h,第二次注射慢病毒后96 h时,用1.68×105TCID50/只剂量的BVDV进行攻毒;攻毒后0、4、8、10、15 d处死一组小鼠,解剖后采集肾脏、肝脏、 脾脏、肺脏、小肠等组织,提取总RNA和各组织总蛋白;取少量组织浸润福尔马林溶液,后续制作病理切片,观察病变情况。
1.2.4 qRT-PCR检测各组织OCLN mRNA水平 称取1 g各组织,加入液氮研磨后,加入500 μL TRIzol细胞裂解液,提取各组织的总RNA,反转录成cDNA,qRT-PCR检测各组织中OCLN mRNA水平。qRT-PCR反 应 体 系 为:2×QuantiNova SYBR Green PCR Master Mix 10.0 μL,OCLN-F2/R2(10 μmol/L)各1.4 μL,cDNA 模 板 1.0 μL,QN ROX Reference Dye 0.1 μL,RNase Free ddH2O 6.1 μL;引物为OCLN-F2:5′-ACCTCTCCTCCCGGAGTAAT-3′;OCLN-R2:5′-GCTACCAAAGGCACTTCCTG-3′;qRT-PCR反应条件为:95℃ 2 min;95℃ 5 s、60℃ 30 s、40循环;按照如下公式计算OCLN mRNA水平:2-ΔΔCt=2-[(实验组目的基因Ct-实验组内参基因Ct)-(对照组目的基因Ct-对照组内参基因Ct)]。
1.2.5 Western blot检测各组织OCLN蛋白表达水平 称取1 g各组织,加入液氮研磨后加入RIPA蛋白裂解液提取总蛋白,使用BCA蛋白浓度测定试剂盒测定蛋白浓度;分别取80 μg总蛋白使用SDS-PAGE分离总蛋白,并转膜至PVDF,使用5%脱脂奶粉封闭2 h后,加入兔抗OCLN抗体(1∶1 000稀释)置于4℃孵育过夜,使用PBST洗涤3次后加入辣根过氧化物酶标记山羊抗兔IgG(H+L),使用ECL化学发光底物进行显色和曝光,并拍摄相应的图片。
1.2.6 qRT-PCR检测BVDV病毒载量 各组织处理、RNA提取、cDNA合成、qPCR反应体系和程序同1.2.1.2。BVDV病毒载量qRT-PCR检测引物为5′UTR-F:5′-CCTAGCCATGCCCTTAGTAGGACT-3′;5′UTR-R:5′-GGAACTCCATGTGCCATGTACA-3′;qRT-PCR标准曲线参照田瑞鑫等[12]报道。
1.2.7 组织病理切片检测 福尔马林溶液固定小鼠各组织后,经脱水浸蜡、包埋、切片、H&E染色步骤制备病理切片,观察各组织的病理变化情况。
1.2.8 统计分析 数据以mean±SD(平均值±标准误)表示。使用SPSS 17.0软件进行单因素t检验分析,使用graphpad prism 5.0进行柱状图作图;*P<0.05表示差异显著,**P<0.01表示差异极显著。
2 结果
2.1 慢病毒质粒构建
pLVML-Myc-bOCLN-linker-GFP-IRES-Puro和pLVML-Myc-Mcs-linker-GFP-IRES-Puro慢病毒质粒图谱见图1-A和1-B。使用PCR鉴定单克隆菌落,结果如图1-C,PCR扩增OCLN基因后电泳检测可见大小约为1 566 bp条带,与OCLN基因大小一致。使用Blast进行分析发现OCLN基因与GenBank数据库中牛OCLN基因(登录号:NM_001082433.2)序列同源性为100%(图1-D)。

图1 慢病毒质粒图谱和载体鉴定Fig. 1 Lentivirus plasmid map and vector identification
2.2 慢病毒包装结果
分别将过表达质粒pLVML-Myc-bOCLN-linker-GFP-IRES-Puro、对照质粒pLVML-Myc-Mcs-linker-GFP-IRES-Puro与包装辅助质粒(pSPAX2和pMD2.G)转染HEK-293T细胞,转染48 h后收集慢病毒悬液,并感染HEK-293T细胞,感染48 h后发现大量绿色荧光,根据公式计算得出慢病毒滴度为5×108IU/mL(图2)。

图2 慢病毒感染HEK-293T细胞后绿色荧光表达情况检测Fig. 2 Detection of green fluorescence expression in the HEK-293T cells infected with lentivirus
2.3 qRT-PCR检测小鼠各组织中OCLN mRNA水平
慢病毒尾静脉注射BALB/c小鼠,采集各组织提取总RNA,qRT-PCR检测各组织中OCLN mRNA水平变化。结果如图3所示,与对照GFP慢病毒感染相比,OCLN-GFP慢病毒感染BALB/c小鼠96 h后,小肠、肝脏、肺脏和脾脏等组织中OCLN mRNA水平显著性增加,其中肝脏中OCLN mRNA量最高。
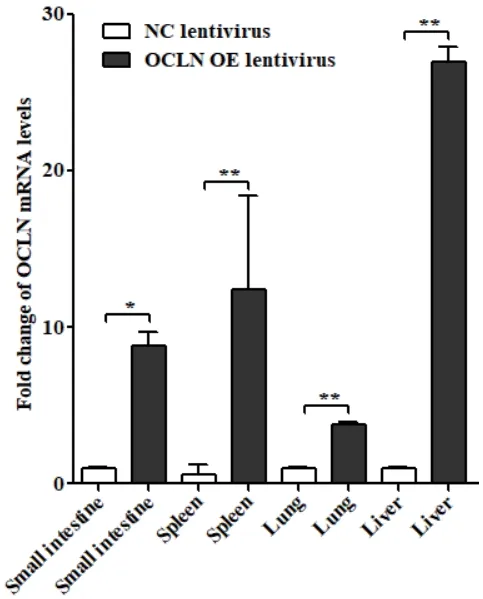
图3 qRT-PCR检测各组织中OCLN mRNA表达量Fig. 3 Detection of OCLN mRNA expressions in various tissues by qRT-PCR
2.4 Western blot检测小鼠各组织中OCLN蛋白表达水平
慢病毒注射BALB/c小鼠96 h后,采集各组织器官,提取总蛋白,Western blot检测各组织中OCLN蛋白表达水平。结果如图4所示,与对照GFP慢病毒感染相比,OCLN-GFP慢病毒感染后各组织中OCLN蛋白表达显著增加。

图4 Western blot检测各组织中OCLN蛋白表达水平Fig. 4 Expressions of OCLN protein in various tissues by Western blot
2.5 qRT-PCR检测各组织中BVDV载量
慢病毒感染BALB/c小鼠后进行BVDV攻毒处理,不同时间后使用qRT-PCR检测各组织中BVDV载量。结果如图5所示,与对照GFP慢病毒感染相比,BVDV攻毒OCLN-GFP慢病毒感染BALB/c小鼠0和4 d时,各组织中BVDV 5′ UTR拷贝数未出现明显的差异;BVDV攻毒后8、10和15 d时,OCLN-GFP慢病毒感染BALB/c小鼠各组织中BVDV 5′ UTR拷贝数差异逐渐明显,在攻毒后15 d时,BVDV 5′UTR拷贝数增加最显著,表明OCLN-GFP感染BALB/c小鼠造成OCLN蛋白过表达,有助于BVDV载量的增加。
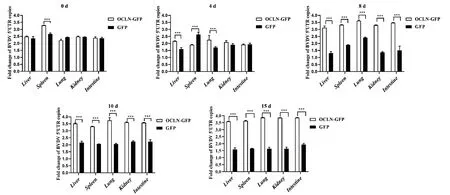
图5 qRT-PCR检测各组织中BVDV载量Fig. 5 BVDV loading in various tissue by qRT-PCR
2.6 病理切片检测BALB/c小鼠各组织病变情况
慢病毒注射BALB/c小鼠后BVDV攻毒,制作组织病理切片并进行H&E染色观察各组织病变情况。结果如图6所示,BALB/c小鼠各组织感染BVDV后都不同程度的病变。肝脏组织大量动、静脉以及肝窦充血,并伴有大量炎性细胞浸润,不同程度的颗粒变性、坏死现象;脾脏组织病变主要表现为淤血、组织局部出血,有少量淋巴细胞浸润;肺脏组织病变特征主要为出血、淤血、空泡,肺泡间隔显著增宽,肺泡坏死现象;肾脏组织病变特征主要出血、颗粒变形和少量淋巴细胞浸润,皮质髓质分界模糊,间质增生;小肠组织肠绒毛固有层淋巴细胞浸润,小肠毛细血管出血,肠黏膜固有层水肿,肠绒毛上皮细胞坏死。

图6 病理切片检测BALB/c小鼠各组织病变情况Fig. 6 Detection of pathological changes of various tissues in BALB/c mice by pathological section
与对照GFP慢病毒感染相比,BVDV攻毒OCLN-GFP慢病毒感染组各组织病变更为严重。BVDV攻毒4 d时,病变最先出现于肺脏,肺泡坏死出血,炎性细胞浸润;其次是肝脏中肝细胞坏死,炎性细胞浸润,其余组织较为轻微;BVDV攻毒10和15 d时,肺脏组织出血严重,肝细胞大量颗粒变形以及坏死现象出现;肺脏不同程度出血、淤血和空泡,肺泡坏死;肾脏出血,淤血、大量淋巴细胞浸润;脾脏炎性细胞浸润;小肠上皮细胞坏死,淋巴细胞浸润。
3 讨论
近年研究发现,细胞的分化、增殖、迁移、信号转导和基因表达中都有TJs的参与[13-16]。TJs功能丧失将导致癌症、中风、糖尿病视网膜病变、肺疾病和炎症性肠病等各种疾病的发生,据报道,至少有9种不同病毒家族的成员使用紧密连接相关蛋白作为受体[17]。TJs家族重要蛋白OCLN可作为HCV侵入的关键受体。OCLN主要表达于细胞膜,其蛋白结构包括2个细胞外环(extracellular loops,EL)和4个跨膜区域(transmembrane,TM)[18],其中EL2能与HCV囊膜蛋白E2发生互作,从而介导HCV侵入。BVDV与HCV属于同科病毒,其复制过程是否受到OCLN蛋白的介导,进而受OCLN调控?前期本课题组已通过CRISPR/Cas9基因敲除和RNAi敲低等技术敲除/低OCLN在BVDV靶细胞MDBK中的表达,进而研究其对BVDV复制影响,结果发现OCLN敲除/低都将严重影响BVDV在宿主细胞中复制,而OCLN是否影响BVDV体内复制?国内外尚未见报道。本研究采用慢病毒介导OCLN在BALB/c小鼠体内过表达,进而研究OCLN过表达对BVDV体内复制的影响,结果发现OCLN过表达造成BVDV在BALB/c小鼠体内病毒载量显著性增加,而感染造成的病变更加严重,表明OCLN过表达增加BVDV体内复制。
阮文强等[19]采用3株不同来源的CP型BVDV毒株,通过BALB/c小鼠为实验动物进行攻毒,病理切片可见攻毒小鼠肝脏和肠道炎性细胞浸润,上皮细胞脱落坏死,脾脏脾内吞噬细胞增多和脾小结反应性增生,肺泡萎缩和出血。田瑞鑫等[12]BVDV攻毒小鼠之后病理切片可见大部分脏器出现不同程度组织病变,心脏及肝脏组织局部出血、淤血,心肌细胞坏死症状明显,肺脏及脾脏颗粒变形并伴有大量淋巴细胞浸润,小肠上皮细胞坏死并有轻微出血现象。本实验在攻毒BVDV之后,与GFP组小鼠对比,OCLN-GFP组各个脏器均出现出血、淤血以及淋巴细胞浸润的现象且与对照组相比更为严重,根据病理切片结果发现,最先出现病变的部位在肺脏及肝脏,与BVDV感染小鼠体内的研究报道相似,因对实验动物周围环境进行控制可排除继发感染因素造成动物组织的病变。
OCLN基因作为一种保守基因,在不同种属之间同源性高达90%,且OCLN mRNA能够在肺、肾和肝中高水平表达[8]。采用慢病毒作为载体进行介导,通过慢病毒载体在宿主体内介导外源基因能够稳定表达且不会出现基因沉默现象的特性。实验通过采集慢病毒注射96 h后的RNA和蛋白使用qRTPCR和Western Blot技术来测定动物体内OCLN基因,与GFP组相比,肝、脾等组织均出现OCLN基因过表达情况,能够成功建立动物模型,为BVDV感染动物之后与OCLN基因的关系提供前期实验基础。田瑞鑫等[12]利用慢病毒介导pre-miR-29b在小鼠体内,采用相同时间段进行检测,并成功建立BALB/c小鼠模型。该结果与本研究类似。此外,本课题组前期研究发现OCLN能与BVDV囊膜蛋白E2发生互作,而具体OCLN哪些基序或位点与BVDV E2结合尚不清楚,亟待研究探索。
4 结论
本研究通过慢病毒介导OCLN在BALB/c体内过表达,发现OCLN过表达促进BVDV体内复制,将为BVDV感染机制研究及药物作用靶点提供依据。
