LINC00315在胃癌中的表达及对胃癌细胞增殖、凋亡的影响
2022-07-22贺海斌张智勇俞仲辉
贺海斌 张智勇 俞仲辉
胃癌是世界范围内最常见的恶性肿瘤之一,具有恶性程度高、发病率高及死亡率高等特点[1-2]。尽管近年来胃癌的诊疗水平已经有了大幅提升,但是现阶段胃癌患者的预后仍然不容乐观[3-4]。近年来,胃癌基因靶向治疗研究为胃癌患者带来了新的曙光,其中长链非编码RNA(long non-coding RNA,lncRNA)是研究热点之一[5-6]。lncRNA是一类长度超过200个核苷酸且不具有蛋白编码能力的单链RNA[6]。研究表明,异常表达的lncRNA参与胃癌的发生、发展[7]。如lncRNA NKX2-1-AS1在胃癌中的表达显著上调,且NKX2-1-AS1通过激活SERPINE1/VEGFR-2通路促进胃癌细胞的增殖、侵袭、转移以及新生血管的形成[8];lncRNA SNHG11通过激活Wnt/β-catenin通路促进胃癌细胞的增殖、侵袭、转移和上皮间质化[9];lncRNA CCDC144NLAS1通过靶向作用于miR-143-3p/MAP3K7通路促进胃癌发生、发展[10]。而值得注意的是,LINC00315为一条长度为2 323 bp的lncRNA,基因位于21q22.3。研究发现:在乳腺癌患者中,LINC00315的拷贝数改变与其临床特征相关[11];LINC00315在卵巢癌化疗耐药性中起着重要作用[12]。基于这些,本研究分析了LINC00315在胃癌中的表达情况,旨在探讨其与胃癌患者临床病理特征、预后的关系及其对胃癌细胞增殖、凋亡的影响,现报道如下。
1 材料和方法
1.1 胃癌患者和组织标本 选取2018年1月1日—2019年12月31日在宁波市医疗中心李惠利医院接受手术治疗并经术后病理诊断确诊的胃癌患者75例,收集每例患者的胃癌组织和对应的癌旁组织。患者中男49例,女26例;年龄26~78岁,中位年龄59岁。所有患者术前均未接受放疗、化疗等其他辅助治疗。所有获得的新鲜组织取得后均液氮冷冻,然后长期保存在-80°C冰箱。本研究经医院医学伦理委员会审核批准。
1.2 主要试剂 FBS和DMEM培养基购自美国Gibco公司;Trizol试剂购自美国Thermo Fisher Scientific公司;逆转录试剂盒(PrimeScript RT Reagent Kit)购自日本TaKaRa公司;实时定量PCR试剂盒(SYBR@Green Supermix)购自美国Bio-Rad公司;LINC00315特异性引物(HQP006418)和内参GAPDH引物(HQP006940)购自广州易锦生物技术有限公司;LINC00315小干扰RNA(siRNA)及siRNA阴性对照合成于上海Gene Pharma公司;MTT试剂盒购自江苏凯基生物科技发展有限公司;5-乙炔基-2-脱氧尿嘧啶(5-Ethynyl-2′-deoxyuridine,EdU)检测试剂盒购于广州锐博生物技术有限公司;流式细胞检测细胞凋亡试剂盒购自上海硕嘉生物科技有限公司;转染试剂Lipofectamine®3000购自美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 细胞培养及转染 胃癌细胞系NCI-N87、SGC-7901、AGS、HCG27和正常胃黏膜细胞GES-1均购自中国科学院上海细胞库。细胞置于37℃、5% CO2的细胞培养箱中培养,培养基为含10%FBS、1%青霉素-链霉素的DMEM培养液。细胞转染按Lipofectamine®3000说明书所示步骤进行。先将待转染细胞消化、离心、重悬、计数,然后将适宜数量的细胞接种于6孔板,待细胞融合度达到75%左右时,分别将LINC00315 siRNA、对照siRNA应用Lipofectamine®3000对HCG27细胞进行转染(分别为干扰组、对照组),48 h后应用实时荧光定量PCR检测其转染效率,并进行后续实验。
1.3.2 胃癌组织、癌旁组织及胃癌细胞、胃黏膜细胞LINC00315表达水平检测 采用qRT-PCR法。应用Trizol提取组织和细胞总RNA,采用NanoDrop微量紫外分光光度计(美国Thermo Fisher Scientific公司)测定RNA的纯度及浓度。应用逆转录试剂盒将1 μg总RNA逆转录为cDNA,应用实时定量PCR试剂盒检测LINC000315的表达水平,GAPDH为内参,每孔重复3次,上述操作均参照试剂盒说明书上的步骤进行,结果采用 2-ΔΔCt法进行分析。
1.3.3 胃癌细胞活力检测 采用MTT实验。将干扰组和对照组细胞接种于96孔板(1.5×104/孔),每组重复3个孔,培养24、48、72 h后,每孔加入20 μl MTT溶液,继续孵育4 h后每孔加入150 μl的DMSO终止反应。在酶联免疫监测仪上读取490 nm处的光密度(OD)。每组的3个孔取平均值,绘制细胞生长曲线。
1.3.4 胃癌细胞增殖能力检测 采用EdU细胞增殖实验。将干扰组和对照组细胞接种于96孔板(1×105/孔),每组重复3个孔,培养48 h后每孔加入100 μl EdU(50 μmol/L)培养基孵育2 h后弃去;PBS清洗2次后每孔加入50 μl细胞固定液,室温孵育30 min后弃去。加入 50 μl甘氨酸(2 mg/ml),摇床孵育5 min后弃去;PBS清洗后加入 100 μl Triton X-100(0.5%)孵育10 min;加入 100 μl Apollo®染色反应液,避光室温孵育30 min后,加入100 μl聚乙二醇辛基苯基醚(Triton X-100)(0.5%)清洗2~3次;加入100 μl Hoechst 33342反应液,避光室温孵育30 min;100 μl PBS清洗1~3次后观察、拍照。
1.3.5 胃癌细胞凋亡率检测 采用流式细胞术。细胞凋亡检测按照细胞凋亡试剂盒说明书步骤进行。转染48 h后,收集干扰组和对照组细胞,用预冷的PBS洗涤后离心,弃掉上清液。用300 μl结合缓冲液重悬,然后分别加入5 μl藻红蛋白标记的重组人附件素V(PE Annexin V)试剂和 5 μl 7-氨基放线菌素 D(7-AAD)试剂,并置于避光条件下室温孵育15 min。应用流式细胞仪检测,细胞凋亡拟合软件分析数据。
1.4 观察指标 (1)比较胃癌组织与癌旁组织LINC00315表达水平;(2)比较胃癌细胞、胃黏膜细胞LINC00315表达水平;(3)根据75例胃癌组织中LINC00315的中位表达水平,将患者分为LINC00315高表达患者和低表达患者,分析LINC00315表达水平与胃癌患者临床病理特征的关系;(4)应用来自公共数据库 GEPIA(http://gepia.cancer-pku.cn)的TCGA数据分析LINC00315的表达水平对胃癌患者预后的影响;(5)比较干扰组和对照组细胞LINC00315表达水平、细胞活力、增殖能力;(6)比较干扰组和对照组细胞凋亡率。
1.5 统计学处理 采用SPSS 20.0和Graphpad Prism 6统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验,胃癌组织与癌旁组织比较采用配对t检验。计数资料以频数和构成比表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,生存曲线的比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织与癌旁组织LINC00315表达水平比较胃癌组织LINC00315表达水平高于癌旁组织(P<0.05),见图1。

图1 胃癌组织与癌旁组织LINC00315表达水平比较
2.2 胃癌细胞、胃黏膜细胞LINC00315表达水平比较胃癌 NCI-N87、SGC-7901、AGS、HCG27 细 胞LINC00315表达水平均高于胃黏膜GES-1细胞(均P<0.05),见图2。

图2 胃癌细胞、胃黏膜细胞LINC00315表达水平比较
2.3 LINC00315表达水平与胃癌患者临床病理特征的关系分析 根据75例胃癌组织中LINC00315的中位表达水平(4.22),将患者分为LINC00315高表达患者39例和低表达患者36例。分析结果显示:LINC00315表达水平与患者肿瘤大小及TNM分期有关(均P<0.05),高表达患者肿瘤较大、TNM分期较晚;而与年龄、性别、分化程度、手术方式及淋巴结转移等因素无关(均P>0.05),见表1。

表1 LINC00315表达水平与胃癌患者临床病理特征的关系分析[例(%)]
2.4 LINC00315表达水平对胃癌患者预后的影响TCGA数据分析LINC00315的表达水平对胃癌患者预后的影响,结果显示:LINC00315高表达的胃癌患者总生存率、无病生存率均低于LINC00315低表达的胃癌患者(均P<0.05),见图3。

图3 LINC00315高表达与低表达胃癌患者总生存曲线和无病生存曲线比较(a:总生存曲线;b:无病生存曲线)
2.5 干扰组和对照组细胞LINC00315表达水平、细胞活力、增殖能力比较 干扰组细胞LINC00315表达水平低于对照组(P<0.05),见图4。MTT实验结果显示:培养24、48、72 h后,干扰组细胞活力较对照组减弱(均P<0.05),即敲低LINC00315的表达导致HCG27细胞活力明显减弱,见图5。EdU细胞增殖实验结果显示:干扰组细胞增殖能力较对照组减弱(均P<0.05),即敲低LINC00315的表达导致HCG27细胞增殖能力明显减弱,见图6。
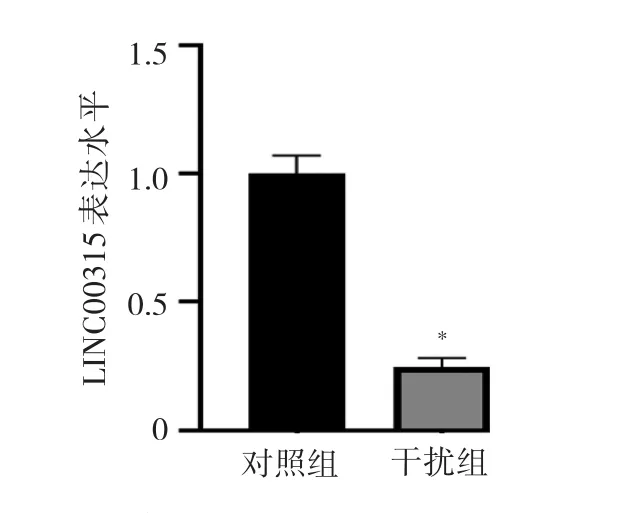
图4 干扰组和对照组细胞LINC00315表达水平比较

图5 干扰组和对照组细胞活力比较

图6 干扰组和对照组EdU阳性细胞率比较)
2.6 干扰组和对照组细胞凋亡率比较 干扰组细胞凋亡率高于对照组(P<0.05),即敲低LINC00315的表达导致HCG27细胞的凋亡率明显升高,见图7。

图7 干扰组和对照组细胞凋亡率比较
3 讨论
胃癌是世界范围内最常见的恶性肿瘤之一,具有较高的发生率和致死率。一直以来,国内外学者都在积极致力于研究如何提升胃癌的诊疗水平,而近年来以lncRNA为代表的胃癌靶向治疗是研究热点之一[13-14]。既往认为,lncRNA是基因组转录产生的“噪音”,不具有生物学功能。而随着研究的不断深入,人们发现lncRNA能够参与细胞的X染色体沉默、基因组印记、基因转录激活、转录干扰等多种重要的调控过程[15-17]。而研究也表明,异常表达的lncRNA与包括胃癌在内的肿瘤的发生、发展密切相关[18-22]。例如,Song等[18]研究发现lncRNA TMEM92-AS1能够通过与YBX1蛋白的结合介导CCL5对胃癌发生、发展的调节作用;Ma等[19]研究发现lncRNA NEAT1在胃癌细胞中可作为BRG1蛋白的“支架”,从而调控GADD45A的表达量进而影响胃癌的发生、发展;此外,Ma等[20]研究发现EGR1介导的LINC01503可通过表观调控DUSP5/CDKN1A的表达水平从而调控胃癌细胞的发生、发展。由此可见,lncRNA在胃癌的发生、发展中起着极其重要的作用。然而,LINC00315在胃癌中的表达情况报道鲜见。
本研究发现:LINC00315在胃癌组织和细胞系中的表达均明显上调,并且高表达的LINC00315与胃癌较大的肿瘤体积和较晚的TNM分期有关。此外,LINC00315高表达的胃癌患者的总生存率和无病生存率与低表达患者相比明显降低。上述结果提示,LINC00315可能是胃癌的促癌基因,且对判断胃癌的恶性程度及患者预后具有一定的临床参考价值。
在细胞功能实验中,本研究发现敲低胃癌细胞中LINC00315表达后,胃癌细胞活力和增殖能力均被明显抑制,此外,细胞的凋亡率明显增加。上述结果表明,LINC00315能够增强胃癌细胞的增殖能力,并能抑制胃癌细胞的凋亡。这一结果与在临床病理特征分析中的发现,即高表达的LINC00315与胃癌较大的肿瘤体积和较晚的TNM分期有关,是相符的。笔者推测LINC00315可能通过上调细胞内CDK4、Cyclin D1蛋白表达,加速细胞周期进展,进而促进细胞增殖。然而,LINC00315在胃癌细胞中的其他生物学作用、其上下游调控因子还有待进一步探究。
综上,LINC00315在胃癌中表达上调,其与胃癌的肿瘤大小、TNM分期以及患者的预后密切相关;高表达的LINC00315可以促进胃癌细胞的增殖、抑制胃癌细胞的凋亡。
