唑吡坦对慢性睡眠剥夺老年失眠大鼠神经递质及下丘脑-垂体-肾上腺皮质轴相关激素的影响
2022-07-22林明霞李宝梅朱春燕
林明霞 李宝梅 朱春燕
失眠主要表现为入睡困难、睡后反复醒来难以再次入睡或睡眠质量差,极易影响白天日常生活。根据电生理参数,睡眠被分为快速动眼睡眠(rapid eye movement sleep,REMS)和非快速动眼睡眠,前者表现为脑电图与肌肉张力不同步和快速眼球运动,此阶段睡眠中大脑活动类似清醒状态,交感神经张力增加,血压和心率随之升高但肌肉松弛。人类随着年龄增加,REMS时间逐渐缩短,睡眠效率降低,睡后觉醒增多[1]。近半数老年人存在慢性失眠[2]。研究表明:失眠与许多精神疾病相关,持续性失眠的老年患者患抑郁症、认知障碍等的风险增加[3-4]。行为疗法和药物疗法是目前治疗失眠的主要手段,所用药物主要药效学机制多与神经递质和下丘脑-垂体-肾上腺皮质轴(hypothalamus-pituitary-adrenal cortex axis,HPA)激素相关,但多数药物存在严重的不良反应,如苯二氮花罩类受体激动剂通过作用于苯二氮花罩受体和γ-氨基丁酸(γ-aminobutyric acid receptors,GABA)受体打开氯离子通道,对中枢系统产生抑制作用,具有抗焦虑、催眠镇静等作用,但可引起嗜睡、头晕、头痛、共济失调等不良反应[5],因此需要疗效相似但更加安全的药物。唑吡坦是一种非苯二氮花罩类受体调节剂,具有改善睡眠潜伏期和睡眠持续时间,减少短暂性失眠患者觉醒次数的作用[6]。本研究通过建立慢性睡眠剥夺老年失眠大鼠模型,探究唑吡坦对其神经递质及HPA相关激素的影响,以期为临床治疗老年性失眠提供参考。
1 材料和方法
1.1 材料
1.1.1 实验动物 60只SPF级SD大鼠,32周龄,体质量350~400 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0006。本次实验经浙江大学实验动物中心动物实验伦理委员会批准(批号:ZJDXDWLL20210121L),符合3R原则。
1.1.2 主要药品与试剂 酒石酸唑吡坦片购自赛诺菲(杭州)制药有限公司(国药准字:J20130015,规格:10 mg),艾司唑仑片购自上海上药信谊药厂有限公司(国药准字:H31021534,规格:1 mg),多巴胺(dopamine,DA)、5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)检测试剂盒购自武汉菲恩生物科技有限公司(批号分别为FN-EU0392、ER1463、EU2565),大鼠肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮(cortisol,CORT)、ELISA试剂盒购自上海酶研生物科技有限公司(批号分别为EK-R37071、EK-R37072、EK-R38929),蛋白质定量试剂盒购自武汉博士德生物工程有限公司(批号:AR0146),5-羟色胺1A受体(5-hydroxytryptamine 1Arecrptor,5-HT1AR)、A型γ-氨基丁酸受体(γ-aminobutyric acid receptors type A receptor,GABAAR)抗体购自美国Abcam公司(批号分别为ab227165、ab92747)。
1.2 方法
1.2.1 动物分组、建模与干预 60只大鼠随机分为环境对照组、模型组、唑吡坦低、中、高剂量组和阳性药组,每组10只,采用花盆法复制慢性睡眠剥夺失眠老年大鼠模型[7-8]。准备2种倒置花盆平台装置,中间凸起部分(平台)直径分别为6.5和12.5 cm,平台周围注满水。除环境对照组大鼠饲养在较大的平台上外,其余组大鼠饲养在较小的平台上,所有大鼠均可在平台上自由活动。装置设有金属笼盖,笼盖有凹槽可供大鼠自由摄食,大鼠每日在装置中饲养18 h,剩余6 h转至常规饲养笼具中正常喂养,持续21 d。第22天开始药物干预,按照人与大鼠等效剂量比计算剂量,唑吡坦低、中、高剂量组大鼠分别为1/2、1、2倍大鼠等效剂量,即以0.52、1.05、2.10 mg/kg唑吡坦灌胃,阳性药组大鼠以艾司唑仑0.50 mg/kg[9]灌胃,环境对照组和模型组大鼠以10 ml/kg的0.9%氯化钠溶液灌胃,1次/d,持续14 d。治疗前、后对大鼠称体质量。
1.2.2 行为学实验 药物干预结束后通过行为学实验评估各组大鼠学习和记忆能力。(1)旷场实验:将大鼠放入旷场实验装置中央,记录5 min内大鼠的运动距离和中央运动时间。(2)Morris水迷宫实验:实验第1~3天,将大鼠从随机位置放入水中,记录其找到并爬上平台的时间(逃避潜伏期),若90 s内未找到平台,则将其引导至平台,将时间记为90 s;第4天撤去平台,将大鼠从原先平台所在象限的对侧放入水中,记录其进入原先平台所在象限的次数和停留时间。实验重复3次取平均值。
1.2.3 脑系数计算 行为学实验结束后,用10%水合氯醛腹腔注射麻醉大鼠,腹主动脉取血后,迅速取出全脑称质量,计算脑系数。脑系数=脑质量(g)/体质量(g)×100%。
1.2.4 下丘脑神经递质和血清HPA轴相关激素检测 将称量后的全脑置于冰上分离下丘脑,手动匀浆;大鼠腹主动脉血静置2 h后,离心分离血清。采用ELISA法分别检测下丘脑神经递质DA、5-HT、NE和血清HPA轴相关激素CRH、ACTH、CORT水平。按照试剂盒方法在酶标板中加入50 μl样本和50 μl生物素化抗体工作液,37℃孵育45 min;洗板3次后加入100 μl工作液,37 ℃孵育30 min;洗板5次,加入90 μl底物溶液,37℃孵育15 min,加入50 μl工作终止液。测量450 nm下的吸光度,计算神经递质和激素水平。
1.2.5 下丘脑5-HT1AR、GABAAR蛋白表达水平检测 采用Western blot法。下丘脑组织加入裂解液充分匀浆、水浴变形后,进行蛋白定量,在电泳仪上进行电泳和电转。蛋白条带膜在5%脱脂牛奶封闭1 h后,摇床漂洗条带3次;4℃一抗孵育过夜,摇床漂洗条带3次;二抗孵育2 h,摇床漂洗条带3次。凝胶成像显色,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用Image J软件分析条带灰度值。
1.3 统计学处理 采用SPSS 24.0统计软件,所有实验均重复3次。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 6组大鼠体质量、脑系数比较 比较6组大鼠体质量,环境对照组大鼠体质量呈逐渐升高趋势,其余各组呈先降低后升高趋势;治疗后唑吡坦中、高剂量组和阳性药组大鼠体质量均高于模型组(均P<0.05)。与环境对照组比较,模型组大鼠脑系数降低(P<0.05);与模型组比较,唑吡坦中、高剂量组和阳性药组大鼠脑系数均升高(均P<0.05)。见表1。

表1 6组大鼠体质量、脑系数变化
2.2 6组大鼠行为学实验变化比较 旷场实验结果显示:与环境对照组比较,模型组大鼠5 min内运动距离和中央运动时间均升高(均P<0.05);与模型组比较,唑吡坦中、高剂量组和阳性药组大鼠5 min内运动距离和中央运动时间均降低(均P<0.05)。Morris水迷宫实验结果显示:与环境对照组比较,模型组大鼠90 s内逃避潜伏期延长(P<0.05),原平台象限停留次数、停留时间均减少(均P<0.05),与模型组比较,唑吡坦中、高剂量和阳性药组大鼠90 s内逃避潜伏期均缩短(均P<0.05),原平台象限停留次数、停留时间均增加(均P<0.05)。见表2。
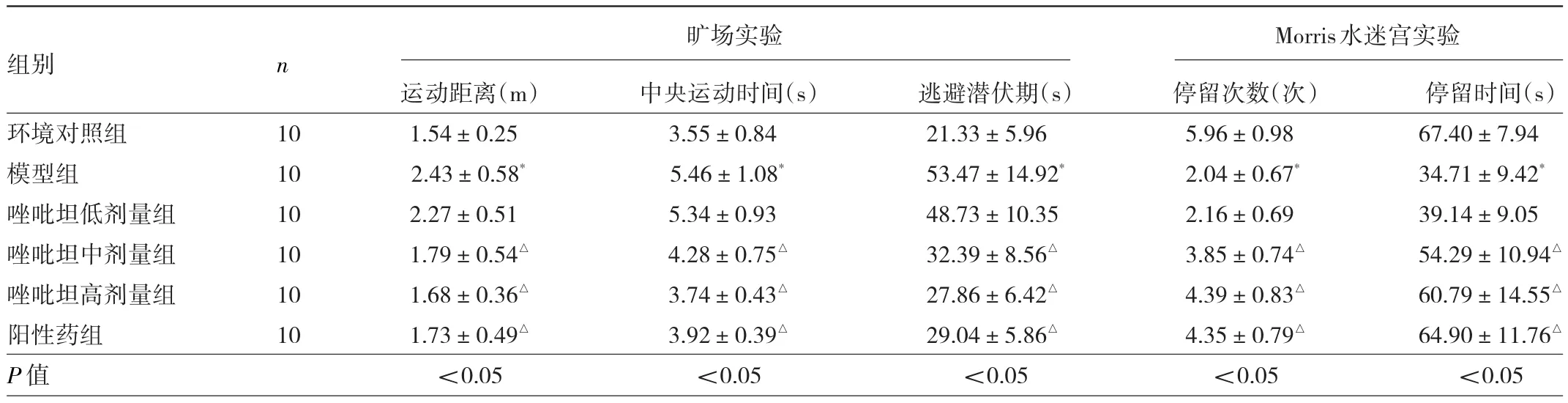
表2 6组大鼠旷场实验、Morris水迷宫实验结果比较
2.3 6组大鼠下丘脑神经递质变化比较 与环境对照组比较,模型组大鼠下丘脑DA、NE质量浓度升高(P<0.05),5-HT质量浓度降低(P<0.05)。与模型组比较,唑吡坦中、高剂量组和阳性药组大鼠下丘脑DA、NE质量浓度降低(P<0.05),5-HT质量浓度升高(P<0.05)。见表3。
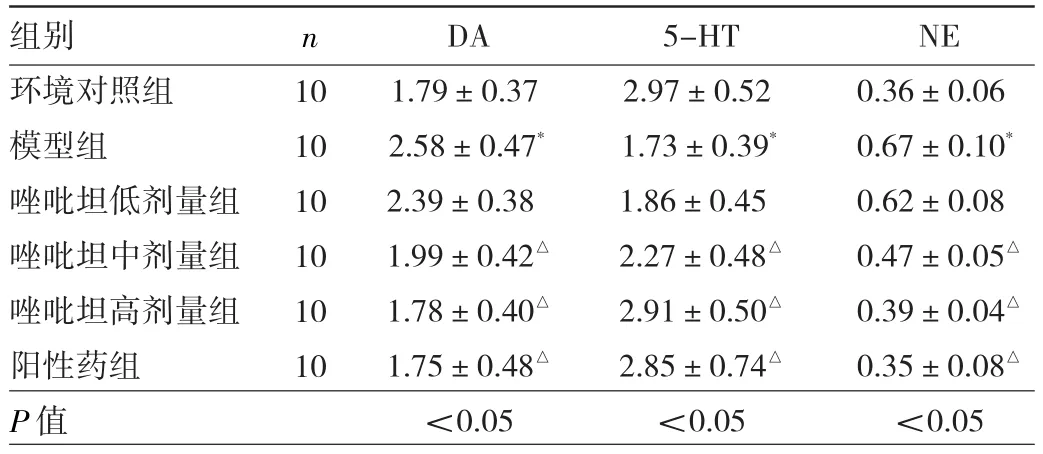
表3 6组大鼠下丘脑DA、5-HT、NE变化比较(μg/L)
2.4 6组大鼠血清HPA相关激素水平变化比较 与环境对照组比较,模型组大鼠血清CRH、ACTH、CORT质量浓度升高(P<0.05);与模型组比较,唑吡坦中、高剂量和阳性药组大鼠血清CRH、ACTH、CORT质量浓度降低(P<0.05)。见表4。
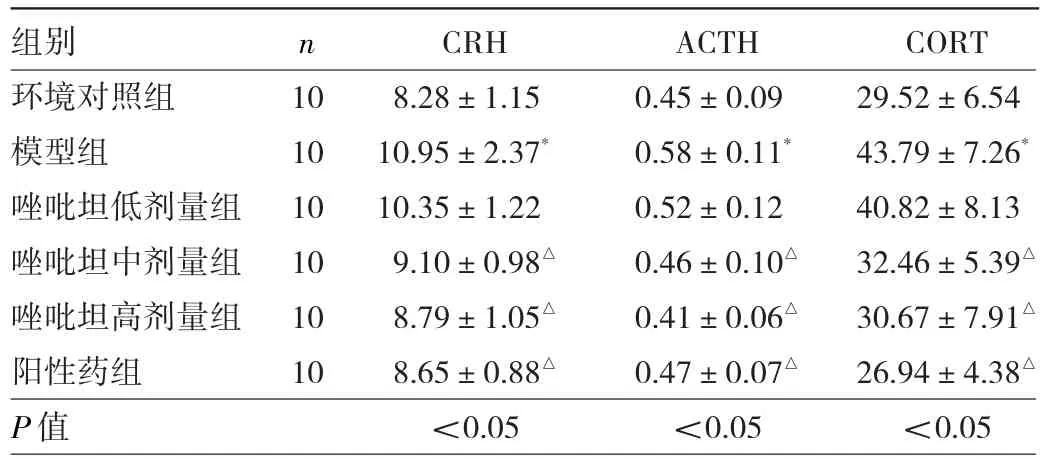
表4 6组大鼠血清CRH、ACTH、CORT水平变化比较(μg/L)
2.5 6组大鼠下丘脑GABAAR、5-HT1AR蛋白表达变化比较 与环境对照组比较,模型组大鼠下丘脑GABAAR、5-HT1AR蛋白相对表达量降低(P<0.05);与模型组比较,唑吡坦中、高剂量组和阳性药组大鼠下丘脑GABAAR、5-HT1AR蛋白相对表达量升高(P<0.05)。见图1。
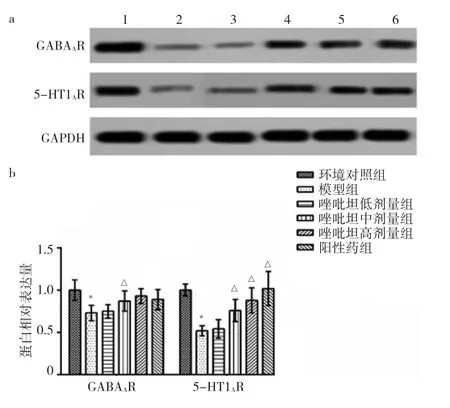
图1 唑吡坦对大鼠下丘脑GABAAR、5-HT1AR蛋白表达变化的影响(a:GABAAR、5-HT1AR蛋白电泳图;1-6依次为环境对照组、模型组、唑吡坦低剂量组、唑吡坦低中剂量组、唑吡坦高剂量组和阳性药组。b:GABAAR、5-HT1AR蛋白相对表达量)
3 讨论
睡眠受中枢系统主导的昼夜节律和机体动态平衡的调节,在维持正常生理生理活动中具有重要作用。自然衰老过程中,睡眠结构和参数不断变化,N1、N2睡眠阶段占比和夜间清醒时间不断增加,而睡眠效率、稳态和慢波睡眠占比不断降低[10]。研究表明:19~75岁,REMS比例呈线性下降,每10年下降0.6%[11]。实验性REMS剥夺可影响大脑中酶、代谢物、神经递质以及导致细胞凋亡的神经元结构蛋白。花盆法是目前常用的REMS剥夺方法[12]。本研究采用花盆法建立老年失眠大鼠模型,21 d建模期后,大鼠体质量和脑系数明显降低,学习和记忆能力降低。表明老年大鼠在经过慢性REMS剥夺后表现出异常兴奋,动物模型建立成功。
唑吡坦是一种非苯二氮花罩类药物,通过与GABA受体复合体上的苯二氮花罩类结合起作用,引起神经抑制并诱导睡眠,对GABAAR的α1亚型具有很高的亲和力,半衰期短、起效较快。目前国外出现了有关其滥用倾向的报道[13],但国内相关报道较少;在规定剂量内,唑吡坦的滥用和依赖风险较低,相比阿普唑仑,唑吡坦在失眠症上的治疗效果更好,安全性更高[14-15]。本研究发现:经中、高剂量唑吡坦干预后,老年失眠大鼠体质量和脑系数明显高于模型组,学习和记忆能力显著改善,与谢光璟等[16]研究结果类似。表明唑吡坦可改善老年慢性失眠大鼠的学习和记忆能力。
中枢神经递质紊乱在失眠的复杂机制中具有重要作用,包括NE、DA、GABA和5-HT等在内的单胺类神经递质参与了睡眠调节[17]。5-HT主要分布于脑皮质和神经突触,可作用于大脑中与睡眠和清醒控制相关的多个区域,抑制觉醒并延长REMS,5-HT1AR是5-HT的受体[18-19]。DA主要分布于中脑腹侧被盖区和黑质致密部,在清醒时逐渐升高[20]。GABA是中枢神经系统的主要抑制性神经递质,其受体GABAAR与睡眠相关,GABA与GABAAR结合对唤醒系统具有抑制作用。GABAAR是苯二氮卓类药物、巴比妥类药物等多种神经类药物的靶标,参与神经系统多种疾病机制[21]。本研究中,老年慢性失眠大鼠下丘脑DA、NE质量浓度升高,5-HT质量浓度降低,GABAAR、5-HT1AR蛋白相对表达量降低;经中、高剂量唑吡坦干预后均有所改善,与张利平[22]研究结果类似。表明唑吡坦可改善老年慢性失眠大鼠下丘脑神经递质紊乱。
HPA参与调节人体体内平衡和应激反应,其功能障碍与失眠相关。研究表明:HPA功能障碍与CRH、ACTH和CORT水平提高有关[23]。HPA激活是一连串复杂过程,由下丘脑分泌的CRH可直接作用于垂体,促进垂体分泌ACTH,ACTH可促进肾上腺皮质分泌糖皮质激素,而糖皮质激素可对垂体和下丘脑产生反馈,进而调整HPA[24]。因此,维持HPA轴稳定对调节睡眠具有重要意义。本研究发现:老年慢性失眠大鼠血清CRH、ACTH、CORT质量浓度升高,经唑吡坦干预后回落,与Dong等[25]的研究结果一致。表明唑吡坦可改善老年慢性失眠大鼠血清HPA相关激素水平。
综上所述,唑吡坦对老年慢性睡眠剥夺失眠大鼠学习和记忆能力和睡眠情况具有改善作用,可提升血清HPA相关激素水平,改善下丘脑神经递质紊乱,上调下丘脑GABAAR、5-HT1AR蛋白表达。
