基于PET效应检测8-氧鸟嘌呤DNA糖基化酶的荧光传感器
2022-07-22李哲建乔成芳
刘 萍,金 东,李哲建,乔成芳
(1.商洛学院 化学工程与现代材料学院,陕西 商洛 726000;2.陕西省尾矿资源综合利用重点实验室,陕西商洛 726000;3.南京邮电大学 材料科学与工程学院,江苏 南京 043000)
生物体的生命活动经常会受到内、外致突变因素的影响,引起DNA 碱基损伤。8-氧鸟嘌呤(8-oxoG)是DNA氧化损伤的重要标志[1]。8-氧鸟嘌呤DNA糖基化酶(OGG1)是一类存在于生物体内能够参与DNA 损伤修复过程的蛋白酶,可与DNA 双链进行非特异性结合,选择性识别并切除DNA 双链中的8-oxoG,形成脱嘌呤(AP)位点,并在一系列修复酶协助下完成DNA 分子的修复[2]。人体中8-氧鸟嘌呤DNA 糖基化酶(OGG1)称为hOGG1。研究表明:OGG1的异常与多种疾病以及癌症密切相关[3],其已成为多种疾病发展状态的重要标志物和癌症的潜在治疗靶点,因此实现对OGG1 活性的快速、灵敏检测对于基础生化研究和临床医学发展具有十分重要的意义。
检测OGG1 的传统方法有凝胶电泳法[4]、放射性检测法[5]、高效液相色谱法(HPLC)[6]、比色法[7]、电化学法[8]和荧光分析法[9-10]等,如蒋健晖课题组[7]基于探针末端保护原理,利用表面修饰寡核苷酸的AuNP作为识别探针,发展一种检测hOGG1活性的比色分析法。Liu等[8]基于hOGG1对8-oxoG 的识别特性,设计了包含8-oxoG及亚甲基蓝分子(MB)的DNA探针,利用方波伏安法(SWV)表征hOGG1的活性,将酶活性成功转化成物理信号输出,建立了目标蛋白与电化学信号之间的量化关系,构建了灵敏的hOGG1 电化学传感器。刘斌等[9]利用标记荧光的发夹结构分子信标,设计含有8-oxoG 且有标记的双链DNA,利用hOGG1的特异性功能解链,再用适体与解旋链形成复合物,通过实时监测8-oxoG 切割过程建立了一种hOGGl 活性分析的新方法。李峰课题组[10]发展一种核酸外切酶ExoⅢ辅助的等温循环信号放大策略,实现了对hOGG1活性的荧光检测。但多数方法存在灵敏度差、操作复杂、分析耗时、仪器昂贵、污染环境等不足,极大地限制了方法的推广应用。
本文基于G碱基与羧基荧光素(FAM)产生光诱导电子转移(PET)效应[11-12],利用OGG1酶能特异识别含有8-oxoG 的双链DNA 的特点,建立了一种检测OGG1 酶活性的荧光新方法。该方法具有操作简便、成本低等优点。
1 实验部分
1.1 仪器与试剂
F-4600 型日立荧光分光光度计(日本日立公司),便携式pH 计、XS105DU 型电子天平(瑞士梅特勒-托利多公司),TGL-18C离心机(上海安亭科学仪器厂),移液枪(北京大龙公司),恒温水浴锅(上海跃进医疗器械有限公司)。
三(羟甲基)氨基甲烷(Tris,上海青析化工科技有限公司),NaCl、EDTA、无水乙醇(国药集团化学试剂有限公司),MgCl2、Cd(NO3)2·4H2O(上海麦克林生化科技有限公司),均为分析纯;实验用水为Milli-Q超纯水(18.2 MΩ·cm)。
8-氧鸟嘌呤糖基化酶(OGG1)、10×NEB缓冲液(100 mmol/L Tris-HCl、100 mmol/L MgCl2、10 mmol/L 1,4-二硫苏糖醇(DTT),pH 7.0)、100 × 牛血清白蛋白(10 mg/mL BSA)购于NEB 公司(New England Bioblabs 公司),尿嘧啶DNA 糖基化酶(UDG)、10 × 反应缓冲液(200 mol/L Tris-HCl、10 mmol/L EDTA、100 mmol/L NaCl,pH 8.2)核糖核酸酶(RNase A)、实验所用DNA序列(表1)均购于上海生物工程股份有限公司。DNA 使用前在10 000 r/min 下离心5 min,然后用10 mmol/L Tris-HCl 缓冲液(含1 mmol/L NaCl、1 mmol/L EDTA,pH 8.0)配制成100µmol/L DNA储备液,于-18 ℃冷冻保存。

表1 实验所用的DNA序列(5'-3')Table 1 DNA sequences used in the experiment(5'-3')
1.2 实验方法
1.2.1 DNA 杂交 取5µL 100µmol/L FAM-DNA1 溶液于离心管中,加入5µL 100µmol/L 含G 碱基且与FAM-DNA1 互补的DNA(c-DNA)溶液,用10 mmol/L Tris-HCl 缓冲液(含50 mmol/L NaCl、10 mmol/L MgCl2、1 mmol/L EDTA,pH 8.0)定容至100 µL,充分混合。然后置于水浴中缓慢升温至95 ℃,保持10 min 后自然降至室温并孵育30 min,室温下避光培育过夜,使DNA 充分杂交。2 条单链DNA 序列互补,形成稳定的DNA 双链结构,将得到的FAM/dsDNA1 溶液储存于4 ℃的冰箱中备用。采用同法得到FAM/dsDNA2。
1.2.2 OGG1 的测定 取100µL FAM/dsDNA1 溶液于比色皿中,测定其荧光强度(F0),然后加入不同浓度的OGG1,反应溶液为1×NEB,300 g/mL BSA 的缓冲液,混匀后在40 ℃恒温水浴中反应2.5 h。待溶液冷却至室温后,设置荧光仪的激发波长为490 nm,狭缝宽度为5 nm,激发和发射光倍增管电压为700 V,在500 ~650 nm 范围内测定荧光发射光谱强度(F)。根据加入OGG1 前、后体系荧光强度的差值ΔF(ΔF=F-F0)测定OGG1的浓度。
2 结果与讨论
2.1 实验原理
基于G碱基对荧光染料的猝灭效应以及OOG1对8-oxoG的识别和切除作用,以1条5'末端标记羧基荧光素且含有8-oxoG 的DNA 链为信号探针,1 条3'末端含多个G碱基的互补序列作为猝灭基团,当2 个链杂交后G 碱基末端会接近FAM,从而引发有效的光诱导电子转移,导致荧光猝灭。当体系中加入OGG1,其将受损G碱基剪切后DNA 序列产生缺口,较短的带有FAM 信号的DNA 片段由于熔化温度降低从互补链上解旋下来,释放出FAM 的荧光信号,导致体系荧光增强。根据加入OGG1 前、后体系的荧光强度变化可实现对OGG1的活性检测。检测的实验原理如图1所示。
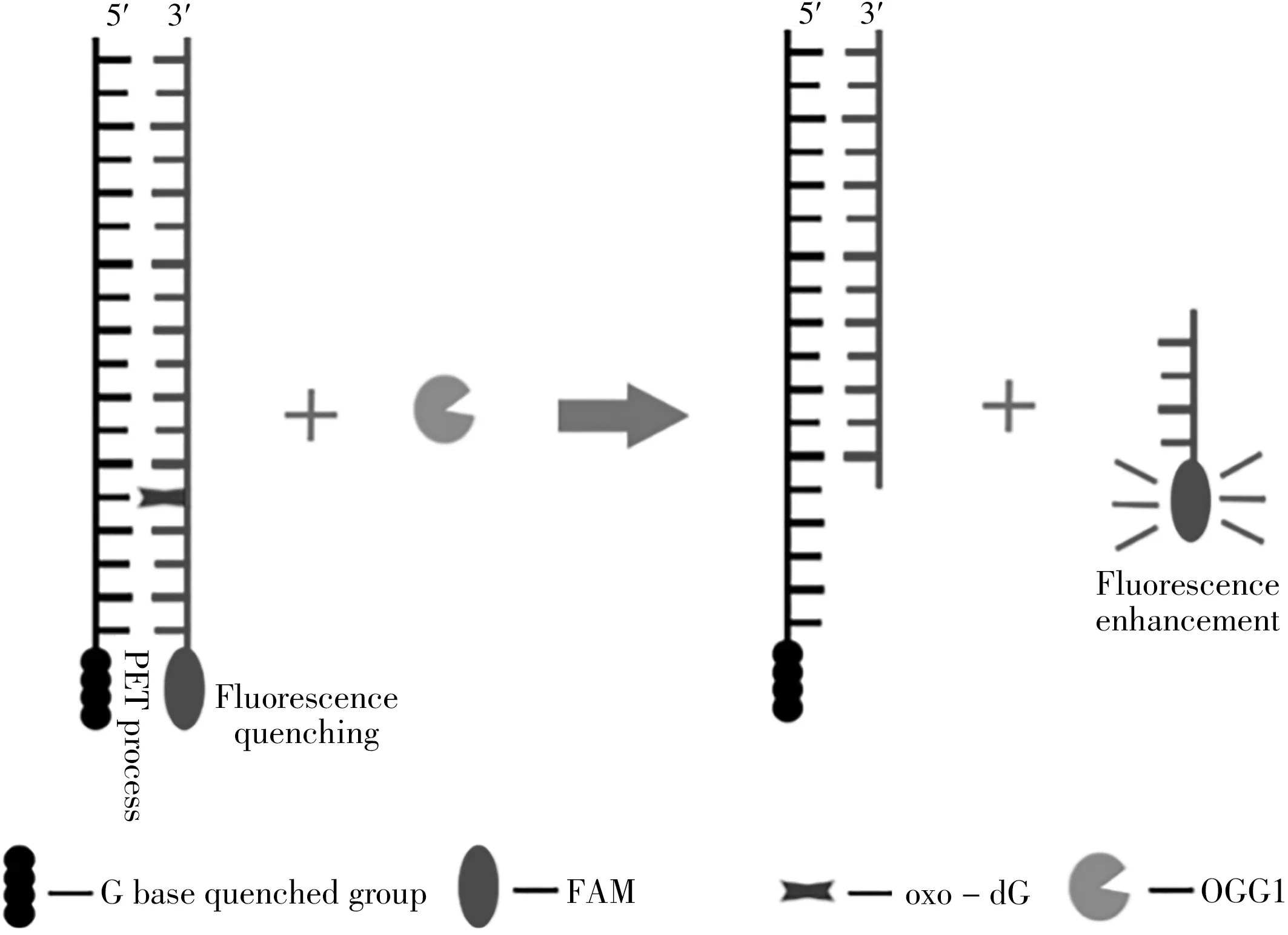
图1 实验原理示意图Fig.1 Schematic diagram of the experimental principles
2.2 传感器的可行性
为验证方法的可行性,实验考察了加入OGG1 前、后反应体系的荧光光谱(如图2)。结果显示,FAM-DNA1具有很强的荧光信号,与c-DNA杂交后体系的荧光强度明显降低,说明形成双链DNA 后G 碱基和FAM之间产生PET效应,猝灭了FAM的荧光;当向底物中加入OGG1 后,荧光强度增强,且加入的OGG1 浓度越大,荧光信号增强越大。说明向猝灭体系中加入OGG1 后,由于酶对oxoG 碱基的识别切除作用,使得双链结构被破坏,熔化温度降低,释放出带FAM 的DNA片段,阻止了PET 过程,体系的荧光强度得到恢复。实验现象与设计的原理相一致。
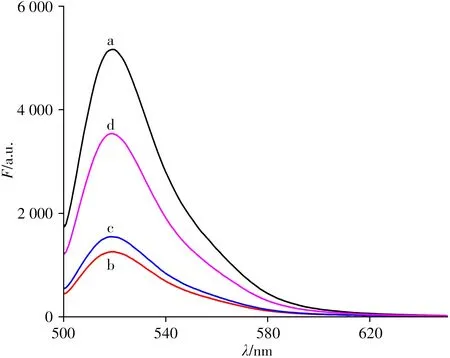
图2 不同条件下FAM-DNA1的荧光光谱Fig.2 Fluorescent spectra of FAM-DNA1 in different conditions a:5 mmol/L FAM-DNA1;b:a+5 mmol/L c-DNA;c:b+10 U/mL OGG1;d:b+60 U/mL OGG1
为进一步验证体系荧光信号的升高是OGG1 剪切释放FAM-DNA 片段所致,以1 条相同序列的FAMDNA2 作为空白对照,在其它条件不变的情况下,考察其加入OGG1前、后体系的荧光信号变化(如图3)。结果表明,FAM-DNA2与c-DNA杂交后荧光信号同样被猝灭,当加入OGG1 后荧光强度无明显变化,说明双链结构未被破坏,不能产生荧光恢复。原因在于该体系中没有供OGG1 特异识别切除的oxoG,当加入OGG1 后,不会引起荧光信号的增强,进一步验证了实验原理是合理的。

图3 不同条件下FAM-DNA2的荧光光谱Fig.3 Fluorescent spectra of FAM-DNA2 in different conditions a:5 mmol/L FAM-DNA2;b:a+5 mmol/L c-DNA;c:b+60 U/mL OGG1
2.3 实验条件的优化
2.3.1 培育温度的优化 由于酶的活性与温度有密切关系,温度太低会使酶不能发挥最佳性能,温度过高会使酶失去活性。为得到最佳的培育温度,考察了加入酶后反应体系温度对荧光信号的影响。图4 为加入OGG1后不同温度时体系荧光强度的变化图。由图4 可知,当反应温度在30 ~35 ℃时,体系的荧光强度变化不明显,当温度达40 ℃时,体系的荧光强度变化明显增大,且继续升温时体系的荧光信号略有增加但变化不明显。考虑到实验效率,选择培育温度为40 ℃。

图4 不同培育温度对反应体系荧光强度的影响Fig.4 Effects of different incubation temperature on fluorescence intensity of the reaction system FAM/dsDNA1:5µmol/L;OGG1:40 U/mL
2.3.2 剪切时间的优化 剪切时间是一个非常重要的因素,影响着方法的灵敏度。考察了FAM/dsDNA1 体系与OGG1充分作用所需的时间。图5显示了酶剪切时间对体系荧光强度的影响。结果显示,在30 ~180 min 范围内,随着反应时间的延长,荧光强度差值不断增加,当达到150 min 后,变化趋于平缓,ΔF达到一个平台值,说明此时剪切反应已趋于完全。因此,实验选择最佳反应时间为150 min。
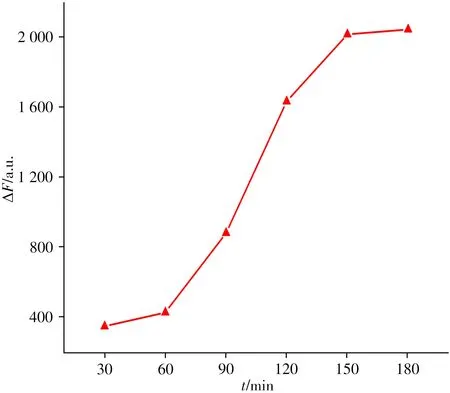
图5 加入OGG1后剪切时间对体系荧光强度的影响Fig.5 Effect of shear time on fluorescence intensity of the reaction system after addition of OGG1 FAM/dsDNA1:5µmol/L;OGG1:40 U/mL
2.4 线性范围与检出限
在优化的实验条件下,对方法灵敏度进行了评估。如上所述,当向FAM/dsDNA1 体系中加入OGG1 前后,体系的荧光强度发生改变,通过荧光强度的变化值实现对OGG1 的活性检测。向FAM/dsDNA1 体系中加入不同浓度OGG1,对荧光信号进行测定(如图6)。图6A 显示,随着OGG1 浓度从2 U/mL 增至1 000 U/mL,体系的荧光强度逐渐增强,表明OGG1 浓度越高,越多的FAM/dsDNA1 中的oxoG 受损碱基被切除,释放越多带FAM 信号的DNA片段,荧光增强变化越显著,说明荧光信号的增强高度依赖OGG1 的浓度。由图6B 可知,OGG1 的浓度(C,U/mL)在0 ~60 U/mL 范围内与体系荧光强度的变化值(ΔF)呈良好的线性关系,线性方程为:ΔF=21.672 5C+6.982 0,相关系数(r2)为0.993 2。根据3σ规则计算得到OGG1的检出限为0.7 U/mL。
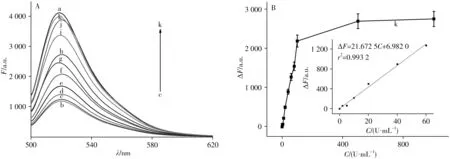
图6 FAM/dsDNA1体系与不同浓度OGG1作用的荧光光谱(A),FAM/dsDNA1体系中加入不同浓度OGG1的线性曲线(B)Fig.6 Fluorescent spectra of FAM/dsDNA1 reaction system with different concentrations of OGG1(A),and linear curves of concentrations of OGG1 versus fluorescence intensity changes of FAM/dsDNA1 reaction systems(B)a:5µmol/L FAM-DNA1;b:a+5µmol/L c-DNA;OGG1(c-k):2,10,20,40,60,80,100,500,1 000 U/mL
2.5 选择性
选择性是衡量检测方法优劣的重要指标,实验考察了其他蛋白质对FAM/dsDNA1 荧光信号的影响。以UDG酶和RNase A 作为干扰酶,将UDG酶、RNase A 和OGG1分别加入到FAM/dsDNA1 反应体系中,在FAM/dsDNA1为5 µmol/L,RNase A 为100 µg/mL,UDG 为100 U/mL,OGG1为40 U/mL条件下,检测相应的荧光强度变化。
结果显示,RNase A 和UDG 体系的荧光信号变化(ΔF)很小,而在OGG1 存在情况下,荧光强度变化很大,说明本方法可以高特异性地区分OGG1 与其他干扰蛋白,对OGG1检测有较好的选择性,在生物医学应用中具有很大的潜力。
2.6 抑制剂分析
Cd2+对许多酶存在抑制作用,常被选作酶抑制剂分析模型[13]。为研究OGG1抑制剂对OGG1酶活性的影响,选择硝酸镉Cd(NO3)2为抑制剂模型。OGG1的活性位点是通过Zn2+结合位点形成[14],而Cd2+能够占据该活性位点使得OGG1 活性被抑制[15]。在FAM/dsDNA1 为5 µmol/L,OGG1 为60 U/mL 条件下,将5、10、20、30、50、80µmol/L的Cd2+与OGG1在40 ℃下培育20 min,然后加入到FAM/dsDNA1体系进行荧光强度检测。
基于公式(1)确定OGG1 被抑制的相对活性(RA)。根据RA与Cd2+浓度拟合的曲线确定最大半抑制浓度(IC50)。
RA=(Fi-F0)/(FCd-F0) (1)
其中,Fi为不存在Cd2+时的荧光强度;FCd为存在Cd2+时的荧光强度。结果表明,当Cd2+浓度从0 增至80µmol/L 时,OGG1的相对活性逐渐降低。根据拟合曲线确定在60 U/mL OGG1体系中,Cd2+抑制作用的IC50为22.26µmol/L。说明本方法可用于对OGG1酶活性的抑制作用研究。
2.7 血清样品中OGG1活性分析
采用本方法检测了正常人血清中OGG1的浓度。将血液样品在3 000 r/min下离心5 min,上层淡黄色液体即为待测的血清样品,-4 ℃冷藏备用。采用标准加入法,将不同浓度的OGG1加入正常人血清样品中,测定OGG1 的回收率。结果如表2 所示,OGG1 的回收率为99.1%~105%,相对标准偏差(RSD)为1.0%~4.3%。表明本方法可用于实际样品中OGG1的定量分析,在临床诊断中具有很大的应用潜力。
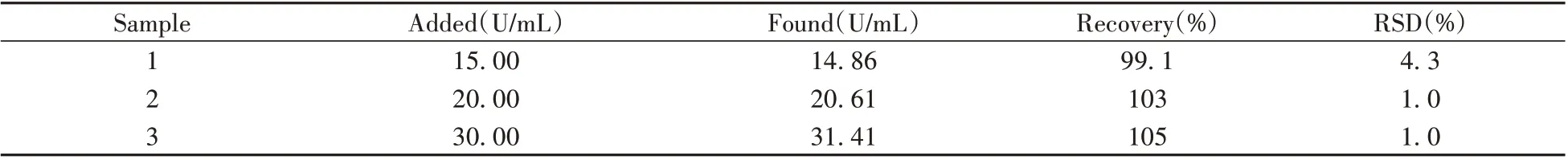
表2 人血清样品添加OGG1的回收率与相对标准偏差Table 2 Recoveries and relative standard deviations of human serum samples added OGG1
3 结 论
本文基于脱氧鸟苷G 碱基的猝灭,设计了一种简单、灵敏的荧光方法用于DNA 糖基化酶OGG1 的检测。该方法具有明显的优势:探针设计简单,避免探针的复杂合成;其识别响应原理是高效的PET机制,且利用鸟嘌呤天然高效的荧光猝灭能力,无需使用有机染料分子标记的DNA 或额外的纳米材料作为猝灭剂,简化了实验步骤,节约了实验成本。方法不仅能提高OGG1 活性的分析效率,而且可为DNA损伤相关修复酶的检测提供简便、通用的传感平台,有望实现对肿瘤细胞中OGG1活性的检测。
