检测SARS-CoV-2的电化学生物传感器研究进展
2022-07-22窦雪晨杜耀华
窦雪晨,王 冠,张 宁,程 智,杜耀华,田 丰
(军事科学院系统工程研究院 卫勤保障技术研究所,天津 300161)
严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)是一种新发现的人类冠状病毒,是引起新型冠状病毒肺炎(COVID-19)的主要病原体。起始于2019年年末、至今未完全遏制的COVID-19的全球大流行,导致了世界范围内极高的发病率和严重的死亡率[1-4],造成了生活、交通、经济、医疗等多方面的严重问题。COVID-19的潜伏时间长、传播速度快且存在40%~45%的无症状感染[5],而无症状感染者的未知传播途径和传播能力给疾病的预防和控制带来了众多监管难题。与此同时,SARS-CoV-2的ORF1(Open reading frame 1)还存在多个变异位点[6]。随着时间的推移,目前已知SARS-CoV-2病毒已有阿尔法变体、德尔塔(Delta)变异毒株等[7-8]。因此,快速、准确的大规模筛查是遏制病毒传播的最有效手段之一。
目前,可用于诊断COVID-19的方法包括实时逆转录聚合酶链式反应(RT-PCR)、抗原检测和血清学检测等。迄今为止,RT-PCR 仍被认为是诊断COVID-19的金标准[9]。然而,RT-PCR 检测时首先需对病毒进行核酸提取及RNA 的体外指数扩增,存在前处理步骤烦琐、检测时间长,需要高精尖设备及专业素养高的操作人员等缺点,不适用于现场的快速诊断。电化学生物传感器因灵敏、便携、稳健性高、小型化、成本低等优点被认为是临床诊断中实时监测新冠肺炎的最强大的替代工具之一[10-11],而其检测时间短(可在数分钟内获得现场检测人员的阳性/阴性结果)的优势还可用于开发COVID-19的即时检验(Point-of-care testing,POCT)设备。本文以可特异性检测SARS-CoV-2 的刺突蛋白(Spike protein)、核衣壳蛋白(Nucleocapsid protein)和病毒核糖核酸(RNA)3个生物标志物为切入点,综述了基于抗原和遗传物质检测SARS-CoV-2 的电化学生物传感器研究进展,旨在为设计现场快速诊断COVID-19的设备提供有力支撑。
1 基于刺突蛋白诊断COVID-19的电化学生物传感器
SARS-CoV-2由刺突蛋白、核衣壳蛋白、包膜蛋白和膜蛋白4种结构蛋白组成[12-13]。其中,刺突蛋白是一种可用于诊断COVID-19 的靶标蛋白,具有高度免疫原性以及受体结合域(Receptor binding domain,RBD),因此将SARS-CoV-2的刺突蛋白用于诊断COVID-19以及研制疫苗和相关治疗药物等方面具有重要意义[14]。基于此,大量学者以检测刺突蛋白为目标,设计了多种可检测SARS-CoV-2的电化学生物传感器。
Seo 等[12]基 于 场 效 应 晶 体 管(Field-effect transistor,FET)设计了一种可用于临床样本检测SARS-CoV-2 以实现COVID-19 诊断的电化学生物传感器。通过在FET 的石墨烯电极片上用1-芘丁酸N-羟基琥珀酰亚胺酯(PBASE)进行修饰,并将其作为界面偶联剂固定SARS-CoV-2 刺突蛋白特异性抗体(如图1A)后,用磷酸盐缓冲盐水(PBS,pH 7.4)完全覆盖FET 作为电解质,基于管道的表面的电位变化和对电响应影响实现SARS-CoV-2 的临床样本检测,得到其检出限为2.42 × 102copies/mL。基于FET 的电化学生物传感器具有成本低、灵敏度高、动态响应范围广等优势,为临床检测SARS-CoV-2、诊断COVID-19 提供了一种无需对样品进行预处理或标记的高灵敏免疫学诊断方法。Vadlamani 等[14]设计了一种低成本、高灵敏度的二氧化钛纳米管(Co-TNTs)电化学生物传感器:通过一步电化学阳极氧化方法合成TNTs,采用离子交换对TNTs平台进行钴功能化后,将其连接到恒电位仪上进行数据采集,并采用电流法检测刺突蛋白表面的RBD快速检测SARS-CoV-2以诊断COVID-19。基于Co-TNTs的电化学生物传感器在较低病毒蛋白载量范围内可特异性检测SARS-CoV-2 刺突蛋白RBD,并在检测浓度范围内表现出线性响应。此传感器的最大优势在于检测速度快,约30 s 即可高效检测SARS-CoV-2 刺突蛋白RBD。未来,可将其用于开发一款快速诊断口鼻分泌物中是否存在SARS-CoV-2 的即时诊断设备。Fabiani 等[15]基于磁珠的电化学检测方法和炭黑基的丝网印刷电极设计了一种可同时对唾液中SARS-CoV-2 刺突蛋白和核衣壳蛋白进行检测的高灵敏度电化学生物传感器(如图1B)。该传感器以PalmSens便携式恒电位仪作为读数计,在30 min 内通过伏安曲线检测到未进行处理的唾液样本中的刺突蛋白和核衣壳蛋白,检出限分别为19 ng/mL和8 ng/mL。将该传感器与实时定量PCR检测同一样本的数据进行对比,发现数据一致性较好且检测速度更快。Lima等[16]利用半胱胺稳定的AuNPs 改性石墨铅笔芯和塑料瓶,以血管紧张素转换酶2(Angiotensin-converting enzyme 2,ACE2)作为识别元件,设计了一种快速、低成本、高便携度的可检测SARS-CoV-2刺突蛋白的电化学生物传感器。在塑料瓶中将50µL含有刺突蛋白的PBS加入石墨电极中孵育5 min,随后加入1 mL 自制的氧化还原探针溶液并检测刺突蛋白与电化学生物传感器结合后的电流抑制情况。该传感器可在6.5 min 内诊断疑似患者是否感染COVID-19,且对SARSCoV-2刺突蛋白的检出限为229 fg/mL,测试费仅需1.5 美元。
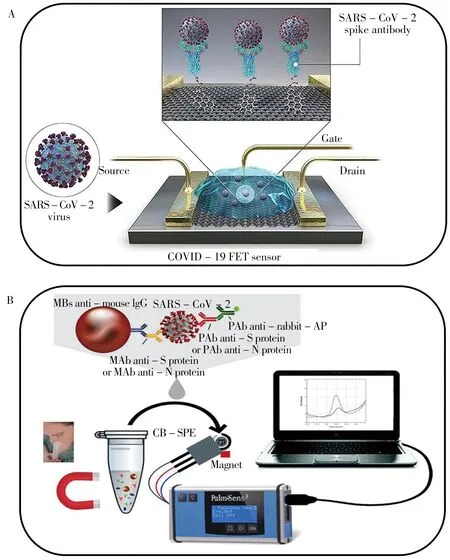
图1 基于刺突蛋白检测SARS-CoV-2的电化学传感器Fig.1 Electrochemical sensor based on SARS-CoV-2 detection with spike protein A. FET-based electrochemical biosensor for COVID-19(基于FET的COVID-19电化学生物传感器)[12];B. carbon black-based electrochemical sensor with screen-printed electrodes for detection of SARS-CoV-2(基于炭黑基的丝网印刷电极电化学传感器检测SARS-CoV-2)[15]
此外,还有一些其他基于SARS-CoV-2刺突蛋白检测以诊断COVID-19的电化学传感器。如Liv等[17]利用牛血清蛋白、SARS-CoV-2刺突蛋白抗体和功能化氧化石墨烯修饰玻碳电极(BSA/AB/f-GO/GCE)或丝网印刷电极(BSA/AB/f-GO/SPE)组成电化学生物传感器,通过抗原-抗体之间的相互作用,利用伏安法测定SARS-CoV-2刺突蛋白;Zaccariotto等[18]设计了一种利用还原的氧化石墨烯修饰玻碳电极的电化学生物传感器,通过电化学阻抗谱和循环伏安法成功检测了唾液样本中SARS-CoV-2刺突蛋白RBD;Guo等[19]利用特制的纳米有机电化学晶体管,根据检测过程中的电流变化,成功检测了不同病毒载量的未经处理的临床鼻咽拭子和唾液样本中的SARS-CoV-2刺突蛋白;Yousefi等[20]将特异性抗体固定在包含还原探针的双链DNA上,采用计时电流法,根据传感器结合刺突蛋白前后的表面流体力学变化实现了SARS-CoV-2的检测,检测时间在5 min 内;El-Said 等[21]使用高度均匀的Au微立方体作为微电极,以抗SARS-CoV-2刺突蛋白抗体为探针,基于循环伏安法和方波伏安法对SARS-CoV-2刺突蛋白进行检测,得到检测范围为100 pmol/L ~5 nmol/L,检出限为276 fmol/L;Zhang 等[22]利用自制的二聚体DNA 适体DSA1N5设计了一种简单快速的基于唾液的SARS-CoV-2抗原检测的电化学传感器,用于识别野生型病毒及其Alpha和Delta变体的刺突蛋白;Idili等[23]利用电化学适配体设计了一种快速、无试剂、可定量检测SARS-CoV-2刺突蛋白的传感器,可在15 s内检测到目标蛋白,且能区分类目标蛋白与其他干扰蛋白。表1总结了近3年基于刺突蛋白检测SARS-CoV-2的电化学传感器,这些成果为后续设计基于SARS-CoV-2刺突蛋白诊断COVID-19的便携式设备提了供研究基础及理论依据。

表1 基于刺突蛋白检测SARS-CoV-2的电化学传感器Table 1 Electrochemical sensor based on SARS-CoV-2 detection with spike protein
由于刺突蛋白位于SARS-CoV-2 病毒的表面,因此采用电化学生物传感器无需进行前处理即可实现刺突蛋白的检测,且具有操作简便、检测速度快等优势。目前基于刺突蛋白诊断COVID-19 的电化学生物传感器研究已有很多报道[24-33],但仅针对刺突蛋白进行SARS-CoV-2 检测以诊断COVID-19还存在不确定性,可能产生假阳/阴性结果。例如,刺突蛋白存在多个变异位点,随着时间的推移会根据地理位置等相关条件的变化产生变异[34-35],如已知的德尔塔变异病毒株。而基于刺突蛋白检测SARS-CoV-2 的电化学生物传感器一般是检测刺突蛋白的固定片段,若刺突蛋白的相关片段发生变异,则极有可能造成检测的假阳/阴性结果,这对于目前变异毒株的即时快速检测是一大阻碍。
2 基于核衣壳蛋白检测SARS-CoV-2的电化学生物传感器
相较于刺突蛋白,核衣壳蛋白更加稳定,随时间推移突变较少[36-40],且核衣壳蛋白在COVID-19患者感染期间会大量表达[41],从而在COVID-19患者血清中可检测到较高浓度的核衣壳蛋白的免疫球蛋白(Immunoglobulin G,IgG)抗体。同时,已有学者的研究证明了核衣壳蛋白对SARS-CoV-2 病毒的整个生命周期至关重要[42]。因此,通过检测核衣壳蛋白诊断COVID-19是一条可行之路。
Raziq 等[43]利用具有合成分子识别功能的分子印迹聚合物(MIP)构建核衣壳蛋白-MIP 识别原件并以其修饰Au 薄膜电极,设计了一种可检测SARS-CoV-2 核衣壳蛋白的电化学生物传感器(如图2A)。该传感器可由平板计算机或智能手机中的软件连接便携式恒电位仪,通过氧化还原探针测量核衣壳蛋白-MIP 元件到Au 薄膜电极的电荷转移强度,从而得到与病毒蛋白浓度相关的电流大小。结果表明,该传感器不仅与SARS-CoV-2核衣壳蛋白浓度在2.22 ~111 fmol/L范围内呈良好的线性关系,检出限低至15 fmol/L,还可以通过MIP 区分SARS-CoV-2 核衣壳蛋白和干扰蛋白(BSA、CD48、E2 HCV等),获得良好的特异性。Tian等[44]通过修饰Au@Pt纳米粒子和酶的金属-有机骨架MIL-53,设计了一种检测SARS-CoV-2 核衣壳蛋白的双适配体电化学生物传感器。通过将2 个巯基修饰的不同核酸适配体固定在电极表面捕获SARS-CoV-2 核衣壳蛋白,再通过修饰Au@Pt/MIL-53 材料构成适配体-蛋白质-纳米探针的免疫夹心体系。研究结果显示,传感器对SARS-CoV-2 核衣壳蛋白的线性范围为0.025 ~50 ng/mL,检出限为8.33 pg/mL。Eissa等[45]将SARS-CoV-2核衣壳蛋白固定在碳纳米纤维修饰的丝网印刷电极上,设计了一种可检测SARS-CoV-2 的电化学生物传感器(如图2B)。该传感器利用方波伏安法,通过在检测溶液中加入固定数量的核衣壳蛋白抗体确定所含核衣壳蛋白的浓度,检出限为0.8 pg/mL。该传感器具有无需样本转移和预处理,即可直接快速检测的优势,且不与人乳头状瘤病毒等其他病毒的抗原发生交叉反应,具有一定的选择性。Li等[46]采用辣根过氧化物酶和目标抗体双重标记的磁珠进行免疫磁性富集和信号放大策略,利用丝网印刷金电极电化学传感器,根据电流响应成功地检测了SARS-CoV-2 核衣壳蛋白。该传感器可在55 min 内检测到全血中的目标蛋白,检出限为50 pg/mL;可在30 min 内于5 倍稀释血清中检测到目标蛋白,检出限为10 pg/mL,具有便携性高、操作简单、灵敏度高等优势。Eissa 等[47]使用11-巯基十一烷酸对纳米金修饰的丝网印刷电极进行功能化,并将抗SARS-CoV-2 核衣壳抗体附在电极上,通过方波伏安法检测还原峰电流的变化,以无标记形式实现了SARS-COV-2核衣壳蛋白的检测。该传感器的线性范围为1.0 pg/mL ~100 ng/mL,在磷酸盐缓冲液溶液中的检出限为0.4 pg/mL,具有小型化、成本低、快速响应等优势,且对SARSCoV-2 具有高度选择性。与此同时,聚焦于核衣壳蛋白检测诊断COVID-9 的电化学传感器研究还有很多[48-50]。如Torrente-Rodríguez 等[48]利用可批量生产的激光雕刻石墨烯电极设计了一种超灵敏、低成本、多路复用的电化学传感器,不仅可检测SARS-CoV-2病毒抗原核衣壳蛋白、IgM 和IgG 抗体以及炎症生物标志物C 反应蛋白等多种评估COVID-19 的生物标志物,还具有检测速度快、选择性高等优势;Torres 等[49]构建了一种由血管紧张素转换酶2 修饰的微型生物传感器并将其命名为RAPID 1.0,可在4 min 内通过测量电化学阻抗谱的变化实现对鼻咽/口咽拭子和唾液样本中核衣壳蛋白的检测,具有高的特异性、敏感性和准确性;Singh等[50]设计了一种基于适配体的电化学葡萄糖传感器,可利用市面现有的血糖仪检测SARS-CoV-2病毒的核衣壳蛋白或刺突蛋白,且蛋白浓度与血糖浓度成正比,具有成本低、设备易于获取且无需额外投入等优势。表2总结了近3年基于核衣壳蛋白诊断COVID-19 的电化学传感器研究工作[15,43-47,49-52]。
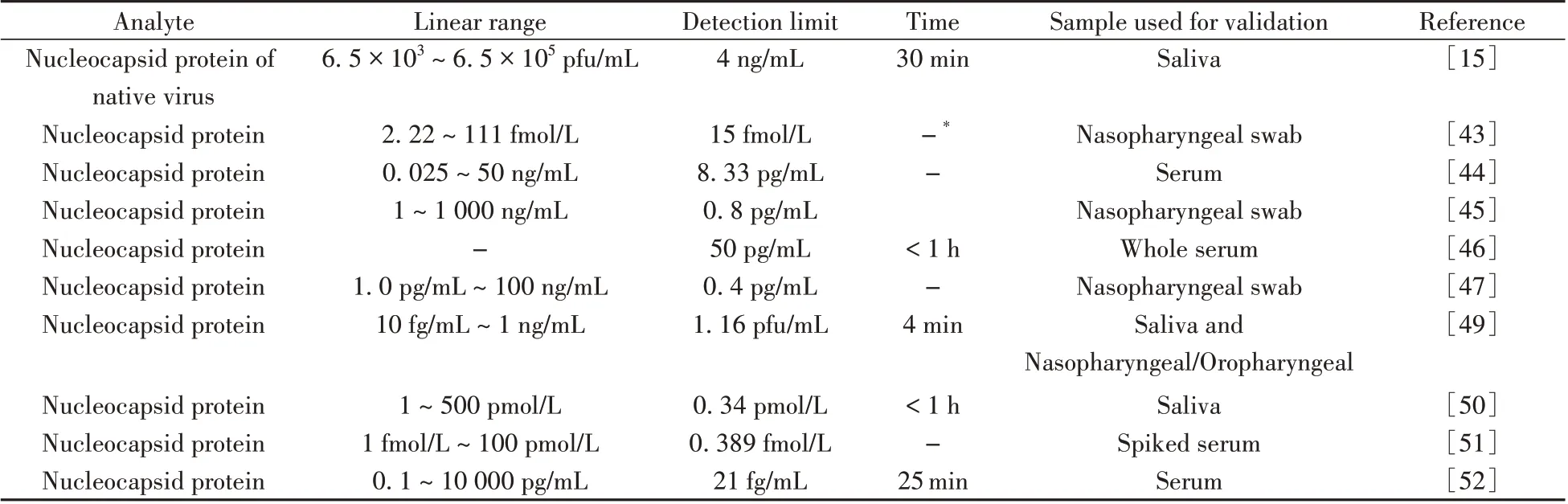
表2 基于核衣壳蛋白检测SARS-CoV-2的电化学传感器Table 2 Electrochemical sensor based on SARS-CoV-2 detection with nuclear capsid proteins

图2 基于核衣壳蛋白的电化学传感器Fig.2 Electrochemical sensors based on the nucleocapsid proteins A. COVID-19 diagnostics principle by nucleocapsid protein sensor analyzing the samples prepared from nasopharyngeal swab specimens of patients(利用核衣壳蛋白传感器诊断COVID-19患者鼻咽拭子标本)[43];B. detection principle diagram of dual aptamer electrochemical biosensor(双适配体电化学生物传感器检测原理图)[45]
与基于刺突蛋白的电化学传感器研究相比,基于核衣壳蛋白的电化学传感器研究较少,这可能与核衣壳蛋白所处位置有关。核衣壳蛋白是SARS-CoV-2 病毒内部的结构蛋白,部分电化学生物传感器在检测前需将SARS-CoV-2 病毒裂解,从而释放其内部的核衣壳蛋白。相较于对SARS-CoV-2的RNA进行检测,基于核衣壳蛋白检测以诊断COVID-19的电化学生物传感器在操作便捷性、试剂成本及检测成本、操作人员专业技能要求、检测时间等方面仍具有相当优势。未来,基于核衣壳蛋白检测的电化学生物传感器可专注于开发快速即时诊断COVID-19的检测设备,以应对现场大规模快速筛查和及早诊断。
3 基于RNA检测SARS-CoV-2的电化学生物传感器
基于RNA的RT-PCR检测是直接对SARS-CoV-2病毒的RNA进行检测,因此该技术被公认为是诊断COVID-19的金标准,且检测灵敏度高,检出限可优化至3.9 copies[53]。但RNA 检测需特有的、昂贵的检验设备,样本采样后须转运至专门的实验室。若在转运或操作过程中存在失误,则可能造成样本的假阳/阴性结果。因此,部分学者研究了基于RNA 检测诊断COVID-19 的可便携电化学生物传感器。
Alafeef等[54]利用石墨烯和金纳米粒子设计了一种超灵敏电化学生物传感器(如图3A),其中金电极利用疏基修饰的反义寡核苷酸进行修饰,在未进行核酸扩增的情况下,通过监测石墨烯表面电荷和电子迁移率的变化可在5 min内快速、准确、高选择性和超灵敏地检测到SARS-CoV-2 RNA,检出限为6.9 copies/µL。与其他研究成果相比[12-14,55-62],该传感器不仅提高了灵敏度,加快了响应速度,还降低了RNA 检测的成本。Peng 等[63]利用离子的静电吸附作用可显著放大电化学信号的原理设计催化发夹组装的信号放大策略,设计了一种灵敏检测SARS-CoV-2 RNA 的电化学生物传感器,其检测原理如图3B。将传感器用于感染患者的血清、唾液和咽喉样本中SARS-CoV-2 RNA 的检测,得到检出限为26 fmol/L。方法避免了繁琐的实验步骤和复杂的探针修改,增强检测信号的同时也提升了传感器的抗干扰能力。Zhao 等[64]利用杯芳烃功能化氧化石墨烯设计了一种靶向SARS-CoV-2 RNA 的超灵敏电化学生物传感器。通过预制混合液A 和B对病毒的RNA 进行提取,随后用传感器进行检测并将其与智能手机关联,基于超夹心识别策略通过电化学信号峰的变化确认靶标是否存在(靶标存在时,电化学信号峰高;无靶标时,电化学信号峰弱)。该传感器检测无需大型设备和专业操作人员,也无需核酸扩增和逆转录等步骤,且具有高度特异性和选择性,对临床样本的检出限为200 copies/mL。但其操作步骤增加,检测时长超过3 h,使之在快速检测方面仍有不足。
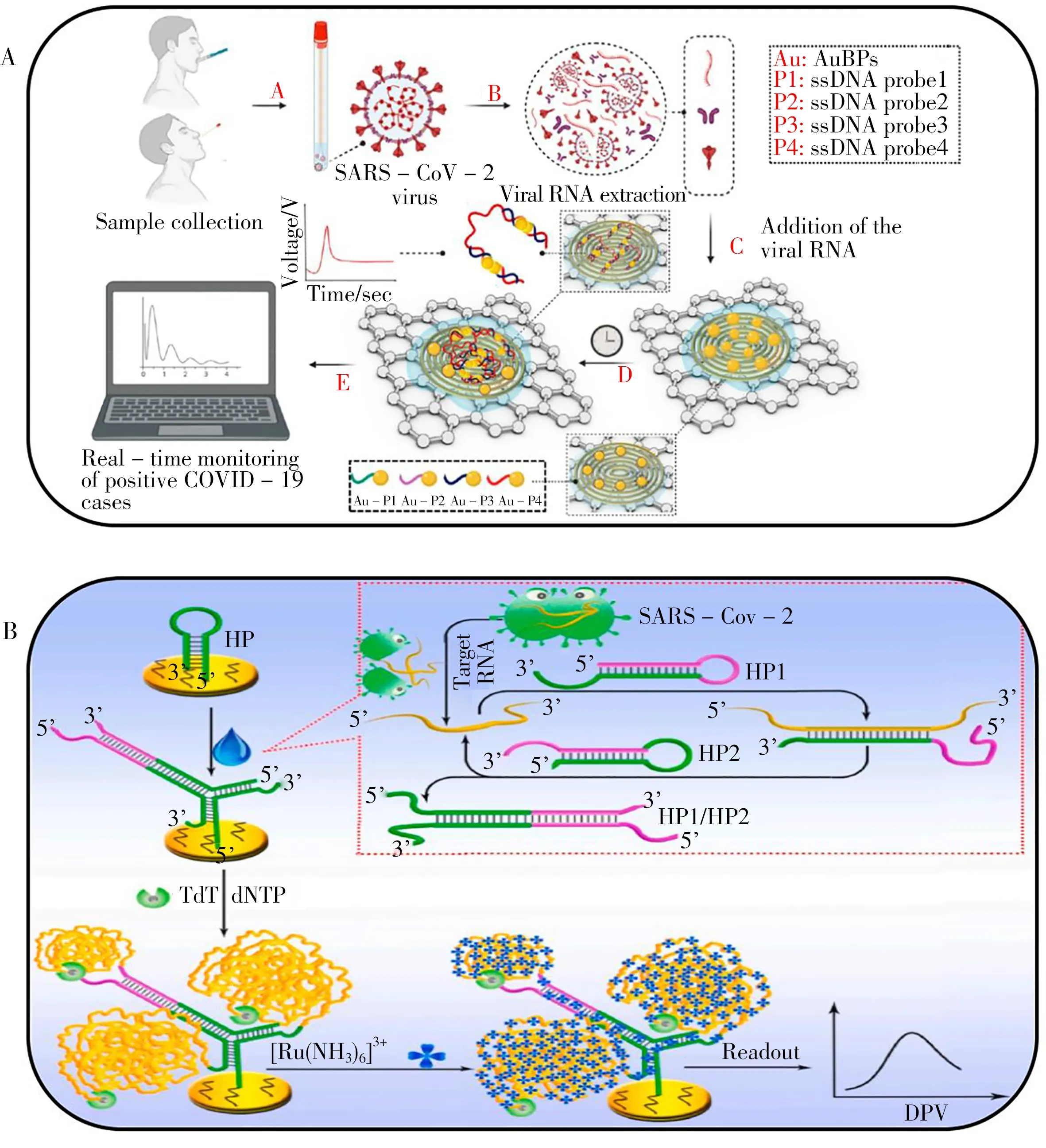
图3 基于RNA检测的电化学生物传感器Fig.3 Electrochemical biosensor based on RNA detection A. schematic diagram of ultra-sensitive electrochemical biosensor detection(超灵敏电化学生物传感器检测原理图)[54];B. principle of the proposed electrochemical biosensor for sensitive analysis of SARS-CoV-2 RNA(SARS-CoV-2RNA灵敏分析的电化学生物传感器的原理)[63]
目前,基于RNA 检测SARS-CoV-2的电化学生物传感器发展如火如荼,但受限于未对RNA 进行扩增等前处理,此类传感器或灵敏度不理想,或对传感器电极和表面修饰过于复杂。因此,如何在不进行RNA 扩增,以及表面修饰步骤简单的前提下提高灵敏度是目前此类电化学生物传感器亟需解决的问题。
表3 总结了部分基于刺突蛋白、核衣壳蛋白和RNA 检测SARS-CoV-2 的电化学生物传感器的构建方法及参数,可看出3 种类型电化学传感器检测SARS-CoV-2 的检出限范围跨度很大,部分电化学传感器的灵敏度完全可媲美RT-PCR 的RNA 检测,且缩短了检测时间。因此,电化学传感器更适用于现场快速筛选潜伏期患者,尤其是基于刺突蛋白的电化学传感器,因其位于病毒表面,更易于检测。而基于核衣壳蛋白和RNA 的电化学传感器可对疑似患者进行二次现场快速筛选,以辅助诊断COVID-19患者。
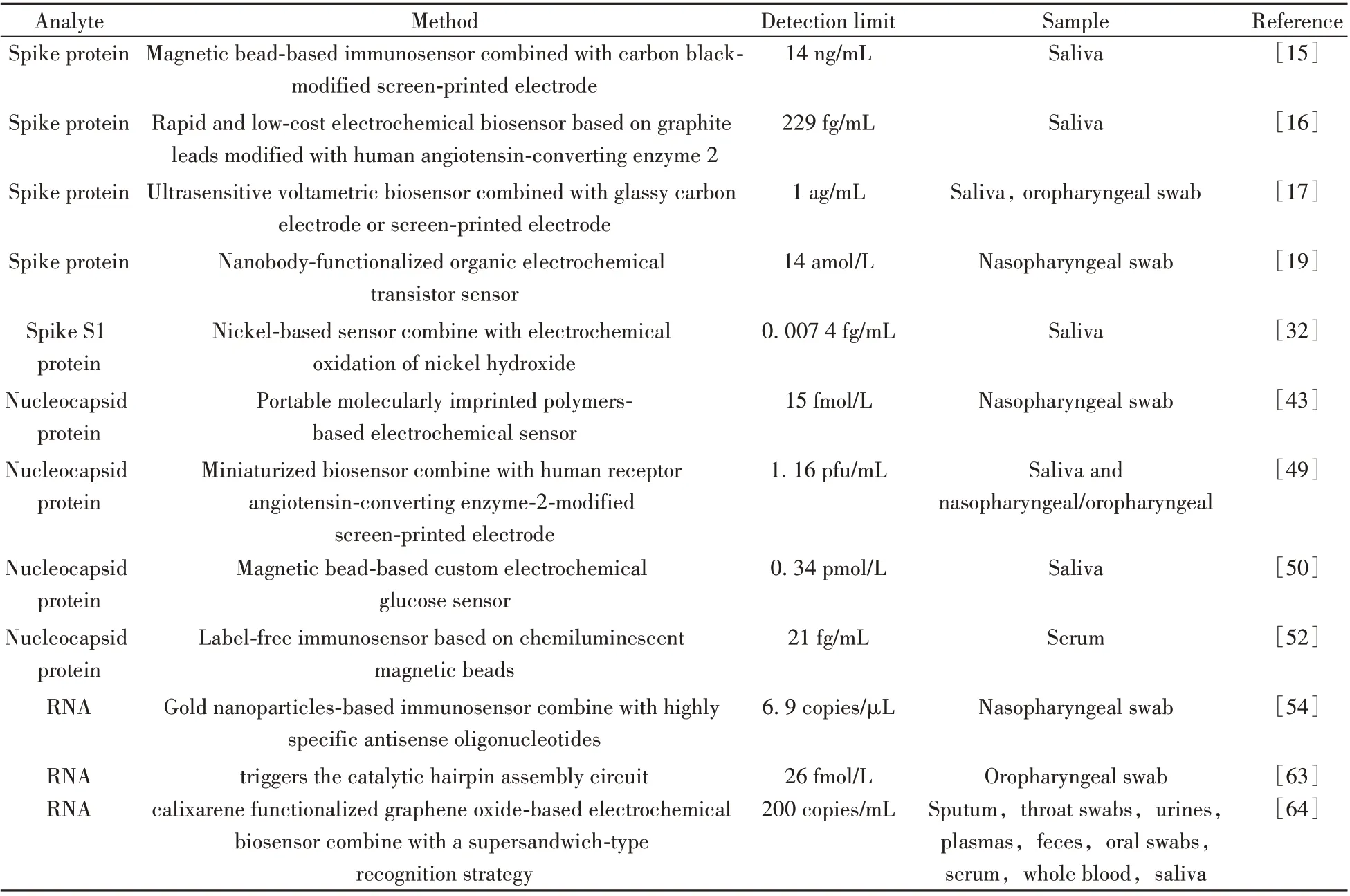
表3 基于RNA检测SARS-CoV-2的电化学传感器Table 3 Electrochemical biosensors for detecting SARS-CoV-2 based on RNA
4 与其他方法的比较
目前,还有一些检测SARS-CoV-2的其他生物传感器方法[65-73],如基于荧光检测的生物传感器、基于抗体检测的电化学传感器等。Kim 等[66]结合重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)技术设计了一种可快速检测SARS-CoV-2的电化学生物传感器,通过脉冲伏安法可检出多个靶基因;Yakoh 等[67]基于横向流动测定设计了一种无标记的纸基电化学传感器,可用于SARS-CoV-2 抗体的检测;Gao 等[68]基于AuNPs 提出了一种比色/表面增强拉曼散射/荧光三模式生物传感器,可在40 min内快速选择性检测病毒的RNA。表4总结了近年电化学传感器和RT-PCR 等检测SARS-CoV-2方法的参数和性能对比,可看出RNA的检测用时普遍高于电化学传感器,且需要复杂、昂贵的专用设备。
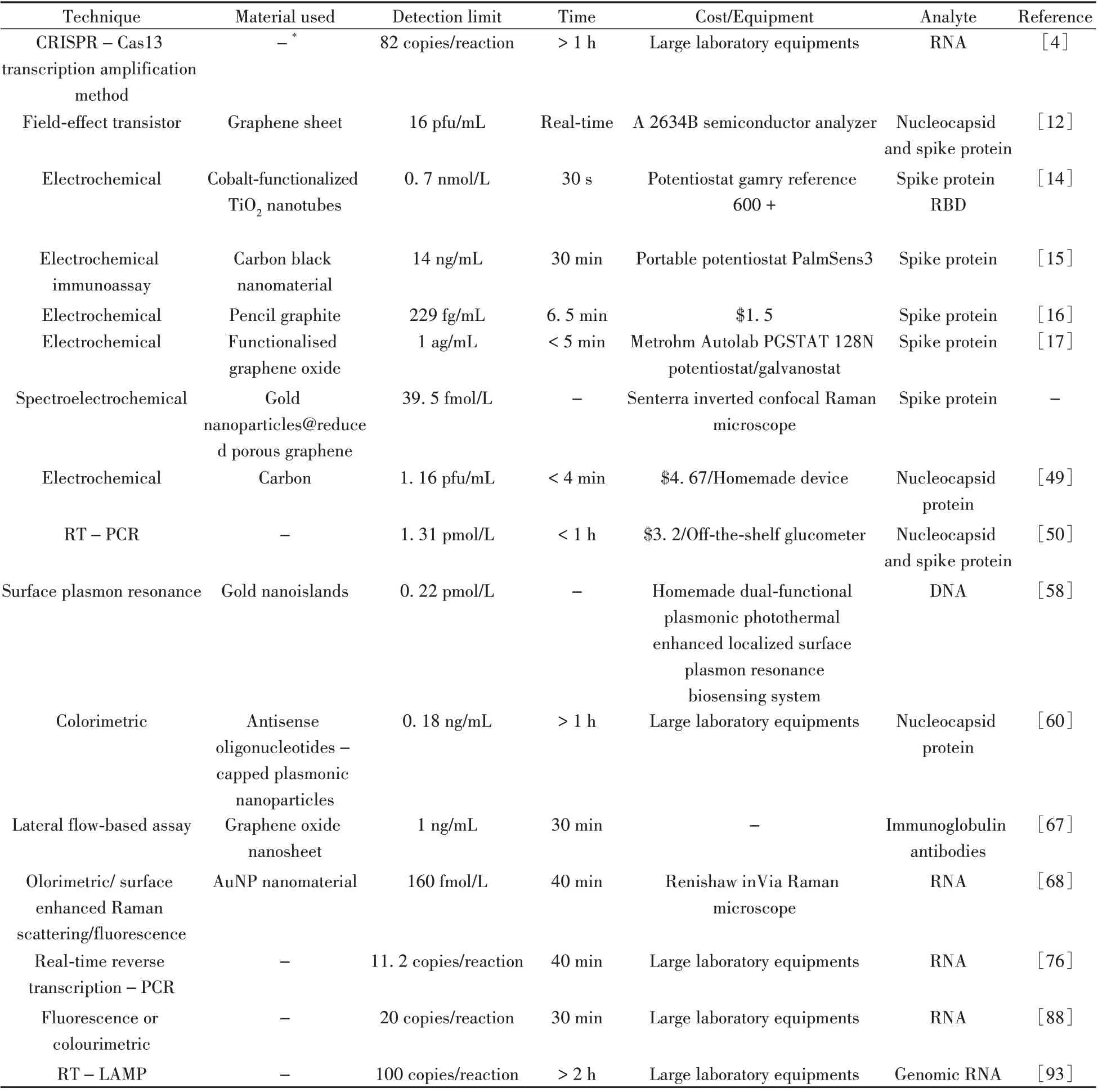
表4 电化学法与常规SARS-CoV-2 检测方法的比较Table 4 Comparison of electrochemical and conventional SARS-CoV-2 detection methods
经典的RT-PCR 法通过提取RNA 进行COVID-19 检测,并凭借其高度敏感性和特异性成为诊断金标准,其检测时长虽已减至约2 h[74-78],但仍存在专业检测设备昂贵、对人员专业技能要求高、检测时间长等不足,且引物探针的设计对识别唯一靶序列的准确性至关重要[79-80]。为进一步缩短分析时长并降低检测要求,大量学者在减少核酸扩增时间方面进行了相关研究[81-95]。如Vincent 等[96]提出利用快速循环光纤和反馈控制的激光加热缩短PCR 的加热周期,Xu 等[97]利用逆转录PCR 环介导的等温扩增(Reverse transcription PCR-LAMP,RT-LAMP)技术减少分析周期。但目前仍很少有核酸扩增实验被授权用于即时检测[98]。
5 总结与展望
本文综述了基于抗原和遗传物质RNA 检测的电化学生物传感器,此类传感器通过直接测定SARS-CoV-2 对感染COVID-19 的患者进行无创检测。无论是确诊患者,还是潜伏期患者,只要感染了SARS-CoV-2 病毒,基于抗原和遗传物质RNA 检测的电化学生物传感器即可对其进行相关检测以辅助COVID-19诊断。此外,电化学生物传感器因具有响应速度快、前处理步骤简单、成本低等优势,被广泛用于便携式、小型分析设备的研发,但将其用于商业化应用仍不成熟。例如,大部分电化学生物传感器在检测时均为恒定的实验室条件,当外界物理条件改变时,部分电化学生物传感器的性质会发生一定变化,稳定性欠佳;同时,如何保证基于刺突蛋白、核衣壳蛋白等检测的电化学生物传感器在非洁净环境中其微小结构不受污染、不影响检测结果也是亟需解决的问题。此外,由于临床样本的复杂性,电化学生物传感器的检测灵敏度相较于标准品(PBS 环境)有显著差异。因此,对电化学生物传感器进行评价时还应考虑临床样本感染等多种情况。
与作为金标准的RT-PCR 检测方法相比,用于检测SARS-CoV-2 的电化学生物传感器主要以快速、便携、低成本等为目的,少有对样本的前处理步骤,导致大多电化学生物传感器存在检测灵敏度不高或稳定性欠佳的不足,尤其是在病毒载量极低时无法正常检出[99-100]。
未来,期望可以通过优化检测电极材料及反应条件、修饰检测探针等,以及与其他免疫检测方法(如侧向流免疫层析、胶体金、免疫荧光等)进行多学科的交叉融合[101-105],以研发可快速、准确检测SARS-CoV-2 病毒的成熟电化学生物传感器,并将其商业化,从而对COVID-19 患者做到早发现、早隔离、早治疗,尽早阻断SARS-CoV-2病毒的传播。
