结合营养风险筛查的术前营养补充对原发性肝癌术后并发症的影响
2022-07-21李建芳
李建芳,李 杰
(郑州市第一人民医院外科,河南 郑州 450004)
原发性肝癌是我国常见的恶性肿瘤之一,流行于东南沿海地区,好发于40~50岁,男性发病率高于女性,发病率居我国全部恶性肿瘤的第3位,死亡率居第2位[1-3]。手术切除病灶是早期肝癌最有效的治疗手段,早期肝癌根治术的5 a生存率可达到69.0%~86.2%[4]。但是手术会造成一定程度的创伤,患者术后机体应激反应剧烈,各脏器均有不同程度的受累。术后患者白蛋白合成水平下降,营养素摄入显著降低,造成患者的免疫功能、抗感染能力下降,组织再生修复能力减弱,从而导致患者术后恢复缓慢,并发症发生风险增加,甚至有可能影响患者的后续治疗[5-6]。
由于肝癌为慢性消耗性疾病,营养不良反应率高[2]。营养状况较差的肿瘤患者术后伤口愈合能力差,院内感染发生率高,并发症多,住院时间延长,医疗费用增加。但是目前临床医师及患者对肝癌术前营养风险筛查的重要性认识不足,未采取有效的营养干预方式,从而影响患者的预后。
肝癌患者的术后营养支持治疗研究较多[7-12],但是对术前患者个体化营养补充的研究较少。患者术前接受的常规营养补充方案缺少针对特定患者的个体化评价方式,对患者的营养状态改善不佳,而术前结合营养风险筛查给予的营养补充方法,是首先对患者本身营养状况进行评估,根据营养状况评估结果,有针对性制定个体化营养摄入计划,给予更加全面、具体的营养素补充,更有利于促进术后恢复。本研究旨在探讨术前结合营养风险筛查给予营养补充对原发性肝癌患者术后营养状态的影响。
1 资料与方法
1.1 一般资料入组2019年1月至2021年3月在郑州市第一人民医院住院治疗的60例原发性肝癌患者,采用随机数字表法均分为观察组和对照组,每组30例。观察组:男21例,女9例,年龄(61.4±17.2)岁。对照组男21例,女9例,年龄(60.2±10.7)岁。观察组和对照组患者在年龄、性别、肿瘤大小、位置、病理分型、肿瘤数量及肝功能分级等方面比较差异无统计学意义(P>0.05),具有可比性。研究对象的纳入标准[13]:原发性肝癌,年龄18~75岁,肝功能分级Child-Pugh A或B级,无手术禁忌证及广泛转移。排除标准[13]:肝癌广泛转移患者、伴严重脏器基础疾病、肝功能Child-Pugh C级且不能纠正,继发性肝癌。
1.2 方法对照组给予常规普通术前营养补充方式,包括入院后常规检查检验、营养健康教育及三高饮食指导等;观察组营养补充措施在对照组基础上使用患者主观整体营养状况评估量表(patient-generated subjective global assessment, PG-SGA)进行营养评估并给予营养补充。营养素摄入:采用少食多餐的方式,主要提高营养素的摄入量,要求各营养素供给指导量为:脂肪1.0~1.3 g/(kg·d),蛋白质1.2~1.5 g/(kg·d),碳水化合物3.0~5.0 g/(kg·d),也可以直接口服按各营养素供给指导量由营养科配置的营养素。肠外营养摄入:不能耐受肠内营养的或者单纯肠内营养补充不能满足营养需求的使用肠外营养乳剂,结构脂肪乳(华瑞制药有限公司)。
1.3 临床观察指标比较2组围手术期指标:手术时间、术中失血量、肛门排气时间、肛门排便时间与住院时间),干预前及干预后的营养状况:前血清蛋白(prealbumin, PA)、血清白蛋白(albumin, ALB)、血红蛋白(hemoglobin, Hb)、血清总蛋白(total protein, TP),并记录2组术后并发症如胸腹腔积液、感染、胆汁漏的发生情况。

2 结果
2.1 2组围手术期指标比较观察组肛门排气时间、肛门排便时间、住院时间均明显短于对照组(t=9.955,P<0.001;t=8.359,P<0.001;t=10.472,P<0.001)。见表1。

表1 2组围手术期指标比较
2.2 2组干预前后营养状态比较干预前,观察组和对照组PA、ALB、Hb和TP水平比较差异无统计学意义(t=1.541,P=0.129;t=0.403,P=0.688;t=0.359,P=0.721;t=0.166,P=0.869)。干预后,观察组PA、ALB和TP水平均高于对照组,差异均有统计学意义(t=15.305,P<0.001;t=3.368,P=0.001;t=4.850,P<0.001)。见表2。
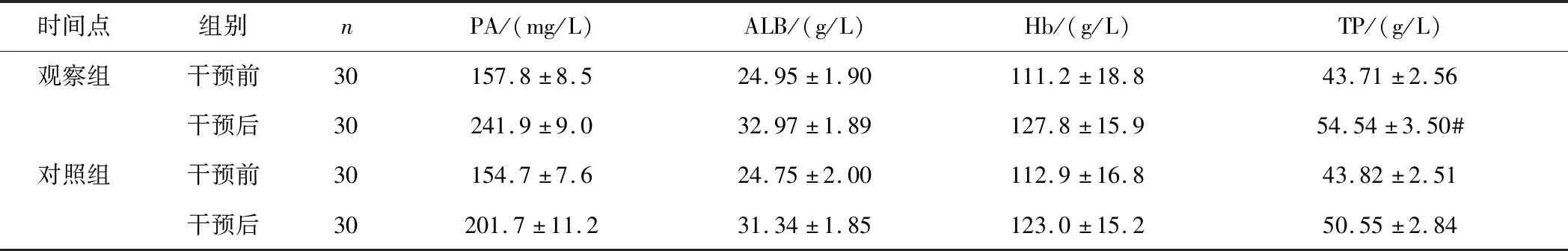
表2 2组干预前后营养状态比较
2.3 2组术后并发症比较观察组术后并发症总发生率为10.0%(3/30),对照组为23.3% (7/30),比较差异无统计学意义(χ2=1.920,P=0.166)。见表3。
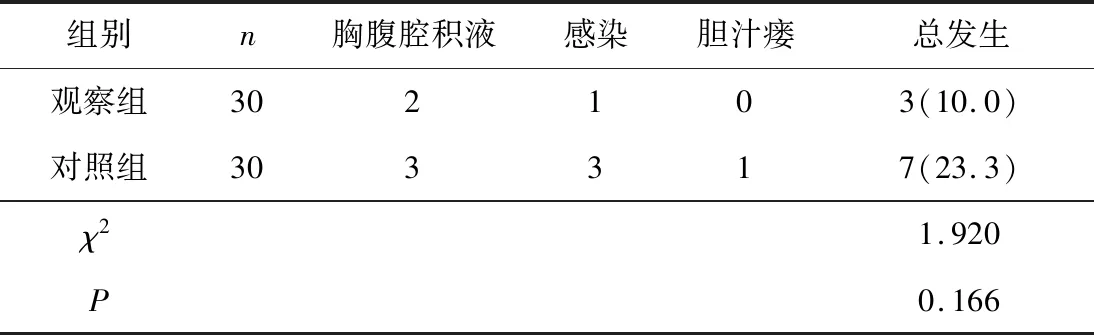
表3 2组术后并发症比较 n(%)
3 讨论
肝脏是重要的消化器官,肝癌大多从肝硬化等慢性肝脏疾病发展而来,肝癌患者发病时多数存在营养不良[14-15]。手术切除本身对机体损伤大,加上术后机体处于应激状态,需要更多的能量和蛋白质。如果术前营养达不到,会直接影响患者预后。因此术前正确的营养风险筛查并给予适合的营养补充至关重要。
美国营养医师协会推荐PG-SGA为恶性肿瘤患者营养筛查首选方法,PG-SGA可以识别住院恶性肿瘤患者的营养不良并对其进行优先排序[2]。结构性脂肪乳是一种新型脂肪乳剂,能减少脂肪沉积,加快蛋白合成[16-17]。
肝癌术前营养不良发生率高,常规护理对患者营养指导患者针对性不强,依从性不高,患者营养摄入补充不理想;而术前使用PG-SGA营养风险筛查量表对患者进行评估,根据不同得分给予需要的营养补充方式,营养摄入更加有针对性,合理科学的营养素搭配比例能够更好、更快改善患者的营养状况。从而改善患者术前营养状况,提高患者对抗手术对机体的打击,显著降低了术后并发症的发生率。
本研究结果显示观察组肛门排气时间、肛门排便时间、住院时间明显低于同期对照组,2组PA、ALB和TP水平均较干预前提高,且观察组的干预后数据更具有优势,术后并发症总发生率显著下降,从而有利于降低院内感染的发生。
因此,术前使用PG-SGA营养风险筛查量表对患者进行评估,根据不同得分给予营养补充不仅纠正了患者的营养状况,而且降低了原发性肝癌患者术后并发症的总发生率,降低院内感染的发生,从而缩短了患者的住院时间,患者获益明显。
