免疫营养支持对肺癌患者术后免疫炎症指标、营养状况和肺功能的影响
2022-07-21李向培孔天东
倪 婷,刘 萍,李向培,孔天东
(1.郑州市第三人民医院营养科,河南 郑州 450000;2.郑州市第三人民医院呼吸肿瘤科,河南 郑州 450000)
肺癌作为人体常见的恶性肿瘤之一,不仅严重威胁到人民的生命和健康,也给患者家庭,乃至整个社会造成了沉重的负担,已经发展成为全球性的公共卫生问题。2020年由国际癌症研究中心发布的全球流行病学统计数据显示,肺癌发病、死亡人数均居各类恶性肿瘤前列,分别占总人数的11.4%和18.0%[1]。我国肺癌患病人数更是高达81.56万,占全球肺癌总人数的36.9%[2]。现阶段,临床上主要采用手术与术后放、化疗作为肺癌治疗的有效手段。外科手术可直接切除病灶,减少肿瘤的转移和复发;而放疗可以抑制肿瘤进一步发展,减缓其扩散,并缓解患者的相关症状;化疗药物则是通过杀灭肿瘤细胞的方式延长患者的生存时间。但是这些手段不可避免地都会对患者造成一定程度的刺激,降低机体的免疫功能,化疗所导致的恶心呕吐还会抑制食欲,影响机体的营养状况,从而不利于患者康复[3]。因此,如何提供合理的辅助干预,保证肺癌患者术后充足的营养供给,是目前临床上医护人员较为关注的难题之一。营养支持主要是通过实施一系列干预措施或饮食指导,调节机体代谢,使得患者从病理损伤的状态逐渐恢复平衡,同时对于免疫指标及营养状况的改善也有部分积极作用[4]。但其对围手术期肺癌患者的辅助治疗效果仍欠缺理论支持,基于此,本研究通过回顾性分析的方法,探讨免疫营养支持对肺癌患者术后免疫炎症、营养状况和肺功能指标的影响。
1 资料与方法
1.1 一般资料选取2020年1月至2021年10月在郑州市第三人民医院行改良肺癌根治术的70例患者,其中男41例、女29例,年龄40~72(60.17±4.42)岁,按照随机数字表法将其均分成观察组(n=35)和对照组(n=35)。2组患者一般资料比较见表1。
表1 2组患者一般资料比较 n(%)
1.2 纳入和排除标准纳入标准:1)患者经术前影像技术及手术病理综合确诊为肺癌;2)有完整的临床资料,且具备良好手术指征;3)凝血功能正常,具备良好的认知与沟通交流能力;4)患者或者家属知情并已签署同意书。排除标准:1)有心脏、肝脏、肾脏等部位器质性病变;2)肺癌Ⅲa期以上或合并其他恶性肿瘤疾病;3)合并有血液系统疾病及自身免疫系统疾病;4)患有精神疾病及认知障碍。
1.3 护理方法对照组患者采取围手术期常规的护理方法,主要包括入院时做好患者的健康教育,告知患者手术操过程以及可能存在的并发症,提高患者的认知度;对患者开展心理疏导,安抚患者的不良情绪;做好基础饮食干预以及术前准备工作;术后加强生命体征监测,营造良好的病房环境;术后早期给予流质食物,之后逐渐过渡到普通食物,对发生的并发症及时处理。观察组患者除了围手术期常规护理,还增加了围手术期免疫营养支持,具体方法如下:1)术前免疫营养支持:若无特殊营养支持禁忌,术前可给肺癌患者补充各种营养素,适当采取高热量、高蛋白质及高维生素饮食;已经存在营养不良的患者,可口服营养液,必要时静脉营养支持,每天根据体质量按168 kJ/kg供应热量,按1.5~2.0 g/kg供应蛋白质,提高机体免疫功能;2)术后免疫营养支持:术后第1~5天,每天提供非蛋白热卡84 kJ/kg、氮0.2 g/kg。其中非蛋白热卡包括脂肪乳剂、葡萄糖,氮源包括乐凡命氨基酸、外源性胰岛素、维生素、微量元素及电解质等。将营养液配制成全合一的溶液,主要经外周静脉进行输注。术后第2天起可提供流质饮食。
1.4 观察指标1)免疫炎症指标:术前与术后3个月,患者空腹时,分别采集其静脉血液4 mL,离心分离血清,采用酶联免疫吸附试验检测白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;2)营养状况指标:术前与术后3个月,分别采集患者静脉血液,离心将血清与血浆分离,采用溴甲酚绿法检测血红蛋白、白蛋白、总蛋白水平;3)肺功能指标:术前与术后3个月,采用德国MasterScreen肺功能仪检测患者第一秒用力呼气容积(forced expiratory volume in one second, FEV1)、用力肺活量(forced vital capacity, FVC)、呼气流量峰值(peak expiratory flow, PEF)水平。

2 结果
2.1 2组患者免疫炎症指标比较术后3个月,观察组患者血清IL-6和TNF-α水平均低于对照组(t=11.830,P<0.001;t=9.593,P<0.001)。见表2。

表2 2组患者免疫炎症指标比较
2.2 2组患者营养状况比较术后3个月,观察组患者血红蛋白、白蛋白、总蛋白水平均高于对照组(t=6.109,P<0.001;t=8.251,P<0.001;t=5.574,P<0.001)。见表3。
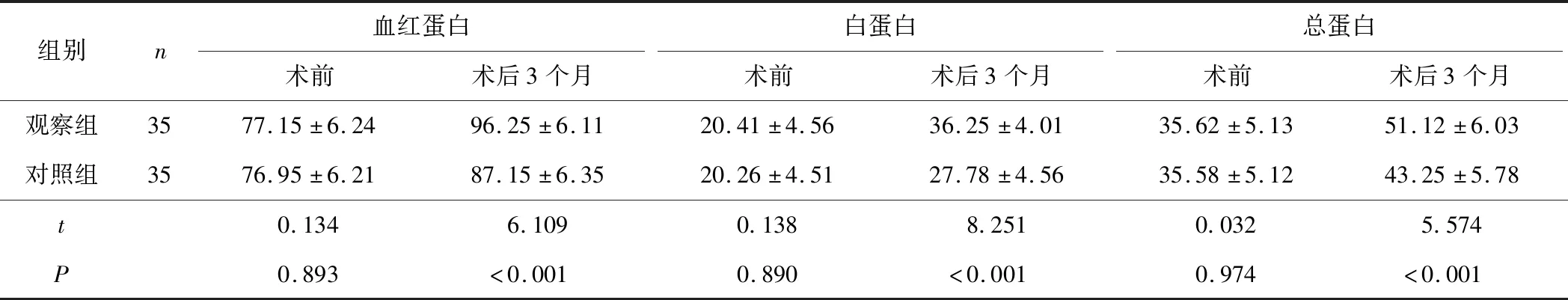
表3 2组患者营养状况比较 g/L
2.3 2组患者肺功能比较术后3个月,观察组患者FEV1、FVC、PEF均高于对照组(t=5.896,P<0.001;t=3.580,P<0.001;t=3.906,P<0.001)。见表4。
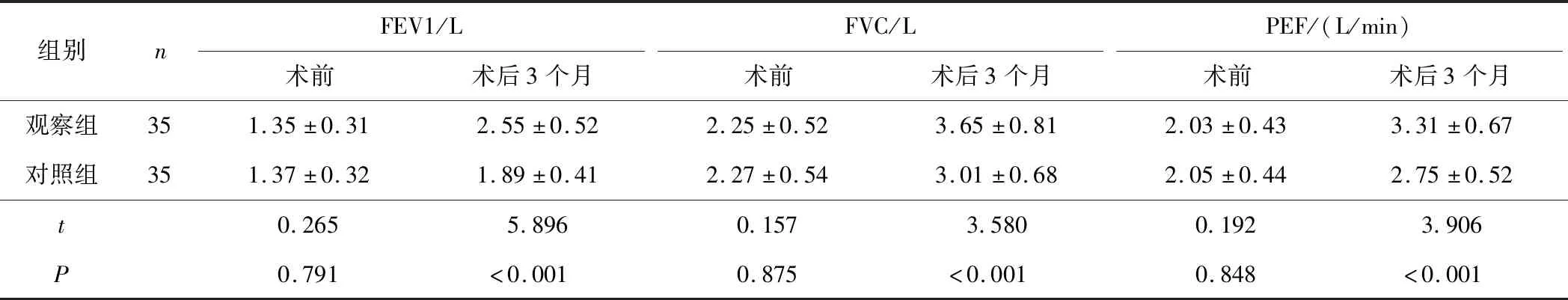
表4 2组患者肺功能比较
3 讨论
肺癌作为我国疾病负担最严重的恶性肿瘤之一,其发病率和死亡率常年居高不下,还呈现出不断增长的趋势,严重威胁人群健康[5]。目前已知的肺癌危险因素有很多,比如吸烟[6]、二手烟暴露[7]、慢性阻塞性肺疾病史、职业暴露、家族史等[8];而适度体育锻炼和增加新鲜蔬果的摄入可以降低肿瘤的发病概率,属于肺癌的保护因素[9]。除此以外,早期筛查也可在一定程度上使居民少患癌,甚至不患癌,但因肺癌发病多具有隐匿性的特点,病例发现时通常已经进展到晚期阶段,即使在诊疗水平不断进步的背景下患者预后仍然很差。对于肺癌患者的治疗,现阶段提倡采取手术治疗与术后放、化疗相结合的方式,原则上以手术为主,放、化疗为辅;无手术指征的患者则主要通过放、化疗延长生存时间[10-11]。但是手术会影响腹腔状况,患者容易出现应激反应[12];放、化疗在损伤肿瘤细胞的同时,也会“误伤”机体正常细胞,产生一系列胃肠道反应;再加上恶性肿瘤本属于消耗性疾病,患者常存在自身代谢障碍、免疫力下降,因此,肺癌患者术后普遍存在炎症反应以及营养状况不佳等问题[13-14]。如果此时能够采取适当的辅助治疗措施,保证肺癌患者身体充足的营养供给,将十分有助于改善其术后的生活质量、提高生存率。
本研究结果显示,术后3个月,观察组患者血清IL-6和TNF-α水平均低于对照组(t=11.830,P<0.001;t=9.593,P<0.001);血红蛋白水平、白蛋白水平、总蛋白水平、FEV1、FVC、PEF均高于对照组(t=6.109,P<0.001;t=8.251,P<0.001;t=5.574,P<0.001;t=5.896,P<0.001;t=3.580,P<0.001;t=3.906,P<0.001)。这表明围手术期常规护理联合免疫营养支持可以有效改善肺癌患者术后炎症反应和机体营养状况,增强肺功能。分析主要有以下两点原因:1)围手术期肺癌患者受到肿瘤细胞和放、化疗的影响,常出现身体素质下降、营养不良、免疫抑制和肺功能受限等症状[15],而常规护理方法对患者的饮食关注较少,营养供给无法满足患者需求,对提高生活质量帮助不大;2)采用免疫营养支持护理方法,术前、术后均给予患者系统的营养饮食干预,适时、按需补充机体所需营养物质,促进体内蛋白质的合成,提高应激反应能力。使患者营养状况改善的同时,体内炎性因子清除能力也随之增强,免疫系统功能得以恢复[16-17]。从而功能受限的肺部细胞抵御肿瘤细胞的能力加强,再配合术后放、化疗的干预,患者肺功能进而改善[18]。但值得注意的是,肺癌患者个体差异较大,肠内与肠外营养各有利弊,应综合衡量患者的身体状况制定个体化的营养支持护理方法。
综上所述,围手术期免疫营养支持可有效改善肺癌患者术后炎症反应和营养状况,增强肺功能。但是本研究也存在一些局限性,比如选取病例少、观察时间短等问题,因此,后续还需要开展长时间、大样本量的研究来验证本结论。
