肺肉瘤样癌临床预后因素分析
2022-07-21余旭旭李向柯杨闽洁毛迎港宋丽杰
陈 钟,余旭旭,李向柯,杨闽洁,毛迎港,宋丽杰
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
肺肉瘤样癌(pulmonary sarcomatoid carcinomas,PSC)发病率较低且预后极差,占非小细胞肺癌(non-small cell lung carcinoma,NSCLC)的0.1%~0.4%[1],其确诊方法主要依赖病理和免疫组化。PSC患者的治疗主要通过手术及放化疗,但一般晚期 PSC 患者对于传统放化疗治疗并不敏感,因此目前PSC治疗的新方向主要依靠靶向治疗及免疫治疗。本文总结郑州大学第一附属医院2017年6月至2020年6月收治的54例PSC患者临床资料,对其临床预后因素进行分析,以提高对本病的认识。
1 资料与方法
1.1 一般资料收集郑州大学第一附属医院2017年6月至2020年6月收治的54例PSC患者临床病理资料,其中全部患者均经病理与免疫组化检测确诊为肺肉瘤样癌,患者均已签署知情同意书且收集的临床病理资料齐全。其中男42例、女12例,男女比例3.51。年龄分布为44~84岁,中位年龄64岁。初诊临床表现为咳嗽伴咳痰/痰中带血40例,胸痛8例,发热5例,无症状体检1例。按照美国癌症分期联合委员会第8版非小细胞肺癌TNM分期标准进行肿瘤分期,I期3例,Ⅱ期7例,Ⅲ期25例,Ⅳ期19例。
1.2 随访采用电话或短信等方法对患者进行随访,随访时间从2017年6月至2020年6月,共1~50个月,中位随访时间为9个月。在随访结束时有42例患者死亡,12例患者生存。生存时间为自确诊之日到末次随访日或死亡时间,以月为单位计算。
1.3 统计学处理采用SPSS 26.0进行数据统计分析。计数资料用百分数表示,比较用χ2检验。应用Kaplan-Meier法绘制生存曲线,log rank法进行生存率显著性检验。多因素分析采用Cox风险回归模型分析。检验水准α=0.05。
2 结果
2.1 临床病理特征与生存的关系在本研究中,患者的1 a总生存率为35.2%,中位生存时间为9个月。单因素生存分析结果显示,性别(χ2=0.337,P=0.561)、有无吸烟史(χ2=0.007,P=0.933)、肿瘤原发部位(χ2=1.288,P=0.256)与患者的生存率无关;而年龄(χ2=4.808,P=0.028)、有无淋巴结转移(χ2=5.868,P=0.015)、是否远处转移(χ2=7.048,P=0.008)、T分期(χ2=11.907,P=0.008)、TNM分期(χ2=11.907,P=0.008)、是否手术(χ2=24.757,P<0.001)和治疗方法(X2=23.527,P=0.001)是影响预后的因素,多因素分析结果显示,影响预后的独立因素为年龄、是否远处转移、T分期和是否手术(P=0.021,P=0.035,P=0.022,P=0.008)。见表1、2,图1。

图1 不同年龄、有无淋巴结转移、是否远处转移、不同T分期、TNM分期、是否手术和不同治疗方法PSC患者生存曲线比较

表1 54例PSC患者临床病理特征与生存的关系
2.2 基因检测分析结果54例PSC患者中,有30例患者进行间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因检测,均未发现突变;21例检测表皮生长因子受体基因(epidermal growth factor receptor,EGFR),其中有4例发生突变,均为EGFR-19外显子突变;21例进行ROS-1基因检测,其中1例发生突变;19例进行KRAS基因检测,其中4例发生突变;18例进行BRAF基因检测,均未发生突变;16例患者进行RET基因检测,其中1例突变;19例进行间质-上皮细胞转化因子(mesenchymal-epithelial transition factor,MET)基因检测,其中6例发现突变,均为MET-14外显子跳跃突变;15例进行TP53基因检测,其中8例发生突变;6例患者进行程序性死亡受体1(programmed cell death protein 1,PD-1)/程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)基因检测,其中1例检测出PD-1弱阳性表达,4例发现PD-L1阳性表达。见表3。

表2 54例PSC患者预后的多因素分析
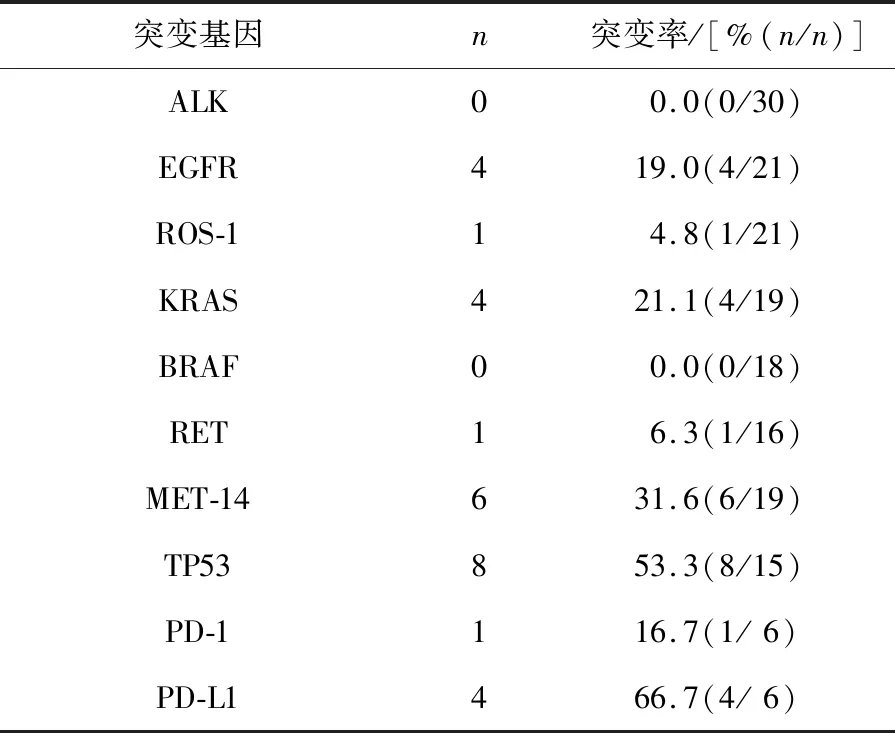
表3 54例PSC患者的基因检测分析结果
3 讨论
肺肉瘤样癌发病率较低且预后极差,被WHO定义为一种含有肉瘤或肉瘤样分化成分的非小细胞肺癌,其发病率约占非小细胞肺癌的2.0%~3.0%,占肺癌的0.1%~0.4%[1-2]。2015年,PSC被WHO分为多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤5种类别[1],其中以多形性癌最为常见,目前认为PSC来源于单克隆原始上皮组织,再经上皮间质转化成为了肉瘤样和(或)肉瘤[3]。PSC多见于有吸烟史的中老年男性,好发年龄段为65~75岁[4],但既往文献对于年轻患者也有报道[5]。本研究中男女比例为3.51,其中吸烟患者占53.7%(29/54),但性别、吸烟史对患者的预后无明显影响。PSC患者临床表现无特异性,多为咳嗽、咳痰、痰中带血、胸痛等,因此多数患者在确诊时就已进展至晚期。PSC常见转移至肺、骨、肾上腺、胸膜和脑等[6],也有一些不常见的转移部位曾被报道,如皮肤和小肠[7],本研究中发生远处转移的患者共有19例,其中发生肺部转移为5例,骨转移为5例,肾上腺转移为2例,7例确诊时已全身多发转移(肺、骨、肾上腺等处)。因此肺肉瘤样癌患者的生存时间明显低于非肉瘤样非小细胞肺癌患者,其中位生存时间为10个月[8]。本研究患者的中位生存时间为9个月,与文献报道基本相符。
与其他类型的非小细胞肺癌一样,PSC患者早期首选的治疗方式为手术,本研究中有16例患者接受手术治疗,中位生存时间为20个月,相较于既往文献报道行手术治疗的患者中位生存时间为14个月[9],本研究术后患者生存时间较长,这可能与本研究中大部分术后患者接受了术后辅助治疗有关。其中38例患者未接受手术治疗,中位生存时间为7个月,2组比较差异有统计学意义,说明早期手术可以提高PSC患者的预后生存时间。
但由于大部分PSC患者发现时已发展至晚期,不能进行手术治疗,且对于放、化疗并不敏感,因此靶向治疗和免疫治疗已成为PSC患者治疗的新方向。目前也有很多研究探讨了肺肉瘤样癌的基因特征。Fallet等[10]对114例PSC患者进行基因检测分析,发现EGFR突变率为22.2%,TP53为22.6%。Schrock等[11]的研究中KRAS突变率高达34.0%,MET突变率为13.6%。Chen等[12]的研究中ALK基因发生突变率为3.5%。Alì等[13]的研究对44例PSC患者PD-L1的表达进行检测,其中有47.0%的患者表达≥50%。还有研究[14]证明KRAS基因突变可能提示患者预后较差。此外,BRAF、RET、NRAS、HER2、AKT1、JAK3、PIK3CA、STK11等基因的突变在PSC患者中也被陆续发现[15],因此靶向治疗、免疫治疗为PSC患者带来了新的希望。
目前在PSC患者的治疗方面,有研究[16-17]表明,存在EGFR突变的PSC患者应用酪氨酸激酶抑制剂的疗效并不稳定。Lin等[18]的个案报道显示,1例ALK重排的晚期PSC患者应用克唑替尼后达到了7个月的部分缓解。本研究中有6例患者MET-14外显子跳跃突变,3例接受克唑替尼治疗,其中1例截止至随访结束仍存活,疾病无进展生存时间为6个月。目前多项Ⅱ期或Ⅲ期临床试验的研究[19-20]结果已表明,PD-L1高表达的患者可以从免疫治疗中受益,在一项肺肉瘤样癌研究中,患者PD-L1中位表达水平为70%,应用以纳武利尤单抗为主要药物治疗,中位生存时间为12.7月,中位疾病无进展生存时间为4.89个月,客观缓解率为40.5%。本研究中有3例患者PD-L1高表达(>50%),1例应用纳武利尤单抗治疗6个周期+GP方案治疗4个周期,肿瘤缩小30.2%,后行手术治疗,该患者共随访24个月,截止至随访结束仍存活;1例应用度伐利尤单抗后出现重症肺炎,总生存时间为5个月;1例行手术治疗,术后行GD方案化疗2个周期,总生存时间为16个月。研究[21]证明放疗联合靶向治疗可提高局部晚期非小细胞肺癌患者的治疗疗效,但在PSC患者中的作用还需要更多的临床研究证明。
本研究存在的一些不足之处:首先,54例患者中大部分患者未进行病理亚型诊断,因此无法针对某一亚型进行研究分析;其次该研究为一项回顾性分析研究,入组的样本量需要进一步增加。
综上所述,PSC多见于有吸烟史的中老年男性,恶性程度高,且临床表现并无特异性,主要治疗方法为手术及放、化疗,但传统治疗方法效果欠佳,靶向治疗和免疫治疗是肺肉瘤样癌患者治疗的新方向,但还需要更加成熟完善的临床实验或研究来进行验证,建议患者在条件允许下进行基因检测,若患者存在相应有意义的基因突变,在符合临床用药规范的情况下可选择相应靶向治疗药物,对比传统放、化疗或将取得更大获益。而患者若出现PD-L1高表达,早期接受免疫治疗能够使患者获得更长的生存时间。虽然PSC被普遍认为是一种预后极差的肺恶性肿瘤,但随着对其基因研究的进展,对PSC的治疗也取得了较大的突破,当然,肺肉瘤样癌的基因突变及其作用机制还需要更深层次的研究。
