载Cu-ZnO牙科饰面瓷的制备及抗菌性能
2022-07-20程名扬乔琴李群廖岚
随着口腔修复材料的发展与修复体制作工艺的进步,全瓷材料已成为口腔临床中最常用的修复材料之一
。全瓷材料具有优异的机械性能及良好的生物相容性,使口腔临床修复的成功率大大提高。但固定修复体边缘细菌聚集的能力明显高于其他部位,修复后基牙自洁作用减弱,易形成菌斑滞留区,研究表明固定义齿的5 年失败率为10%以上
。
无机金属抗菌剂具有安全性较高、耐热性较好、抗菌范围广等优势
。无机金属抗菌材料近几年已被广泛应用于口腔领域。Zhu 等
加入ZnO与Ag
O 后使二硅酸锂玻璃陶瓷具有一定的抗菌性能,二硅酸锂玻璃陶瓷的抗菌性能随着ZnO 含量的增加而增强。研究表明,与其他无机纳米金属抗菌剂相比,因Cu
与Zn
的离子半径相近,Cu
能显著改变ZnO 纳米颗粒的形态、结构及光学性质
,杂化后的Cu-ZnO 纳米粒子相较于纯ZnO 纳米颗粒具有更好的抗菌特性、抗氧化性,且无明显细胞毒性。Jan 等
发现与单一的ZnO 相比,纳米CuO-ZnO 复合材料表面缺陷密度更大。而活性氧(reactive oxygen species,ROS)的产生量与纳米结构表面缺陷密度相关,表面缺陷密度越大,ROS 的产生量越大,抗菌活性越强
。
IPS E.max Ceram 陶瓷因其具有优异的美学性能和良好的力学性能,广泛应用于全冠、嵌体等修复体饰面瓷的制作。本课题组在前期的研究中制备出了一种纳米铜锌复合抗菌剂,Cu 与ZnO 添加的质量百分比为1:99,该抗菌剂已申请专利(专利号CN201910537967.6)。本实验拟将不同质量百分比的纳米Cu-ZnO 通过球磨法添加到IPS E.max Ceram 饰面瓷中,经750 ℃高温烧结后制备出抗菌牙科饰面瓷,并评价改性后的IPS E.max Ceram 饰面瓷的抗菌性能、机械性能以及其体外细胞毒性。
1 材料和方法
1.1 材料、试剂和仪器
大肠杆菌(ATCC25922,由南昌大学第二附属医院提供);CCK-8 试剂盒(Apexbio 公司,美国);IPS E.max Ceram 瓷粉(义获嘉伟瓦登特(上海)有限公司,中国);纳米铜锌复合抗菌剂(南昌大学材料学院);扫描电子显微镜SEM(ZEISS Sigma 300,德国);恒温培养箱(FYL-YS-230,中国);电子天平(Sartorius BT25S,中国);电子拉力试验机(CMT-2502,中国)。
1.2 试件制备
①将IPS E.max Ceram 瓷粉中掺杂不同质量百分比的Cu-ZnO 纳米颗粒(0 wt%,1 wt%,2 wt%,3 wt%,4 wt%,5 wt%,6 wt%),通过球磨法混合均匀,通过磨具将混合均匀的瓷粉压缩成直径20 mm、高2 mm 圆柱形,然后于VITA 烤瓷炉中经750 ℃高温烧结8 min,冷却后使用去离子水冲洗、烘干抛光轮抛光,制得IPS E.max Ceram 抗菌瓷试件。②依照同样的方法制作检测弯曲强度试件,试件尺寸按照《牙科学·陶瓷材料》中的物件建议的标准设定为22 mm×4 mm×3 mm。按照添加不同的Cu-ZnO质量百分比将饰面瓷试件分为7 组。
1.3 晶相分析与形貌表征
将0 wt%~3 wt% Cu-ZnO 组各组的回收菌落数导入SPSS 26.0 软件中显示数据符合正态分布且符合方差齐性。1 wt% Cu-ZnO 组、2 wt% Cu-ZnO 组、3 wt% Cu-ZnO 组与0 wt% Cu-ZnO 组均存在显著性差异(
=23.308,
=0.001)。由表2、图2 可知,随着纳米Cu-ZnO 添加浓度的增加,对大肠杆菌(
,
)的抑制效果逐渐提高。当纳米Cu-ZnO 添加比例依次为1 wt%~6 wt%时,抗菌瓷对
抗菌率分别为24.85%、67.94%、96.92%、99.99%、99.99%、99.99%。
1.4 平板菌落计数实验

1.5 体外细胞毒性实验
将只加入10%胎牛血清的培养基设置为空白对照组,其余各组依次随机抽取3 个试件,向小鼠成纤维细胞(L929)中加入2.0 mL 0.5%胰蛋白酶消化收集,再加入10%胎牛血清DMEM 配成细胞悬液,离心机离心5 min,取3 块96 孔培养板,将细胞悬液依次接种于96 孔培养板中,然后放入37 ℃、5%CO
恒温培养箱中培养1、3 d。


1.6 机械性能实验

1.7 统计学分析
(1)营27X3井应用排砂采油工艺技术恢复生产是成功的,投产初期取得了日产液15.5t、日产油7.1t、含水率54.5%的效果。
2 结 果
2.1 试件制备及表面形貌观察
口腔中的菌斑生物膜在形成和聚集过程中对口腔疾病的发展起到了至关重要的作用。赋予修复体全瓷材料抗菌性能,可以减少修复体表面菌斑生物膜的聚集,延长修复体的使用时间。修复体表面改性制备抗菌涂层是赋予修复体抗菌性能的常用方法之一。与其他抗菌剂相比,无机抗菌剂具有良好的稳定性及安全性。金属纳米抗菌材料近些年已广泛应用于医疗领域,其中具有广谱抗菌性的金属离子包括Ag
、Zn
、Cu
三种
。有学者
采用溶胶凝胶法制备La-TiO
溶胶,在3YTZP(摩尔分数3%氧化钇稳定四方多晶氧化锆陶瓷)表面制备出均匀涂覆的La-TiO
薄膜,对
显示出了良好的抑菌效果。但是在陶瓷表面涂覆的La-TiO
薄膜同时存在着硬度差、与釉面结合度低等缺点。在咀嚼过程中,与对颌天然牙和食物的摩擦容易造成陶瓷表面抗菌薄膜的破损,难以维持抗菌的长效性。有学者采用氧化还原法将Ag NPs 加入到含氧化钇稳定的氧化锆中
,对大肠杆菌(革兰氏阴性菌)、链球菌(革兰氏阳性菌)及白色念珠菌(真菌)进行微量液体稀释法,对这三种细菌均有良好的抗菌效果。但Ag
对光非常敏感,容易氧化变色
,在水中还易与Cl
、SO
等阴离子形成难溶物从而丧失抗菌活性。相比较而言,Cu、Zn 的成本更低廉,抗菌性能也非常优异。Rashid 等
在ZnO 中掺杂Cu
后,相较于纯ZnO,杂化后的纳米Cu-ZnO 有助于提高ZnO 的光催化活性,且能增强ZnO 对革兰氏阳性菌的抗菌效率。与纯ZnO 相比,ZnO-CuO 纳米复合材料对临床分离的多重耐药金黄色葡萄球菌具有更好的抗菌活性
。Liu 等
使用分子探针法评价纳米Cu-ZnO的光催化性能,结果显示杂化后的Cu-ZnO 纳米粒子相较于Ag-ZnO 纳米粒子及Au-ZnO 纳米粒子具有更高的光催化活性和稳定性。有研究表明
通过控制ZnO 的添加量,可以有效调节载Ag
O 抗菌二硅酸锂玻璃陶瓷的透明度。本实验中使用的纳米Cu-ZnO 具有Cu 和ZnO 两种无机纳米抗菌剂,两种抗菌剂在发挥抗菌作用的同时,ZnO 能否有效调节Cu 对饰面瓷带来的着色问题有待进一步研究。
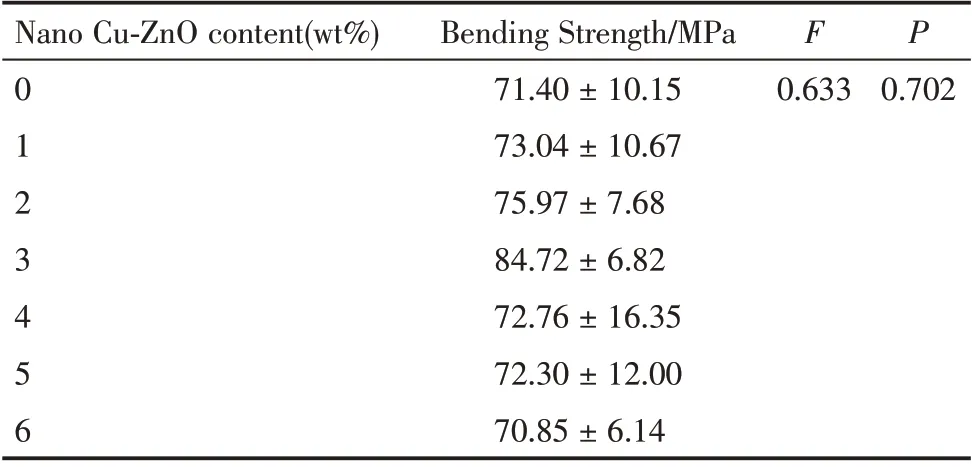
将对照组及各浓度Cu-ZnO 组试件的弯曲强度数据用SPSS 软件26.0 计算,显示数据符合正态分布且方差齐性,采用单因素方差分析,各实验组与对照组的弯曲强度比较,均无显著差异(
=0.633,
=0.702)。IPS E.max Ceram 饰面瓷随着抗菌剂添加量的提升,其弯曲强度呈现先升高,后降低的趋势。当抗菌剂添加量为3 wt%时弯曲强度达到最大值(84.72 ± 6.82)MPa,当添加量大于3 wt%时抗菌饰面瓷的弯曲强度随着抗菌剂的增加而降低,当抗菌剂添加量为6 wt%时弯曲强度下降到(70.85±6.14)MPa(表4)。

2.2 抗菌实验结果
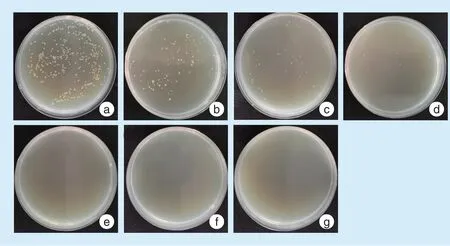
因前期预实验显示载5 wt%Cu-ZnO 的饰面瓷对革兰氏阳性菌及革兰氏阴性菌均具有良好的抑制作用,所以将制备好的5 wt%Cu-ZnO 的饰面瓷试件打磨抛光,试件表面使用3%的氢氟酸溶液酸蚀1 min,去离子水冲洗3 min 后烘干,表面喷金。使用扫描电子显微镜对纳米Cu-ZnO 及含5 wt% Cu-ZnO 的饰面瓷试件进行观察,分析样品表面形貌。
本实验根据现行的GB/T 21510《纳米无机材料抗菌性能检测方法》,对抗菌饰面瓷试件采用贴膜法进行检测。在饰面瓷中添加抗菌剂含量为3 wt%时,对
抗菌率达到96.92%。依据中华人民共和国国家标准JC/T897-2014《抗菌陶瓷制品抗菌性能》,当抑菌率大于90%即可认为该样品有较强的抑制作用。Khalid 等
采用水热法合成了由CuO 和Zn 掺杂的纳米抗菌剂(CuO NSs),相较于单一的CuO,杂化的CuO NSs 对铜绿假单胞菌有着更强的抑制作用,极大地提高了抗菌性能。本实验使用Cu-ZnO 纳米复合材料对牙科饰面瓷进行功能性修饰,Cu 与ZnO 杂化后在瓷面上发挥协同抗菌作用。

2.3 体外细胞毒性分析
将空白对照组(只加入10%胎牛血清培养基)与各浓度组抗菌瓷浸提液培养小鼠L929 细胞,培养1、3 d 的光密度值符合正态分布且方差齐性,采用单因素方差分析,共培养第1 天除了0 wt%组,其余实验组光密度值与空白对照组之间均存在统计学差异(
=4.128,
=0.009),共培养第3天4 wt%、5 wt%、6 wt%组光密度值与空白对照组之间存在统计学差异(
= 6.144,
= 0.001),其余实验组与空白对照组之间均无统计学差异。共培养第1 天及第3 天后,各实验组与空白对照组的细胞相对增殖率无显著性差异(
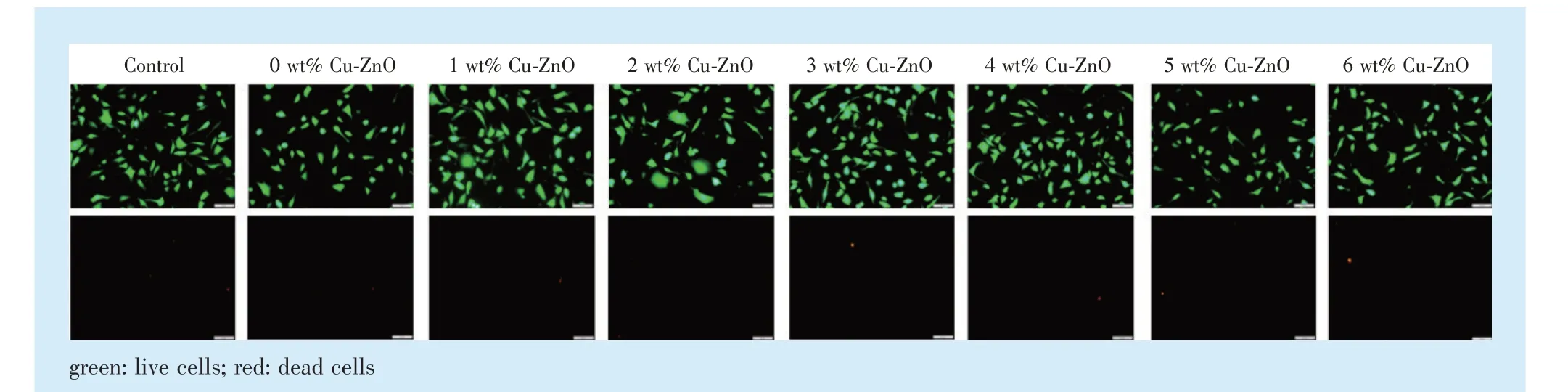
>0.05),且各组别细胞增殖率均>80%,毒性分级均≤1 级(表3)。抗菌IPS E.max Ceram 饰面瓷浸提液与小鼠成纤维细胞L929共培养24 h 后,使用荧光显微镜观察L929 活死细胞染色结果可见:与空白对照组相比,各实验组细胞形态正常,无明显死细胞(图3)。
使用SPSS 26.0 对数据进行统计分析,回收菌落数、光密度值及弯曲强度结果用均数±标准差表示,抗菌率与细胞增殖率结果用均数表示,分析数据是否符合正态分布,若数据不符合正态分布,可采用多独立样本秩和检验;若数据符合正态分布且满足方差齐性,使用单因素方差分析,检验水准α=0.05。

2.4 机械性能
近几年,娃哈哈年营收连续下滑。产品老化和营销渠道老化的双重冲击,让娃哈哈陷入了前所未有的困境。在此背景下,娃哈哈不断求新求变,想重获消费者的青睐,但这并非易事。娃哈哈不断高频次推出新品,但大多反响平平,甚至很快就销声匿迹。
3 讨 论
图1a 为纳米Cu-ZnO 扫描电镜图,微观下氧化锌表现为块状样和花瓣样结构,其上附着颗粒状结构为纳米铜;由图1b 含5 wt% Cu-ZnO 饰面瓷试件的表面形貌及图1c 含5 wt%Cu-ZnO 饰面瓷切割后内部形貌,可见块状样结构的Cu-ZnO 掺杂嵌合于饰面瓷之中。
同时,教师在课上要组织好自身的面部表情,做到微笑讲课。教师给与学生的微笑便是对于学生最好的评价,在学生的心目当中,教师的微笑便是对于自身最好的肯定。而且微笑能够放松学生的身心,使学生以愉悦的心态进行知识的学习,从而达到事半功倍的效果。
CCK-8 法常用于评价材料的生物相容性,CCK-8 法相较于传统的MTT 法操作更为简便,且试剂的灵敏度更高
。其原理是在正常的培养条件下,L929 细胞呈倍数增长,当有外界刺激因素的干扰下会影响其正常生长,导致L929 细胞活性及细胞增殖率的降低。共培养第1 天及第3 天各组别细胞增殖率均>80%,毒性分级≤1 级,荧光显微镜观察L929 活/死细胞染色结果可知,与空白对照组相比,各实验组L929细胞形态正常,无明显死细胞。由CCK-8 法结果可知纳米Cu-ZnO 添加量为1 wt%~6 wt%的IPS E.max Ceram 饰面瓷对小鼠L929 细胞增殖影响较小,生物安全性较高。随着纳米Cu-ZnO 浓度的提升,抗菌饰面瓷的弯曲强度呈现先升高,后降低的趋势。其原因之一可能是无机纳米粒子拥有较高的表面能,当添加量较低时,受到外力作用的能量被无机纳米粒子吸收。随着添加量的增高,纳米颗粒之间发生团聚形成应力集中区,导致饰面瓷机械性能的下降。另有研究表明
将银纳米粒子加入牙科饰面瓷中混合烧结后,发现增强了饰面瓷的机械性能。其原因是Ag 纳米粒子与饰面瓷之间产生了离子交换反应,且两者间存在不同的热膨胀系数,共同导致混合烧结后在饰面瓷中产生了一定的残余压应力,由此增强了饰面瓷的机械性能。在全瓷修复体中,基底瓷与饰面瓷热膨胀系数的差异决定着两者在高温烧结后的结合强度。在临床中应尽量保持基底瓷与饰面瓷热膨胀系数的匹配性,以减少基底瓷与饰面瓷界面的残余应力,降低全瓷修复体破坏的可能性。Fujieda 等
发现银纳米粒子相较于饰面瓷有着更高的热膨胀系数。但将无机纳米粒子加入牙科饰面瓷中混合烧结后,是否会改变原有饰面瓷的热膨胀系数,目前还没有相关文献报道。
蛋疼:原为北方俗语。豫鲁苏皖交界一带多用此俚语,如商丘、菏泽、徐州、亳州等地。表示无聊至极或其他难以名状的无力感的意思。
本研究将3 wt%纳米Cu-ZnO 掺杂至IPS E.max Ceram 饰面瓷,经750 ℃的高温烧结后,制得一种抗菌性能良好的牙科饰面瓷。该饰面瓷对
的抗菌率为96.92%,弯曲强度达到最大值(84.728 ±6.82)MPa,且无明显细胞毒性,为口腔全瓷修复体提出了一种抗菌无毒的策略,具有广阔的应用价值。但载Cu-ZnO 浓度较高时,饰面瓷的颜色亮度会增加。由于口腔环境较为复杂,菌群与宿主保持“动态平衡”,抗菌饰面瓷是否具有抗菌长效性,以及其应用是否会对口腔微生态环境产生影响,尚需进一步的实验研究。
他把手抽了回去,插进裤兜,脸唰一下红了。也许我刚才的问题的确难为他了,以前我从没见他的脸这么红过。如果我整夜埋在枕头里哭泣,我也会觉得窘迫。可至少我知道哭的时候怎么掩饰。
【
】 Cheng MY performed the experiments and wrote the article. Liao L, Qiao Q and Li Q designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
[1] Zhang Y, Kelly JR. Dental ceramics for restoration and metal veneering[J]. Dent Clin North Am, 2017, 61(4): 797-819. doi: 10.1016/j.cden.2017.06.005.
[2] Toman M, Toksavul S. Clinical evaluation of 121 Lithium disilicate all-ceramic crowns up to 9 years[J]. Quintessence Int, 2015,46(3):189-197.doi:10.3290/j.qi.a33267.
[3] Saidin S,Jumat MA,Mohd Amin NAA,et al.Organic and inorganic antibacterial approaches in combating bacterial infection for biomedical application[J]. Mater Sci Eng C Mater Biol Appl,2021,118:111382.doi:10.1016/j.msec.2020.111382.
[4] Zhu J, Zheng T, Xin Y, et al. Influence of ZnO on the crystal phase and properties of lithium disilicate glass-ceramic doped with Ag
O[J].J Non-Cryst Solids,2017,474:43-49.doi:10.1016/j.j noncrysol.2017.08.020.
[5] Khalid A, Ahmad P, Alharthi AI, et al. Synergistic effects of Cudoped ZnO nanoantibiotic against Gram-positive bacterial strains[J]. PLoS One, 2021, 16(5): e0251082. doi: 10.1371/journal.pone.0251082.
[6] Bhuyan T, Khanuja M, Sharma R, et al. A comparative study of pure and copper (Cu)-doped ZnO nanorods for antibacterial and photocatalytic applications with their mechanism of action[J]. J Nanopart Res,2015,17(7):288.doi:10.1007/s11051-015-3093-3.
[7] Jan T,Azmat S,Mansoor Q,et al.Superior antibacterial activity of ZnO-CuO nanocomposite synthesized by a chemical co-precipitation approach[J].Microb Pathog,2019,134:103579.doi:10.1016/j.micpath.2019.103579.
[8] Mahamuni-Badiger PP, Patil PM, Badiger MV, et al. Biofilm formation to inhibition:role of zinc oxide-based nanoparticles[J].Mater Sci Eng C Mater Biol Appl,2020,108:110319.doi:10.1016/j.msec.2019.110319.
[9] Jiang RD,Lin H,Zheng G,et al.
dentin barrier cytotoxicity testing of some dental restorative materials[J].J Dent, 2017,58:28-33.doi:10.1016/j.jdent.2017.01.003.
[10] Ning C, Wang X, Li L, et al. Concentration ranges of antibacterial cations for showing the highest antibacterial efficacy but the least cytotoxicity against mammalian cells: implications for a new antibacterial mechanism[J]. Chem Res Toxicol, 2015, 28(9): 1815-1822.doi:10.1021/acs.chemrestox.5b00258.
[11] 曾永发,付玉林,戴群,等.3Y-TZP陶瓷表面镧掺杂TiO
薄膜的制备和抗菌性能研究[J].口腔疾病防治,2019,27(3):153-158.doi:10.12016/j.issn.2096-1456.2019.03.003.Zeng YF, Fu YL, Dai Q, et al. Preparation and antibacterial properties of lanthanum-doped TiO
films on 3Y-TZP ceramic surfaces[J].J Prev Treat Stomatol Dis,2019,27(3):153-158.doi:10.12016/j.issn.2096-1456.2019.03.003.
[12] Xu K,Liu Y,Liu S,et al.Microorganism adhesion inhibited by silver doped Yttria-stabilized zirconia ceramics[J]. Ceram Int, 2011,37(7):2109-2115.doi:10.1016/j.ceramint.2011.02.023.
[13] Corrêa JM,Mori M,Sanches HL,et al.Silver nanoparticles in dental biomaterials[J]. Int J Biomater, 2015 : 485275. doi: 10.1155/2015/485275.
[14] Rashid M, Ikram M, Haider A, et al. Photocatalytic, dye degradation, and bactericidal behavior of Cu-doped ZnO nanorods and their molecular docking analysis[J]. Dalton Trans, 2020, 49(24):8314-8330.doi:10.1039/d0dt01397h.
[15] Liu X, Liu H, Zhang W, et al. Facile synthesis and photocatalytic activity of bi-phase dispersible Cu-ZnO hybrid nanoparticles[J].Nanoscale Res Lett, 2015, 10: 195. doi: 10.1186/s11671-015-0895-2.
[16] Khalid A,Ahmad P,Alharthi AI,et al.Structural,optical and antibacterial efficacy of pure and zinc-doped copper oxide against pathogenic bacteria[J]. Nanomaterials (Basel), 2021, 11(2): 451.doi:10.3390/nano11020451.
[17] Failli A, Legitimo A, Orsini G, et al. Antiproliferative effects of 5-fluorouracil and oxaliplatin in colon cancer cell lines: comparison of three different cytotoxicity assays[J]. J Biol Regul Homeost Agents,2013,27(1):275-284.
[18] Uno M, Kurachi M, Wakamatsu N, et al. Effects of adding Silver nanoparticles on the toughening of dental porcelain[J]. J Prosthet Dent,2013,109(4):241-247.doi:10.1016/S0022-3913(13)60052-9.
[19] Fujieda T,Uno M,Ishigami H,et al.Addition of Platinum and Silver nanoparticles to toughen dental porcelain[J]. Dent Mater J,2012,31(5):711-716.doi:10.4012/dmj.2012-044.
