重度先天缺牙患者WNT10A 基因新突变位点的检测及其种植修复
2022-07-20蒋欣珂喻康周梦琪吴轶群王凤
胚胎发育是由多因素参与、由多阶段组成的复杂的生理过程,其中任何一个阶段受到干扰,都可能导致先天性畸形和异常的病理现象。牙齿发育异常是其中较为常见的表型,如果诱导牙齿发育形成的生理过程受到干扰,将会导致牙齿大小、位置、结构和数量的异常
。
选择性先天缺牙(selective toothagenesis)指因遗传因素导致的非综合征型或综合征型先天性牙缺失。国际疾病分类第11 次修订本(ICD-11)依据恒牙缺失数目(不含第三磨牙),将先天缺牙分为3 类,包括Ⅰ型先天缺牙(即少数牙缺失,缺牙数目<6)(hypodontia)、Ⅱ型先天缺牙(即多数牙缺失,缺牙数目≥6)(oligodontia)和Ⅲ型先天缺牙(即全口无牙)(anodontia);Ⅱ型或Ⅲ型的缺牙患者被认为是重度缺牙。重度先天缺牙的患者,牙列的缺损甚至缺失会带来咀嚼效率低下、语音问题和颜面美观问题等诸多困扰,严重影响患者的身心健康。
测试前三份问卷装订成册。得到被试班级班主任协助后,以班级为单位进行团体施测。测试者采用统一指导语向被试说明填写要求。被试签知情同意书后在课堂上统一完成测试当堂收回。
无论是哪一种类型的先天缺牙,遗传因素都是主要的致病原因
。随着分子遗传学技术的发展以及研究相关的动物模型,轴抑制蛋白基因2(axis inhibition protein 2,AXIN2)基因
、外异蛋白(ectodysplasin,EDA)基因
、肌节同源异性盒基因1(muscle segment homeobox gene 1,MSX1)基因
、配对盒基因9(paired box 9,PAX9)基因
和Wingless-type MMTV integration site family member 10A(WNT10A)基因
已被证实与非综合征型的先天缺牙有关。上述基因的突变导致所编码蛋白的结构发生变化,影响蛋白的正常功能及/或与其他蛋白的相互作用,最终影响成牙相关细胞和器官,导致牙齿缺失。
Wnt 信号分子在胚胎发育过程中对多种细胞和器官的增殖分化有重要作用
。Wnt 蛋白通过卷曲跨膜受体(frizzled transmembrane receptors,Fz)和共受体低密度脂蛋白受体相关蛋白5/6(lipoprotein receptor-related protein 5/6,LRP5/6)发出信号,激活下游β-catenin 依赖的经典通路
或β-catenin不依赖的非经典通路
,后者包括平面细胞极性通路和Wnt/Ca
通路。牙上皮细胞分泌的Wnt 蛋白(包括Wnt4、Wnt6 和Wnt10)对牙齿发育十分重要,该过程若受到干扰将破坏Wnt/β-catenin 通路活性,导致牙齿在帽状期早期发育停滞。Wnt10A蛋白在牙上皮细胞和间充质中表达,WNT10A 基因的突变已在多种外胚层发育不良综合征的病例中被报道
,包括牙-指-真皮发育不良(odonto-onycho-dermal dysplasia,OODD)和Schopf-Schulz-Passarge 综合征(SSPS),上述两种综合征患者可以出现重度先天缺牙和甲发育不良等相同表型。同时,WNT10A 也是非综合征型的先天缺牙的主要候选基因
。
其实,这跟年岁一点关系都没有。央视有个足球评论员叫张路,说球说了三十多年。我小时候,他就在激情澎湃地说意甲,如今还在激情澎湃地说球,一口气说出那么多球员的名字,这得多好的记忆力啊。老了的张路先生,依然显得年轻,依然帅气,也只有活在自我情趣中的人,才会这么年轻吧。
1 资料和方法
1.1 病例收集
本研究对象为就诊于上海交通大学医学院附属第九人民医院口腔种植科和口腔第二门诊的先天性牙缺失患者。通过询问患者病史、家族遗传史,口腔检查及拍摄曲面体层片、根尖片确定研究对象的缺牙数目、位点。研究对象及其家庭成员均签署知情同意书。本研究遵照《赫尔辛基宣言》进行,并获得上海交通大学医学院附属第九人民医院伦理委员会批准(编号:SH9H-2021-T-340-2)。
1.2 全外显子测序
本研究对先证者进行全外显子测序。使用全血基因组DNA 提取试剂盒(Qiagen,美国)并根据使用说明从外周血样中提取DNA。使用SureSelect人全外显子探诊试剂盒V6(Agilent,美国)采集DNA 样品并根据使用说明在Illumina Hiseq 2000 平台(Illumina,美国)进行测序。原始数据在进行碱基识别和样品解复用后,以Paired FASTQ 文件进行存储。
1.3 突变位点过滤和筛选
运用Genome Analysis Toolkit(GATK,Broad Institute,美国)软件分析测序数据以生成先证者基因型。突变位点根据下列标准进行筛选:①保留位于外显子区域的突变位点;②排除同义突变的位点;③排除未报道的序列片段插入/删除;④保留在Exome Aggregation Consortium(ExAC,http://exac.broadinstitute.org),the 1000 Genome Browsers(1000G)和中国国家基因库生命大数据平台(CMDB,https://db.cngb.org/cmdb/)中最小等位基因频率(Minor Allele Frequency,MAF)≤0.05 的突变位点。
一是明确村委会在农业领域PPP项目运行中的职责。我国《民法总则》第101条赋予农村集体经济组织特别法人的主体地位,并规定在尚未建立农村集体经济组织的情形下,村委会可以代行农村集体经济组织的职责。据此,村委会在农业领域PPP项目中既不能成为社会资本方的附庸,也不能完全等同于农民群体,而要代表农民群体的利益与政府和社会资本方合作。具体而言,村委会在项目前期主要负责与项目落地有关的谈判、准备工作;在项目运营过程中主要负责资源协调、履约监督等工作;在项目后期主要负责资产的清算与受领等工作。
1.4 聚合酶链式反应及Sanger 测序
使用引物设计软件Snapgene(Insightful Science,美国)设计涵盖WNT10A 基因编码区外显子的引物,对先证者及其家系成员DNA 进行聚合酶链式反应(PCR)扩增,扩增产物经琼脂糖凝胶电泳鉴定后进行Sanger 测序(擎科生物科技有限公司,中国)。使用Chromas 软件(Technelysium,澳大利亚)对DNA 序列峰图进行分析。
例如古诗《乡村四月》,教师引读:乡村的四月山陵和原野上到处是一片绿色,稻田里的水色映照着天空的光辉,是水天一色的白。学生读:绿遍山原白满川。教师读:杜鹃鸟在如烟的蒙蒙细雨中一声一声地啼叫。学生读:子规声里雨如烟。教师读:怎么四月的乡村不见人呢?原来是在干农活,才收了蚕桑丝,又去了稻田插秧。学生读:乡村四月闲人少,才了蚕桑又插田。这样可以让学生在理解诗歌意思的同时,记住诗句。
1.5 突变蛋白功能预测及致病性分级
使用在线软件Polyphen-2(http://genetics.bwh.harvard.edu/pph2/)、Mutation Taster(https://www.mutationtaster.org/)和Provean(http://provean.jcvi.org/index.php)分别对检测、筛选出的WNT10A 基因突变进行蛋白质功能预测和致病性评估。
1.6 保守性分析及蛋白结构预测
通过Uniprot 数据库(https://www.uniprot.org/)获得不同物种的Wnt10A 蛋白序列的FASTA 格式数据。使用在线软件T-Coffee(https://www.ebi.ac.uk/Tools/msa/tcoffee/)对检测出的Wnt10A 蛋白突变位点进行保守性分析。
6 例患者中,先证者#4 无恒牙,为Ⅲ型先天缺牙,即全口无牙症患者;先证者#208 上下颌仅各存留一颗恒磨牙。其余4 位先证者缺牙数目从6 ~14 颗不等。
通过在线软件Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对Wnt10A 蛋白进行同源建模,预测其三维结构。将模板导入到在线 软 件 Missense3D(http://missense3d.bc.ic.ac.uk/~missense3d/),预测位点突变后的Wnt10A 蛋白结构变化。
该故障案例中,已确认是动力电池内部局部损坏,因一时没有单体电池供应,只能更换动力电池总成,更换后该车故障排除。
1.7 种植修复设计与实施
针对患者的缺牙数目、部位、间隙、软硬组织缺损情况进行种植修复方案的设计。其中,对于无天然恒牙上颌或仅存留极个别畸形天然恒牙且伴有上颌骨发育性重度萎缩的患者进行颧种植修复。其余患者行常规种植修复。记录愈合期种植体成功率,同时在种植修复完成后,对患者进行定期随访,记录种植体的留存率及相关并发症。
2 结 果
2.1 突变位点检测及功能预测
梁、王两人寻碑、拓碑事俱见《嘉泰会稽志》卷十六《碑刻·秦颂德碑》。也可以参考绍兴丛书第一辑(地方志丛编①)〔M〕,北京:中华书局,2006,307。
目前,Clinvar 数据库(https://www.ncbi.nlm.nih.gov/clinvar)已收录了200 余种类型的WNT10A 基因突变,新的WNT10A 基因突变仍有待发现以丰富突变谱,为产前诊断和遗传诊断提供新的证据。本研究拟对近年来在临床治疗中收集到的重度先天缺牙患者进行WNT10A 基因突变筛查以发现新突变,并随访观察其中这类患者的种植修复疗效。

对6 位先证者的家系中可获得的成员进行WNT10A 基因突变检测,可发现有4 位先证者的母亲或父亲能检测到与先证者一致的WNT10A 基因突变(图1)。
本研究纳入6 例无血缘关系的WNT10A 基因突变的重度先天缺牙患者,分别携带5 个WNT10A基因突变,包括3 个错义突变、1 个无义突变和1 个移码突变。其中,先证者#184 和#203 携带相同的WNT10A 基因突变c.1036delT(p.Cys346fs)。在检出的5 种突变中,有2 种为未见报道的新检出突变。综合运用Polyphen-2、Mutation Taster 和Provean预测突变蛋白的功能影响,发现这些突变表现出一定程度的致病性(表1)。

2.2 突变位点的保守性分析和蛋白结构预测
在系统评估患者余留牙和牙槽骨情况后,先证者#4 无恒牙,为全口无牙患者,上颌采用双侧颧种植植入,结合前牙区4 枚常规种植体共同行使功能,下颌共计植入5 枚常规种植体行种植体支持固定修复;先证者#208 上下颌仅各存留一枚恒磨牙,上颌采用双侧双颧种植修复,下颌植入5 枚常规种植体,术后实施了上下颌即刻负载,骨结合后行上下颌种植固定修复。先证者#118、#32 和#208 都通过正畸调整了缺牙间隙,共植入13 枚常规种植体,种植区域均分期或同期实施了骨增量手术(图3)。种植体骨结合愈合期未出现植体松动、失败,所有患者均按计划完成上部结构修复。

2.3 患者的临床表型分析
本研究纳入的6 例患者中,有5 例表现为单纯的口内多数恒牙先天缺失。值得注意的是,先证者#4 除典型的多数牙缺失外,还表现出皮肤干燥和指甲发育不良等轻微的外胚层发育不良症状。患者均未表现出牙齿形态异常。
在农村地籍调查实际工作中,存在土地坐落、房屋坐落和通讯地址3个需要填写地址的字段,作业人员有时会误把身份证件上的地址填写为土地坐落和房屋坐落的位置。如身份证件上的地址为天河区,宗地和房屋却在从化区的情况。通过土地和房屋坐落检测功能,实现快速、准确的检查出类似错误,并导出为Excel表。
本研究中有5 位WNT10A 基因新突变患者接受了种植修复治疗,共植入27 枚常规种植体和6 枚颧种植体。
6 例患者恒牙平均缺牙数目为(15.33 ± 8.64)颗(6 ~28 颗),其中上颌平均缺牙数目为(8 ±3.95)颗(4 ~14 颗),下颌平均失牙数目为(7.30 ±4.97)颗(2 ~14 颗)。上颌牙列中,尖牙缺失率最高,为100%,中切牙缺失率最低,为33.33%(4/12);下颌牙列中,中切牙、侧切牙和第二磨牙缺失率最高,为66.67%(8/12),第一磨牙缺失率最低,为25%(3/12)(表2)。

2.4 种植修复
由于环境中Na和Ca含量高,样品处理过程中非常容易沾污。因此,超纯水需要使用现接的水,样品前处理与相应的测定也需尽快完成。
对检测出的3 个WNT10A 基因错义突变位点进行保守性分析,发现这些位点在不同物种间均高度保守。选择同源性置信度大于90%的结构域模板,对错义突变p.Ile122Phe 和p.Thr357Ile 进行蛋白三维结构预测分析,发现氨基酸的替换使蛋白构象发生了改变(图2)。
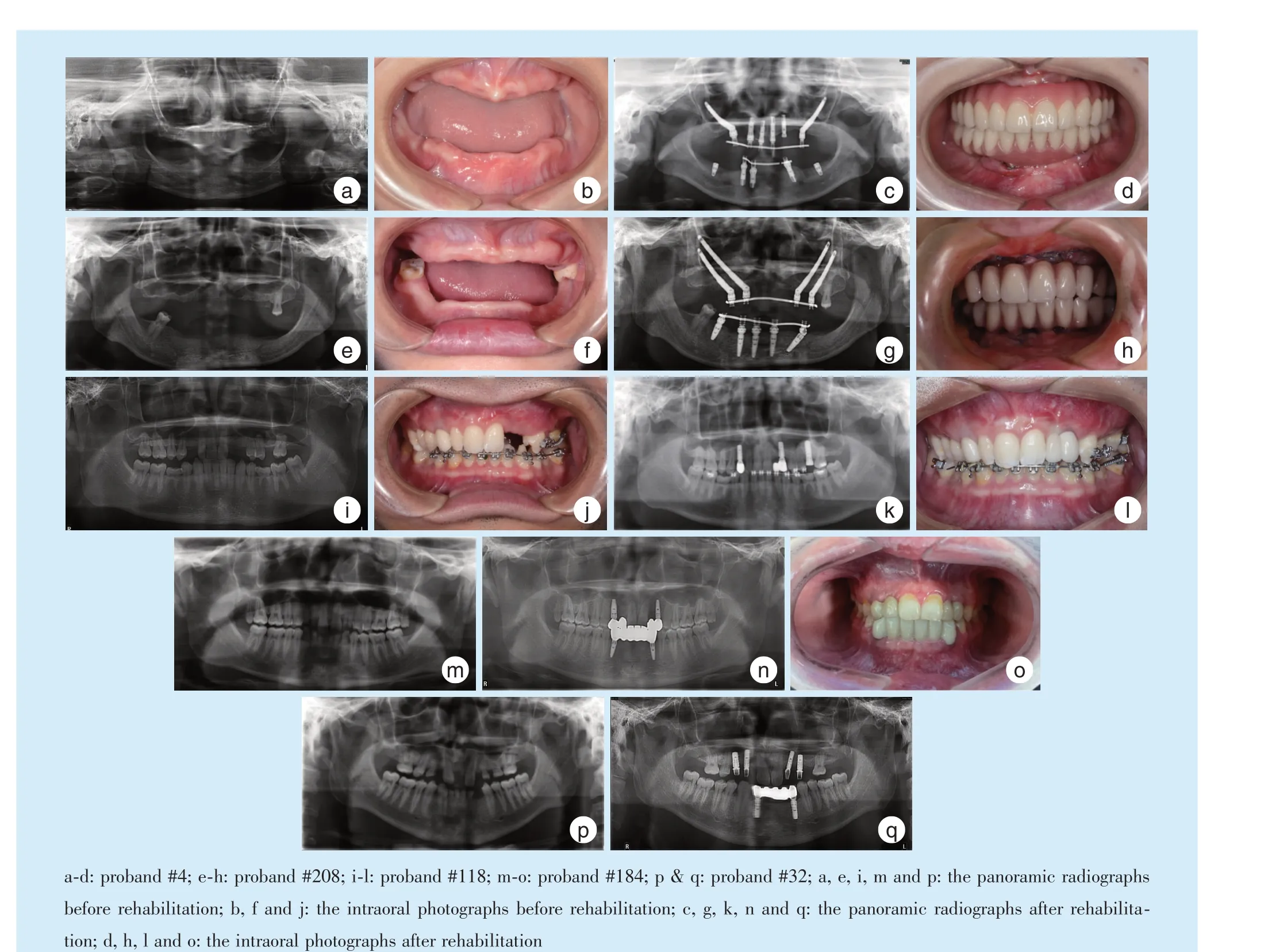
本研究中随访时间最长为先证者#4,随访时间为8 年。其余患者随访时间3 至30 个月不等。随访期内,6 枚颧种植体未发生机械、生物学及上颌窦相关的并发症。27 枚常规种植体均无松动,种植体与上部修复体均在位,能行使有效功能,但有3 枚常规植体出现了不同程度的边缘骨吸收(1.5 ~3 mm)(图4)。

3 讨 论
哺乳动物的牙齿发育始于位置和类型的确定,随后经过牙板形成、蕾状期、帽状期和钟状期等不同的形态阶段,最终完成牙根的形成和牙齿的萌发。上皮和间充质之间有序的相互作用调控着牙齿发育的整个进程,在此期间出现的异常会导致牙齿的缺失。分子遗传学和动物模型的相关研究已经证实WNT10A 基因在胚胎发育中起着重要作用,调控了帽状期早期的牙齿发育
。
在本研究纳入的6 例患者中,平均缺牙数目为(15.33 ± 8.64)颗。其中缺失率最高的牙位为上颌尖牙,6 例患者一共缺失了12 颗上颌尖牙,缺失率达到100%;缺失率最低的牙位为下颌第一磨牙,6 例患者一共缺失了3 颗下颌第一磨牙,缺失率达到25%。Van Den Boogaard 等
分析了WNT10A 基因突变的19 例非综合征型的先天缺牙患者和11 例有轻微外胚层发育不良的患者的缺牙表型,两类患者平均缺牙数分别为15.6 颗和15.4 颗(包括第三磨牙)。Zhou 等
分析了74 例WNT10A 基因突变的非综合征型缺牙患者和28 例WNT10A 基因突变的综合征型缺牙患者,患者平均缺牙数为(13.0 ± 6.2)颗。其中,上颌第二前磨牙缺失率最高,上颌中切牙缺失率最低。Van Den Boogaard等
还发现,缺牙数超过20 颗的重度缺牙患者中,WNT10A 基因既可能是纯合突变,也可能是杂合突变。所有纳入患者中,缺牙数最大为30 颗,是一位WNT10A 基因纯合无义突变p.C107X 的患者;缺牙数最小为6 颗,是一位WNT10A 基因双等位基因突变患者,包括杂合无义突变p.C107X 和杂合错义突变p.F228I,该患者同时伴有指甲发育不良和毛发轻微卷曲的外胚层症状。在Zhou 等
的研究中,缺牙数超过20 颗的患者为WNT10A 基因纯合缺失突变或复合杂合错义突变。而在本研究中,缺牙数超过20 颗的患者均为WNT10A 基因纯合错义突变,这说明还需纳入更多的相关病例,以更好地分析WNT10A 基因突变类型与缺牙表型的关系。
外胚层发育不良综合征(ectodermal dysplasia)是一类以出现两种及两种以上外胚层结构发育异常为临床特征的遗传性疾病。少汗型外胚层发育不良综合征(hypohidrotic ectodermal dysplasia,HED)是外胚层发育不良综合征最常见的亚类之一,表现为牙发育异常(先天缺牙)、毛发稀少、少汗或无汗等,包括前额凸出、鞍鼻、嘴唇外翻等面部畸形也常与上述临床三联征伴随出现。HED 被报道最多的为EDA1 基因突变导致的x 连锁遗传病例
;EDA1 基因编码外异蛋白,属于肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员。编码外异蛋白受体的EDAR 基因和编码EDAR 相关死亡结构域的EDARADD 基因的突变也已被证明会导致常染色体显隐性遗传的HED
。上述3 种形式的HED 的表型在临床上难以区分,可能是因为3 个基因处于同一条信号转导途径,该通路已被证实在皮肤附件的发生、形成和分化过程中起着非常重要的作用
。
Cluzeau 等
在65 例外胚层发育不良的患者中,发现有WNT10A 基因突变的患者也表现出HED 的表型,证明了WNT10A 基因的突变也会导致常染色体隐性和显性遗传的HED。有趣的是,大多数携带WNT10A 基因突变的HED 患者相比于携带EDA 基因突变的患者,皮肤及其附件(如毛发和汗腺)的异常程度更轻,且未见面部畸形。在此之前,已有相当多的文献报道了WNT10A 突变导致的常染色体隐性遗传的外胚层发育不良疾病,除了非综合征型的4 型选择性先天缺牙(selective tooth agenesis 4,STHAG4),还包括牙-指-真皮发育不良(odonto-onycho-dermal dysplasia,OODD)和Schopf-Schulz-Passarge 综合征(SSPS)
。在本研究中,一例患者除了牙齿缺失,还出现皮肤干燥、指甲发育不良等较轻微的外胚层发育不全的表型,再次证明了Wnt/β-catenin 信号通路对外胚层发育也起着重要的作用。经典的Wnt 信号通路被认为在成骨过程中也起着重要的调控作用
。成骨细胞来源于未分化的间充质细胞,具有多向分化潜能;除了骨细胞,也可分化成为软骨细胞、脂肪细胞、肌细胞和成纤维细胞。Wnt 蛋白通过抑制成骨前体细胞凋亡,从而促进成骨细胞分化。动物实验研究发现,Wnt10B 可以促进小鼠的成骨和骨量增加
。体外细胞实验研究发现,Wnt6、Wnt10A和Wnt10B 可以抑制间充质干细胞向脂肪细胞的分化,并通过典型的Wnt 通路促进间充质干细胞向成骨细胞的分化
。而在本研究纳入的WNT10A基因发生突变的患者中,种植体与颌骨、颧骨的愈合期骨结合似乎未受到影响。这可能存在两方面原因,一方面,Wnt 家族的其他蛋白可以正常地行使功能并通过经典通路调控成骨;而另一方面,颅颌面骨与长骨的成骨方式不同,细胞来源也有差异,可能存在着不同的调控骨代谢的方式
。但值得注意的是,这类患者植入常规种植体后出现边缘骨吸收的风险。一方面可能与这类患者自身牙槽骨发育较差,骨弓轮廓属于不利型植骨居多有关;另一方面,种植体在这类遗传性骨代谢通路可能受到影响的患者上的长期表现仍需要大样本的继续观察随访。
对于重度先天缺牙甚至全口无牙的患者,牙齿的缺失同时还伴随着牙槽骨的严重萎缩。相较于进行大范围的骨增量手术,颧种植治疗具有创伤更小、治疗周期加快、可即刻负荷等优点,是解决该类上颌骨严重萎缩患者功能重建的有效办法。在本研究中,对一例前牙区尚有一定骨量的患者进行了双侧单颧种植修复,对一例前牙区剩余骨量已经不足以放置常规种植体的患者进行了双侧双颧种植修复。随访期间显示两位患者的颧种植体骨结合良好,修复体能正常行使功能,成功地解决了患者的咀嚼、发音和美观问题。
综上,本研究丰富了严重先天缺牙患者的WNT10A 基因突变谱,为遗传诊断和产前咨询提供了新的证据。同时,对患者进行的相关治疗证实了种植治疗能有效地对患者进行功能修复。WNT10A 基因突变类型与患者缺牙表型的关系尚未明确,未来还需要更多的病例和相关研究,以更好地助益临床治疗。
【
】 Jiang XK analyzed the data and wrote the article. Kang Y collected the data. Zhou MQ collected the references.Wu YQ and Wang F designed the study and revised the article. All authors read and approved the final manuscript as submitted.
[1] Yin W,Bian Z.The gene network underlying hypodontia[J].J Dent Res,2015,94(7):878-885.doi:10.1177/0022034515583999.
[2] Ye X, Attaie AB. Genetic basis of nonsyndromic and syndromic tooth agenesis[J]. J Pediatr Genet, 2016, 5(4): 198 - 208. doi:10.1055/s-0036-1592421.
[3] Yu T, Klein OD. Molecular and cellular mechanisms of tooth development, homeostasis and repair[J]. Development, 2020, 147(2):dev184754.doi:10.1242/dev.184754.
[4] Jensen JM, Skakkebæk A, Gaustadness M, et al. Familial colorectal cancer and tooth agenesis caused by an AXIN2 variant:how do we detect families with rare cancer predisposition syndromes?[J].Fam Cancer,2021.doi:10.1007/s10689-021-00280-y.
[5] Yu K, Shen Y, Jiang CL, et al. Two novel ectodysplasin A gene mutations and prenatal diagnosis of X-linked hypohidrotic ectodermal dysplasia[J]. Mol Genet Genomic Med, 2021, 9(11): e1824.doi:10.1002/mgg3.1824.
[6] Andreoni F, Sgattoni C, Bencardino D, et al. Missense mutations in EDA and EDAR genes cause dominant syndromic tooth agenesis[J]. Mol Genet Genomic Med, 2021, 9(1): e1555. doi: 10.1002/mgg3.1555.
[7] Adachi J, Aoki Y, Tatematsu T, et al. Novel MSX1 frameshift mutation in a Japanese family with nonsyndromic oligodontia[J].Hum Genome Var,2021,8(1):29.
[8] Zheng J, Yu M, Liu H, et al. Novel MSX1 variants identified in families with nonsyndromic oligodontia[J].Int J Oral Sci, 2021,13(1):2.doi:10.1038/s41368-020-00106-0.
[9] Jia S,Oliver JD,Turner EC,et al.Pax9's interaction with the ectodysplasin signaling pathway during the patterning of dentition[J].Front Physiol,2020,11:581843.doi:10.3389/fphys.2020.581843.
[10] Safari S, Ebadifar A, Najmabadi H, et al. Screening PAX9, MSX1 and WNT10A mutations in 4 iranian families with non-syndromic tooth agenesis[J]. Avicenna J Med Biotechnol, 2020, 12(4): 236-240.
[11] Doolan BJ, Onoufriadis A, Kantaputra P, et al. WNT10A, dermatology and dentistry[J]. Br J Dermatol, 2021, 185(6): 1105-1111.doi:10.1111/bjd.20601.
[12] Xiong Y,Fang Y,Qian Y,et al.Wnt production in dental epithelium is crucial for tooth differentiation[J]. J Dent Res, 2019, 98(5):580-588.doi:10.1177/0022034519835194.
[13] Zhang Z,Pan X,Chen M,et al.Wnt signalling in oral and maxillofacial diseases[J]. Cell Biol Int, 2022, 46(1): 34-45. doi: 10.1002/cbin.11708.
[14] Grumolato L, Liu G, Mong P, et al. Canonical and noncanonical Wnts use a common mechanism to activate completely unrelated coreceptors[J].Genes Dev,2010,24(22):2517-2530.doi:10.1101/gad.1957710.
[15] Yu M, Liu Y, Liu H, et al. Distinct impacts of bi-allelic WNT10A mutations on the permanent and primary dentitions in odonto-onycho-dermal dysplasia[J].Am J Med Genet A, 2019,179(1):57-64.doi:10.1002/ajmg.a.60682.
[16] Martínez-Romero MC, Ballesta-Martínez MJ, López-González V,et al. EDA, EDAR, EDARADD and WNT10A allelic variants in patients with ectodermal derivative impairment in the Spanish population[J]. Orphanet J Rare Dis, 2019, 14(1): 281. doi: 10.1186/s13023-019-1251-x.
[17] Yu M, Wong SW, Han D, et al. Genetic analysis: Wnt and other pathways in nonsyndromic tooth agenesis[J]. Oral Dis, 2019, 25(3):646-651.doi:10.1111/odi.12931.
[18] Yuan Q, Zhao M, Tandon B, et al. Role of WNT10A in failure of tooth development in humans and zebrafish[J]. Mol Genet Genomic Med,2017,5(6):730-741.doi:10.1002/mgg3.332.
[19] Zhao K, Lian M, Zou D, et al. Novel mutations identified in patients with tooth agenesis by whole-exome sequencing[J].Oral Dis,2019,25(2):523-534.doi:10.1111/odi.13002.
[20] Yu M, Liu Y, Wang Y, et al. Epithelial Wnt10a is essential for tooth root furcation morphogenesis[J].J Dent Res,2020,99(3):311-319.doi:10.1177/0022034519897607.
[21] Kornsuthisopon C,Photichailert S,Nowwarote N,et al.Wnt signaling in dental pulp homeostasis and dentin regeneration[J]. Arch Oral Biol, 2022, 134: 105322. doi: 10.1016/j.archoralbio.2021.105322.
[22] Van Den Boogaard MJ, Créton M, Bronkhorst Y, et al. Mutations in WNT10A are present in more than half of isolated hypodontia cases[J]. J Med Genet, 2012, 49(5): 327-331. doi: 10.1136/jmedgenet-2012-100750.
[23] Zhou M, Zhang H, Camhi H, et al. Analyses of oligodontia phenotypes and genetic etiologies[J].Int J Oral Sci, 2021,13(1):32.doi:10.1038/s41368-021-00135-3.
[24] Cai Z,Deng X,Jia J,et al.Ectodysplasin A/ectodysplasin A receptor system and their roles in multiple diseases[J]. Front Physiol,2021,12:788411.doi:10.3389/fphys.2021.788411.
[25] Ahmed HA, El-Kamah GY, Rabie E, et al. Gene mutations of the three ectodysplasin pathway key players (EDA, EDAR, and EDARADD)account for more than 60%of Egyptian ectodermal dysplasia: a report of seven novel mutations[J]. Genes (Basel), 2021, 12(9):1389.doi:10.3390/genes12091389.
[26] Cluzeau C, Hadj-Rabia S, Jambou M, et al. Only four genes(EDA1,EDAR,EDARADD,and WNT10A)account for 90%of hypohidrotic/anhidrotic ectodermal dysplasia cases[J]. Hum Mutat,2011,32(1):70-72.doi:10.1002/humu.21384.
[27] Maeda K,Kobayashi Y,Koide M,et al.The regulation of bone metabolism and disorders by Wnt signaling[J].Int J Mol Sci,2019,20(22):5525.doi:10.3390/ijms20225525.
[28] Sun Y, Li J, Xie X, et al. Recent advances in osteoclast biological behavior[J]. Front Cell Dev Biol, 2021, 9: 788680. doi: 10.3389/fcell.2021.788680.
[29] Hardeland R. Melatonin and the programming of stem cells[J]. Int J Mol Sci,2022,23(4):1971.doi:10.3390/ijms23041971.
[30] De Souza FA, Schoenmaker T, Azari A, et al. Jaw and long bone marrows have a different osteoclastogenic potential[J]. Calcif Tissue Int,2011,88(1):63-74.doi:10.1007/s00223-010-9418-4.
