常规超声、超声弹性成像和经皮超声造影在乳腺癌前哨淋巴结诊断中的价值比较
2022-07-19张海见贾志莺武秀兰冷晓玲
葛 妍,张海见,张 媛,贾志莺,武秀兰,冷晓玲
新疆医科大学附属肿瘤医院超声科,新疆 乌鲁木齐830011
乳腺癌是女性最常见的恶性肿瘤[1-2],近年来其发病率呈逐年上升趋势,占女性癌症患者的30%[3-4]。我国每年约有27万名女性被诊断为乳腺癌,其中7万人死于乳腺癌[5]。而据2019年世界癌症统计,早诊早治可将5年生存率提高至89%[6]。前哨淋巴结(SLN)是乳腺癌发生转移的第一站淋巴结[7],目前乳腺癌手术多采用术中前哨淋巴结清扫术,后期患者会引起麻木、疼痛、肩关节活动受限、上肢淋巴水肿等术后并发症。术前若能有效评估SLN是否为转移性淋巴结,可避免术中淋巴结清扫,减少术后并发症的发生,提高患者的生活质量[8-9]。
常规二维超声虽能显示淋巴结的形态、结构、大小及血流等一般情况,但对转移性淋巴结、前哨淋巴通道(SLCs)、SLN的位置及数量的检查效力不足[10]。压力性弹性成像技术主要是通过组织软硬程度评估疾病性质[11]。由于癌转移性淋巴结受肿瘤细胞侵袭影响,改变淋巴结组织结构,致使淋巴结硬度增加,故可通过弹性成像技术(UE)间接了解组织硬度信息,从而判定乳腺癌病灶腋窝淋巴结的转移情况[12-13]。超声造影对淋巴结内微小血管及低血流显示敏感度较高,通过淋巴结内血流灌注情况判断淋巴结的良恶性并确定SLCs和SLN[14]。因此,UE和经皮超声造影(CEUS)可对常规二维超声进行有力的补充。既往国内大部分是通过常规超声、CEUS、UE或者其中两者的联合对乳腺癌前哨淋巴结的研究,而三者联合检查评估乳腺癌前哨淋巴结的研究较少。本研究拟探讨三者联合诊断,即通过术前常规二维超声检查、UE检测SLN的硬度、CEUS显示SLN的灌注方式并确定SLCs和SLN,结合穿刺活检明确病理性质,取长补短、多角度评估三者联合诊断对乳腺癌前哨淋巴结转移的诊断价值,为临床防治提供更多参考。
1 资料与方法
1.1 一般资料
选取2020年6月~2021年12月在我院进行检查的乳腺癌患者158例共206枚SLN作为观察对象,年龄37~65(49±6)岁。纳入标准:腋窝淋巴结未触及肿大;未完成乳腺肿块穿刺及新辅助化疗;无造影剂过敏史。排除标准:腋窝淋巴结可触及肿大;造影剂过敏者。本研究通过我院医学伦理审查,并获得患者及家属的知情同意。
1.2 仪器与方法
本研究使用GE logiq E9彩色多普勒超声诊断仪,探头型号LA523,频率5~12 MHz。造影剂为Sonovue(Bracco)。患者取平卧位,双臂张开上举放于头部并呈90°,充分暴露乳房和双侧腋窝。
常规二维超声:观察并记录淋巴结的形态、结构、大小及血流。
UE:常规超声最大长轴切面应用压力性弹性成像技术,弹性图相框面积在感兴趣区应超过病灶1.5~2倍,将探头垂直于淋巴结,压力指标设为3~4为宜[15]。注意避开血管及肌肉,获得反映组织硬度的伪彩色弹性图像,采用彩色显示方式:弹性系数小的组织受压后位移变化大,显示为红色;弹性系数大的组织受压后位移变化小,显示为蓝色,弹性系数中等的组织显示为绿色,以色彩对不同组织的弹性编码来反映组织硬度。
CEUS:经常规及UE扫描后,对患侧乳晕区进行消毒,将配好的声诺维混悬液于乳晕区皮下4个方向(3点、6点、9点、12点)各注射0.5 mL并轻柔注射部位15~20 s。自乳晕区向腋尾区扫查,寻找显影的淋巴管及造影剂汇聚的SLN。一般淋巴池造影剂汇聚处无淋巴结结构[16-17]。SLN通常是第一个显影的淋巴结,记录其部位、大小、数量及灌注模式,并标记SLCs及SLN的体表位置。
1.3 图像分析
常规二维超声、UE及CEUS的SLN检测质控均由2名经验丰富的副主任医师或高年资主治医师进行。
1.4 观察指标
常规二维超声诊断SLN转移:(1)淋巴结构消失或疏松;(2)淋巴结纵横比<2;(3)淋巴结皮质多增厚宽松;(4)淋巴结表现为内部回声不均匀。符合2条,即可判断为阳性。
UE:采用5分法:1分:病灶基本或是完全呈绿色;2分:病灶周围为绿色,内部呈蓝色;3分:病灶内部蓝色与绿色占比相等;4分:病灶内部少许绿色或整体呈蓝色;5分:病灶及周围区域均呈蓝色。良性淋巴结多呈绿色或蓝绿相间,转移性淋巴结多呈蓝色。因此,将≥4分的淋巴结诊断为转移性淋巴结,将<4分的淋巴结诊断为良性淋巴结,判定结果与既往研究[18]相一致。
CEUS:将增强模式分为4型。I 型:完全均匀增强型(图1 A);Ⅱ型:周边及髓质均匀增强型(图1 B);Ⅲ型:周边和(或)髓质不均匀增强型(图1 C);Ⅳ型:无增强型(图1 D)。将I、Ⅱ型的SLN诊断为良性淋巴结,将Ⅲ、Ⅳ型的SLN诊断为转移性淋巴结,评价其诊断效能。

图1 乳腺癌前哨淋巴结CEUS高峰期特征分型Fig.1 Sentinel lymph node of breast cancer with CEUS peak characteristic classification.
1.5 统计学分析
采用SPSS20.0软件进行统计分析,计数资料以n(%)表示,组间比较采用χ2检验。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。采用Kappa检验评价诊断一致性:Kappa<0.4时,表明一致性较差;0.4<Kappa≤0.6时,表明中等一致性;0.6<Kappa≤0.8时,表明有较高一致性;Kappa>0.8时,表明有极好一致性。以病理诊断为金标准,绘制ROC曲线,计算曲线下面积,分析UE、CEUS及联合方法诊断乳腺癌SLN转移的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 常规二维超声、UE及CEUS对SLN的病理检测结果比较
158例乳腺癌患者中,依据病理诊断,共检出206个淋巴结,转移性SLN76个,非转移性SLN130个(表1);常规二维超声共检出转移性SLN59 个,非转移性SLN147个;弹性成像共检出转移性SLN67个,非转移性SLN139个;CEUS共检出转移性SLN70个,非转移性SLN136个;三者联合共检出转移性SLN72个,非转移性SLN134个。常规二维超声、UE、CEUS及三者联合检查与病理结果一致性进行比较(Kappa=0.683、0.828、0.884、0.937,P<0.05),UE、CEUS的一致性均高于常规二维超声,三者联合诊断的一致性最好。
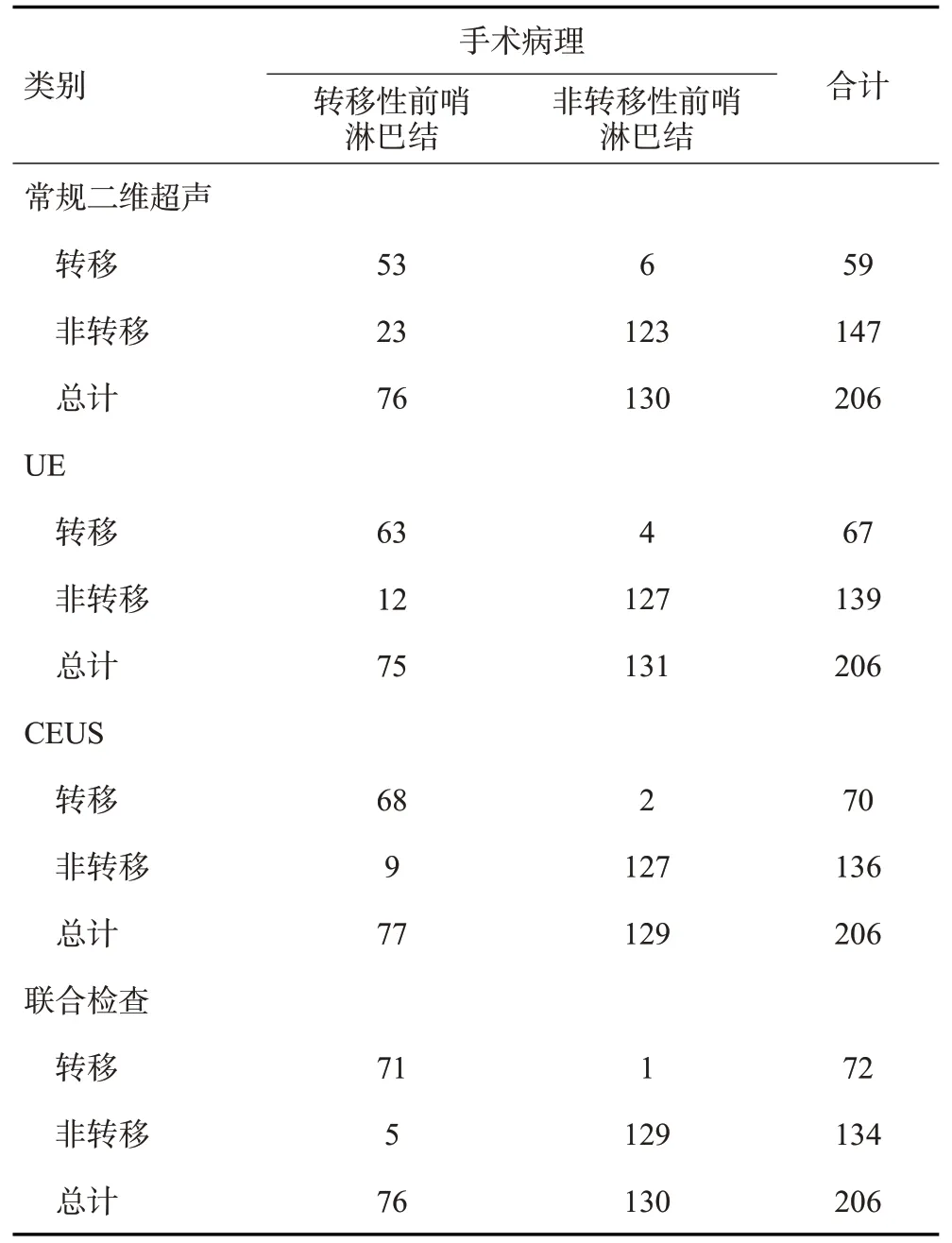
表1 病理检测、常规二维超声、UE、CEUS的诊断结果比较Tab.1 Comparison of diagnostic results of pathological examination,conventional two-dimensional ultrasound,elastography and CEUS(n)
2.2 SLN的经皮CEUS增强模式与病理结果对照
CEUS将增强模式分为4型(图1),其中I型转移性淋巴结0个,非转移性淋巴结77个;Ⅱ型转移性淋巴结6个,非转移性淋巴结37个;Ⅲ型转移性淋巴结36个,非转移性淋巴结19个;Ⅳ型转移性淋巴结28个,非转移性淋巴结3个。非转移性淋巴结多以I型为主,II型次之;转移性淋巴结多以III型为主,IV型次之。良性与转移性淋巴结中4 种类型的分布差异有统计学意义(P<0.05)。I、II型间及III、IV型间比较,差异无统计学意义(P>0.05);II、III型间的差异有统计学意义(P<0.05),验证了前期研究结果。乳腺癌前哨淋巴结UE及CEUS图像(图2)。

图2 乳腺癌前哨淋巴结UE及CEUS图像Fig.2 Images of sentinel lymph nodes with breast cancer by elastography and CEUS.
2.3 常规二维超声、UE及CEUS对乳腺癌SLN的诊断价值
ROC曲线分析显示:三者及三者联合诊断SLN转移的AUC分别为0.668、0.712、0.738、0.756,95%CI分别为0.595~0.741、0.643~0.781、0.671~0.805、0.692~0.821。以ROC曲线靠左上方约登指数的最大切面作为最佳临界值,该点预测敏感度、特异性、准确度:常规二维超声为69.7%、94.6%、85.4%;UE为84.0%、96.9%、92.2%;CEUS 为88.3%、98.4%、94.7%;联合诊断为93.4%、99.2%、97.1%,提示联合诊断价值均高于单项检测(图3)。
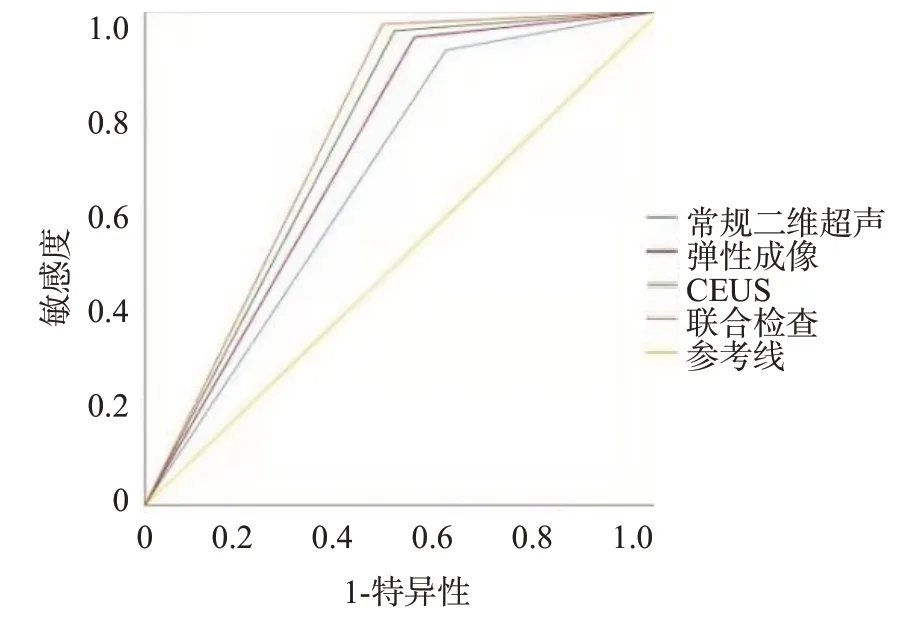
图3 常规二维超声、UE、CEUS及联合检查对乳腺癌前哨淋巴结的ROC曲线Fig.3 ROC curves of sentinel lymph nodes of breast cancer by conventional two-dimensional ultrasound,elastography,CEUS and combined examination.
3 讨论
前哨淋巴结活检术是目前国内外乳腺外科医师探索的腋窝淋巴结手术管理办法,但对于未发生淋巴转移的患者清扫淋巴结会引起麻木、疼痛、肩关节活动受限、上肢淋巴水肿等术后并发症,导致患者生活质量下降,故术前精准判定前哨淋巴结性质及位置,可以为外科术式的选择及是否行术后辅助化疗提供依据。超声用于术前淋巴结诊断已被临床认可,常规超声可以直观展现患者淋巴结的状态,但对转移性淋巴结、前哨淋巴通道(SLCs)、SLN 的位置及数量的检查效力不足。由于CEUS及UE等超声新技术的发展,常规超声联合多种新的超声诊断手段应用于乳腺癌前哨淋巴结术前评估的需求迫在眉睫[19]。
UE可以直观地显示组织硬度,从而进行疾病的诊断[20-21]。本研究显示,UE与乳腺癌淋巴结转移的病理诊断结果一致性较好,提示其对诊断乳腺癌腋下阳性淋巴结转移价值较高,但不能判断其是否为前哨淋巴结,仍需在造影的基础上对前哨淋巴结进行诊断[22]。但在部分类型的乳腺癌如髓样癌等病变部位硬度较低,相应的淋巴结硬度也较低,导致假阴性发生;当淋巴结成分部分胶原化、钙化等组织变性或间质细胞丰富的良性病变时,可引起淋巴结变硬,导致假阳性的发生。因此,部分病变淋巴结由于其内部结构发生改变,导致弹性评分偏低或偏高时,可结合淋巴结的CEUS增强模式,对病变淋巴结进行最后的评估,从而避免UE导致的假阴性或假阳性的发生。
既往研究多将SLN的经皮CEUS增强模式提高了诊断的敏感度,但特异性较低[23],主要是因为有部分良性淋巴结也可有不均匀增强,从而错误地认为是阳性诊断[24]。有研究报道在不均匀增强中如果有边缘缺损则对判断淋巴结有无转移具有帮助性[25]。本研究为进一步探索SLN的增强模式与其病理性质的关系,在前期研究基础上把增强模式细分为四型,即完全均匀增强(I型)、周边及髓质均匀增强(II型)、周边和(或)髓质不均匀增强(III型)及无增强(IV型)。转移性SLN无一例表现为完全均匀增强的淋巴结,可见CEUS更能清楚显示彩色多普勒技术无法显示的淋巴结内微细血管分布与走向,这与既往研究结论一致[26-27]。非转移性SLN中有22例表现为III型、IV型,这可能由于组织反应性增生阻塞周边细小的淋巴管,导致淋巴结不均匀强化或无强化,同时也可能与注射造影剂的部位、按摩的力度等造成微泡造影剂不同程度的破坏,从而影响声像图的表现有关。
综上所述,本研究通过总结了乳腺癌患者SLN的特征表现,UE 可以间接反应SLN 的硬度,结合经皮CEUS声像图表现特点可反应淋巴结的灌注情况并可观察SLCs的走形,为乳腺癌SLN的定性及定位诊断提供了新的参考。在此基础上结合超声引导下粗针穿刺活检,检测SLN的敏感度为93.4%,特异性为99.2%,准确度为97.1%,具有较高临床实用价值,也是对常规二维超声的有力补充。常规超声联合UE及CEUS操作简单、经济,为临床乳腺癌患者SLN的定性及定位提供了新的方法。本研究后期拟继续通过收集更多的病例资料,总结出更严谨实用的SLN定性定位诊断标准。
