帕博利珠单抗联合诱导化疗、放疗对中晚期肺鳞癌患者有较好治疗效果
2022-07-19王新颖李家树靳卫权顾玉海
王新颖,李家树,靳卫权,顾玉海
连云港市第一人民医院1呼吸与危重症医学科,2消化内科,江苏 连云港 222000;3青海省人民医院呼吸与危重症医学科,青海 西宁810000
肺癌是死亡率较高的一种恶性肿瘤,主要包括非小细胞肺癌和小细胞肺癌,其中前者占比80%。肺鳞癌在非小细胞肺癌中占比约35%,多发于肺段支气管以上,以中央型较为多见,由于发病比较隐匿,很多患者在初诊时就已发展至中晚期,此时不适合采用手术治疗[1-3]。由于肺鳞癌独特的临床表现、病理表现及基因突变特征,其在诊治过程中与肺腺癌有明显的区别,治疗方法十分有限,以铂类为主的化疗和放疗是其主要治疗方法之一,但临床疗效仍不满意[4]。肿瘤的发生与进展与机体免疫有着密切的关系,因而免疫治疗在癌症中的治疗也占据重要地位。帕博利珠单抗是程序性细胞死亡受体-1(PD-L1)抑制剂,而PD-L1在机体中可降低免疫系统感应,使得肿瘤细胞免疫逃逸,加速肿瘤的进展,因而帕博利珠单抗可通过抑制PD-L1表达以激活T细胞的免疫反应,进而抑制肿瘤进展[5-6]。有研究显示,帕博利珠单抗联合卡培他滨、奥沙利铂能够明显提高进展期胃癌患者的临床疗效,降低化疗期间的毒副反应,提升患者的生存率[7];也有研究显示,食管鳞癌患者术前采用帕博利珠单抗联合培美曲塞、顺铂新辅助化疗,能显著提高疾病缓解率,下调血清肿瘤标志物水平,提高手术效果,改善预后[8]。但目前帕博利珠单抗联合诱导化疗、放疗的疗效及肺部CT表现还未在中晚期肺鳞癌患者中得到证实。本研究旨在探究帕博利珠单抗联合诱导化疗、放疗对中晚期肺鳞癌患者临床治疗效果及肺部CT表现的影响,以期为提高中晚期肺鳞癌的治疗效果提供临床数据和证据。
1 资料与方法
1.1 一般资料
选取2019年11月~2020年12月本院收治的中晚期肺鳞癌患者为研究对象。纳入标准:经病理或细胞学检查证实为肺鳞癌;TNM分期为Ⅲ~Ⅳ期;预计生存时间>6月;患者及家属签署知情同意书。排除标准:合并其它恶性肿瘤者;对本研究方案的药物过敏者;治疗前服用其它影响免疫力的药物;肝肾功能异常者。本研究最终共纳入80例,按随机数字表法将其分为对照组和观察组,40例/组,两组一般资料差异无统计学意义(P>0.05,表1)。本研究已通过我院伦理委员会审核。
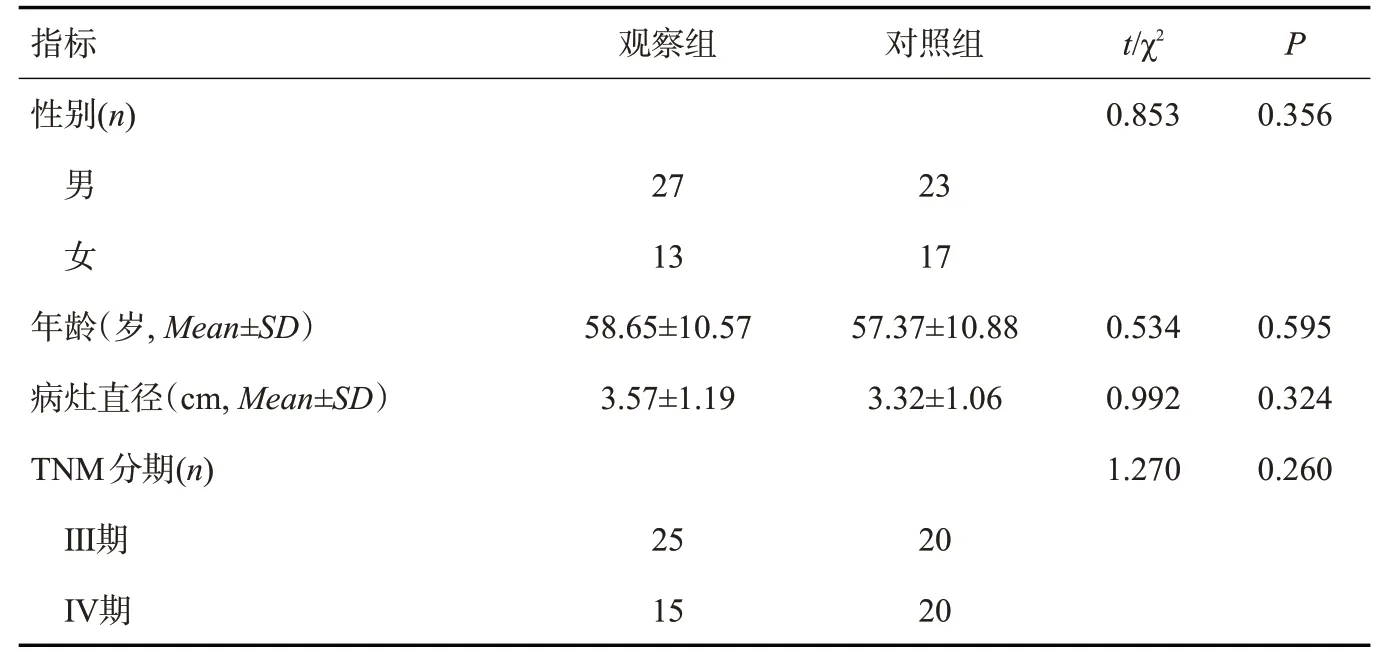
表1 两组一般资料比较Tab.1 Comparison of general data between two groups(n=40)
1.2 方法
1.2.1 对照组 对照组给予诱导化疗+放疗。诱导化疗:采用卡铂500~600 mg、紫杉醇175 mg/m2,3周为1个周期,诱导化疗2个周期后,给予患者三维适形调强放射治疗,设定5~7个照射野,逆向优化。大体肿瘤体积包括原发病灶和纵膈内每个直径>1 cm的淋巴结转移;临床靶体积由大体肿瘤体积外扩得出,为0.6 cm;计划靶体积为临床靶体积加上肿瘤运动范围及摆位误差,即5 mm,左右外扩1.0~1.5 cm,上下外扩1.5~2.5 cm,处方剂量为60~66 Gy(2 Gy/次),覆盖≥95%计划靶体积。放疗结束后再进行2个周期的诱导化疗。
1.2.2 观察组 观察组在对照组的基础上给予帕博利珠单抗注射液静脉注射,100~200 mg/次,3周/次,共使用4个周期。
1.3 观察指标
1.3.1 临床疗效 参照《实体瘤疗效评价标准的研究进展》[9]制定评估标准,完全缓解(CR):肿瘤病灶完全消失,维持时间至少超过1月;部分缓解(PR):病灶缩小体积达50%,维持时间至少超过1月;病变稳定(SD):病灶缩小不超过50%,增大不超过25%,且无新病灶出现;病变进展(PD):病灶无减少,病灶体积增加超过25%,或有新病灶出现。客观缓解率=(CR+PR)/总例数,疾病控制率=(CR+PR+SD)/总例数。
1.3.2 肺部CT 检查前8 h禁食,6 h禁饮,采用64排CT扫描机进行检查。取患者仰卧位,将80~100 mL碘佛醇经肘静脉团注,然后进行扫描。肺窗、窗宽1200~1500 Hu、窗位-500~-400 Hu;纵膈窗,窗宽350~400 Hu、窗位-40~-50 Hu。扫描参数:螺距0.625 mm、层厚5 mm、间隔5 mm、扫描条件120 kV。扫描范围设置为自胸廓入口至肺下界。
1.3.3 T淋巴细胞亚群 采用流式细胞仪检测T淋巴细胞亚群,即CD3+、CD4+、CD8+、CD4+/CD8+比值。
1.3.4 肿瘤标志物水平 采集患者空腹静脉血,采用放射免疫分析法检测细胞角蛋白19 片段抗原21-1(CYFRA21-1)、癌胚抗原(CEA)、鳞状细胞癌相关抗原(SCC)。
1.3.5 不良反应 根据常见不良反应事件评价标准4.0版本(CTCAE v4.0)评价不良反应,主要包括肝功能异常、贫血、白细胞减少、恶心呕吐、乏力。
1.3.6 生命质量 采用健康调查简表(SF-36)[10]评估生命质量。量表包括躯体功能、躯体角色、身体疼痛、总健康状况、生命力、社会功能、情绪角色、心理健康8个领域,各领域条目之和为粗分,将粗分变换为0~100的标准分,标准分值越高,生命质量越好。
1.4 统计学分析
采用SPSS 22.0进行统计分析,计量资料以均数±标准差表示,组间比较行独立样本t检验,组内比较行配对样本t检验;计数资料以n(%)表示,组间比较行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效比较及肺部CT表现情况
观察组客观缓解率和疾病控制率均高于对照组(P<0.05,表2)。
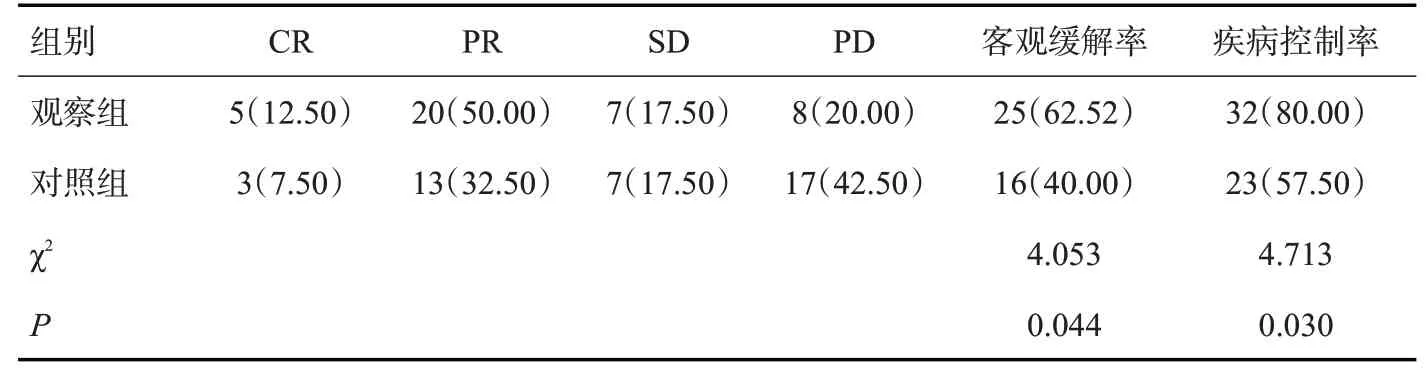
表2 两组临床疗效比较Tab.2 Comparison of clinical efficacy of the two groups[n=40,n(%)]
某男性患者的病理图(图1)及治疗周期中的胸部CT图显示,患者左肺病灶明显(图2);在进行1周期诱导化疗和免疫治疗后,病灶明显缩小(图3);2周期后,病灶进一步缩小(图4),此时临床疗效为PR;而后进行放疗,病灶缩小(图5),此时临床疗效为SD;然后再次进行2周期的诱导化疗和免疫治疗(图6),临床疗效仍为SD。
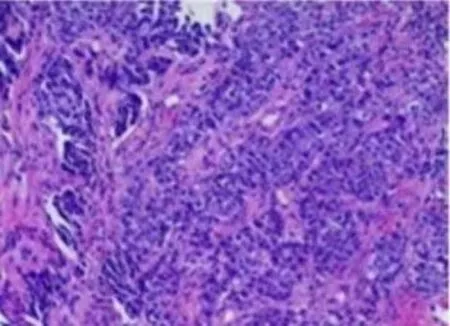
图1 某男性患者左肺鳞癌(T4N2M0 IIIB期)病理图Fig.1 Pathological picture of a male patient with left lung squamous cell carcinoma (T4N2M0 stage IIIB.HE staining,×100).
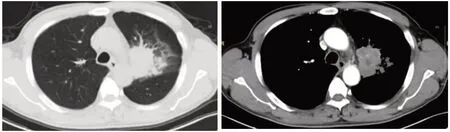
图2 治疗前初次就诊时胸部CT图Fig.2 Chest CT at the first visit before treatment.
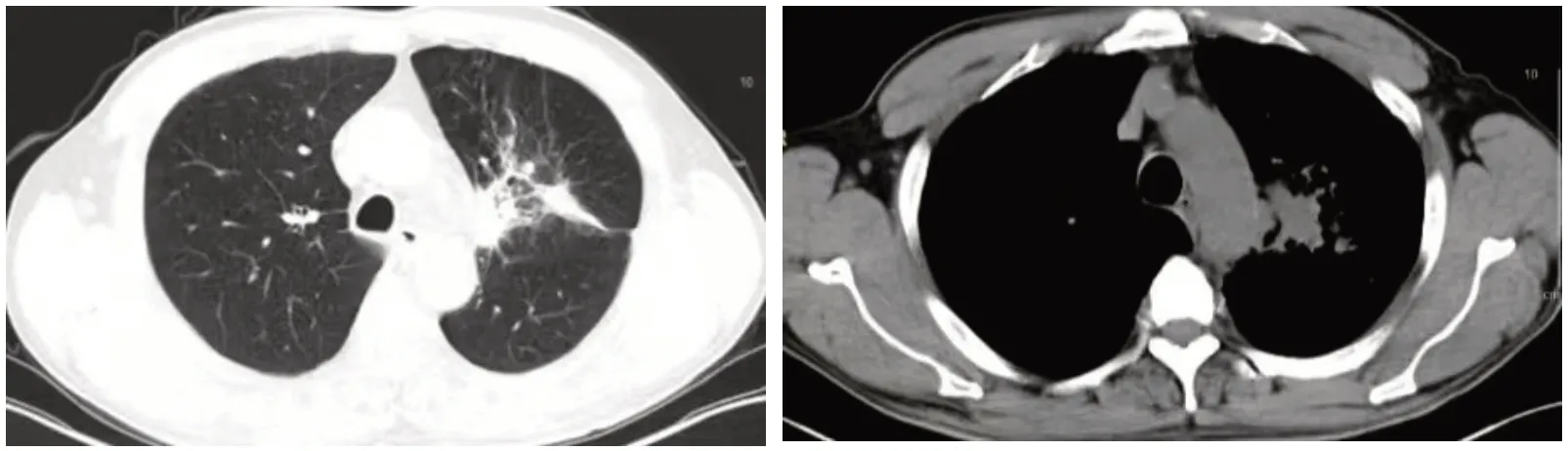
图3 诱导化疗和免疫治疗1周期后胸部CT图(病灶明显缩小)Fig.3 Chest CT after one cycle of induction chemotherapy and immunotherapy (the focus was significantly reduced).
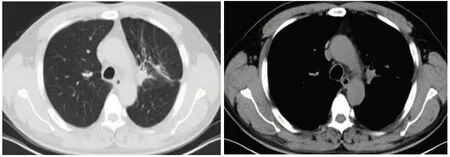
图4 诱导化疗和免疫治疗2周期后胸部CT图(病灶较之前缩小,PR)Fig.4 Chest CT after 2 cycles of induction chemotherapy and immunotherapy (lesions smaller than before,PR).
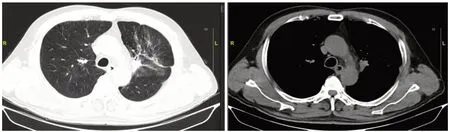
图5 治疗2周期后放疗后胸部CT图(SD)Fig.5 Chest CT(SD)after radiotherapy after 2 cycles of treatment.
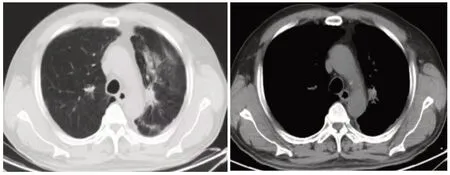
图6 放疗后再进行2周期的诱导化疗和免疫治疗的胸部CT图(SD)Fig.6 Chest CT (SD) of two cycles of induction chemotherapy and immunotherapy after radiotherapy.
2.2 T淋巴细胞亚群比较
治疗后,两组CD3+、CD4+、CD4+/CD8+比值均升高(P<0.05),CD8+降低(P<0.05),其中观察组CD3+、CD4+、CD4+/CD8+比值高于对照组(P<0.05),CD8+低于对照组(P<0.05,表3)。
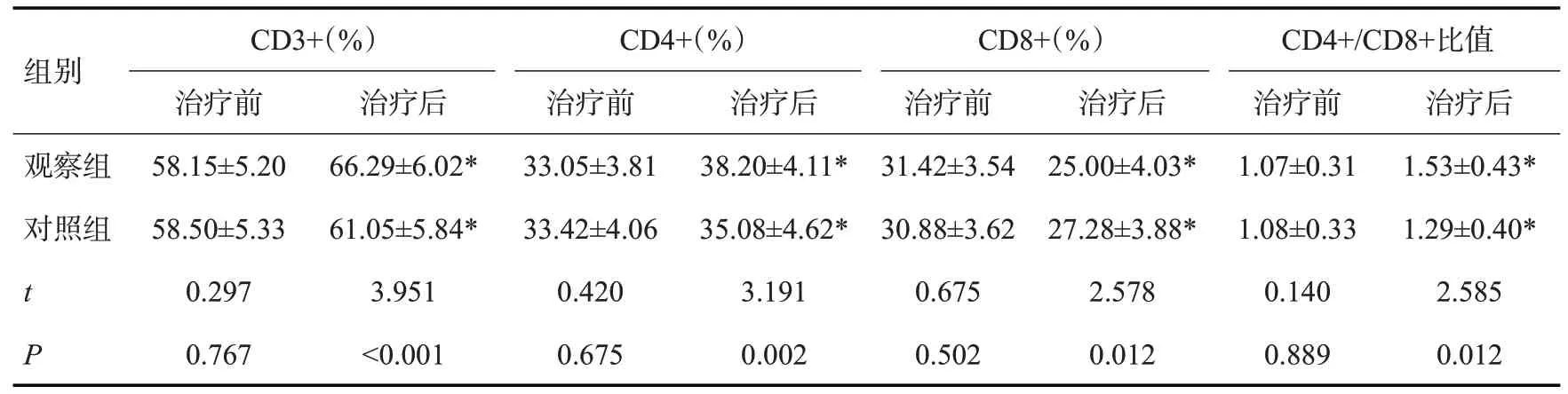
表3 两组T淋巴细胞亚群比较Tab.3 Comparison of T lymphocyte subsets between the two groups(n=40,Mean±SD)
2.3 血清肿瘤标志物比较
治疗后,两组CYFRA21-1、CEA、SCC水平均降低(P<0.05),其中观察组上述指标水平均低于对照组(P<0.001,表4)。
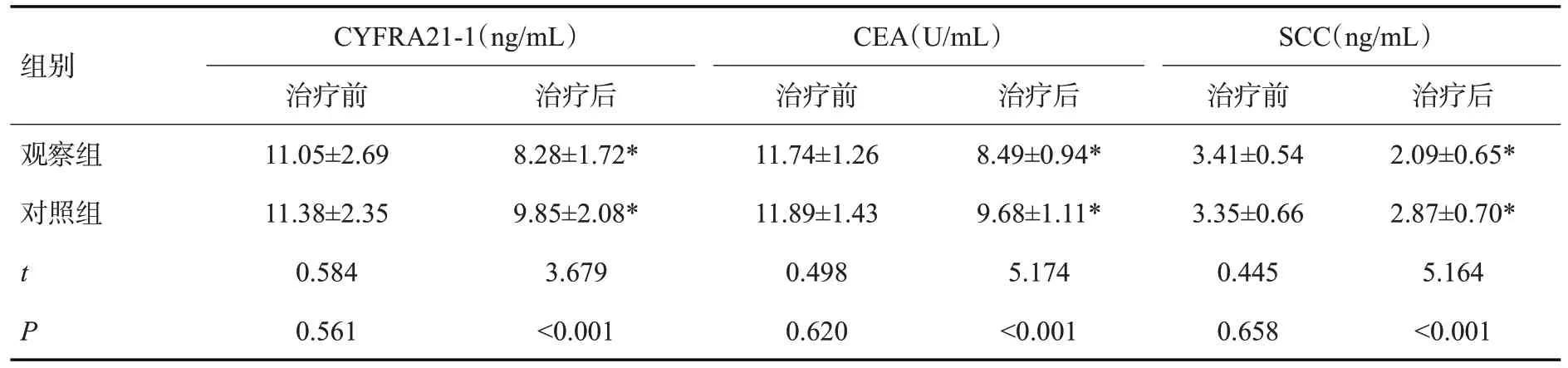
表4 两组血清肿瘤标志物比较Tab.4 Comparison of serum tumor markers between the two groups(n=40,Mean±SD)
2.4 不良反应比较
两组不良反应总发生率差异无统计学意义(P>0.05,表5)。
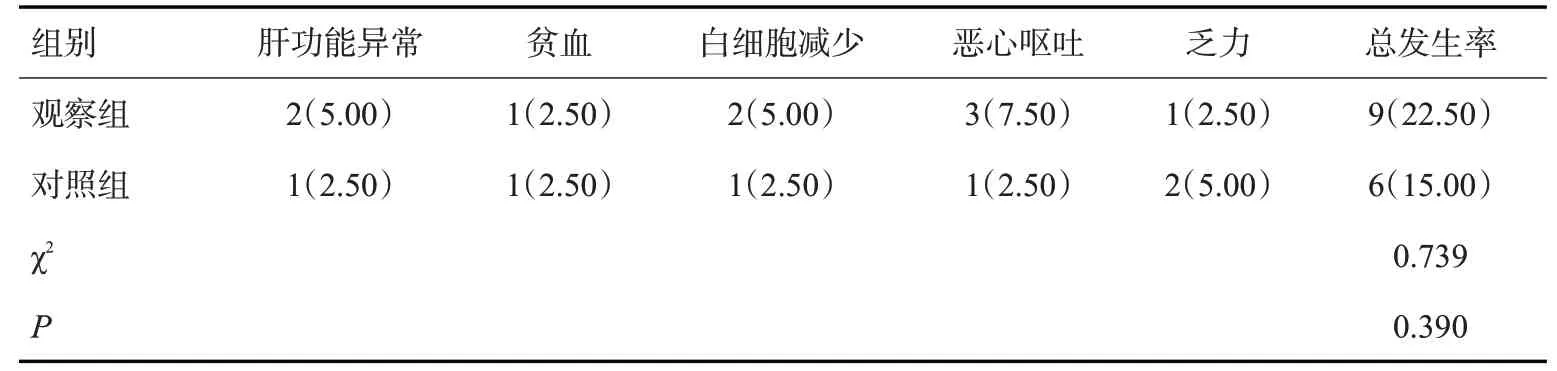
表5 两组不良反应比较Tab.5 Comparison of adverse reactions between the two groups[n=40,n(%)]
2.5 生命质量比较
治疗后,两组SF-36各领域评分均升高(P<0.05),其中观察组SF-36各领域评分高于对照组(P<0.05,表6)。
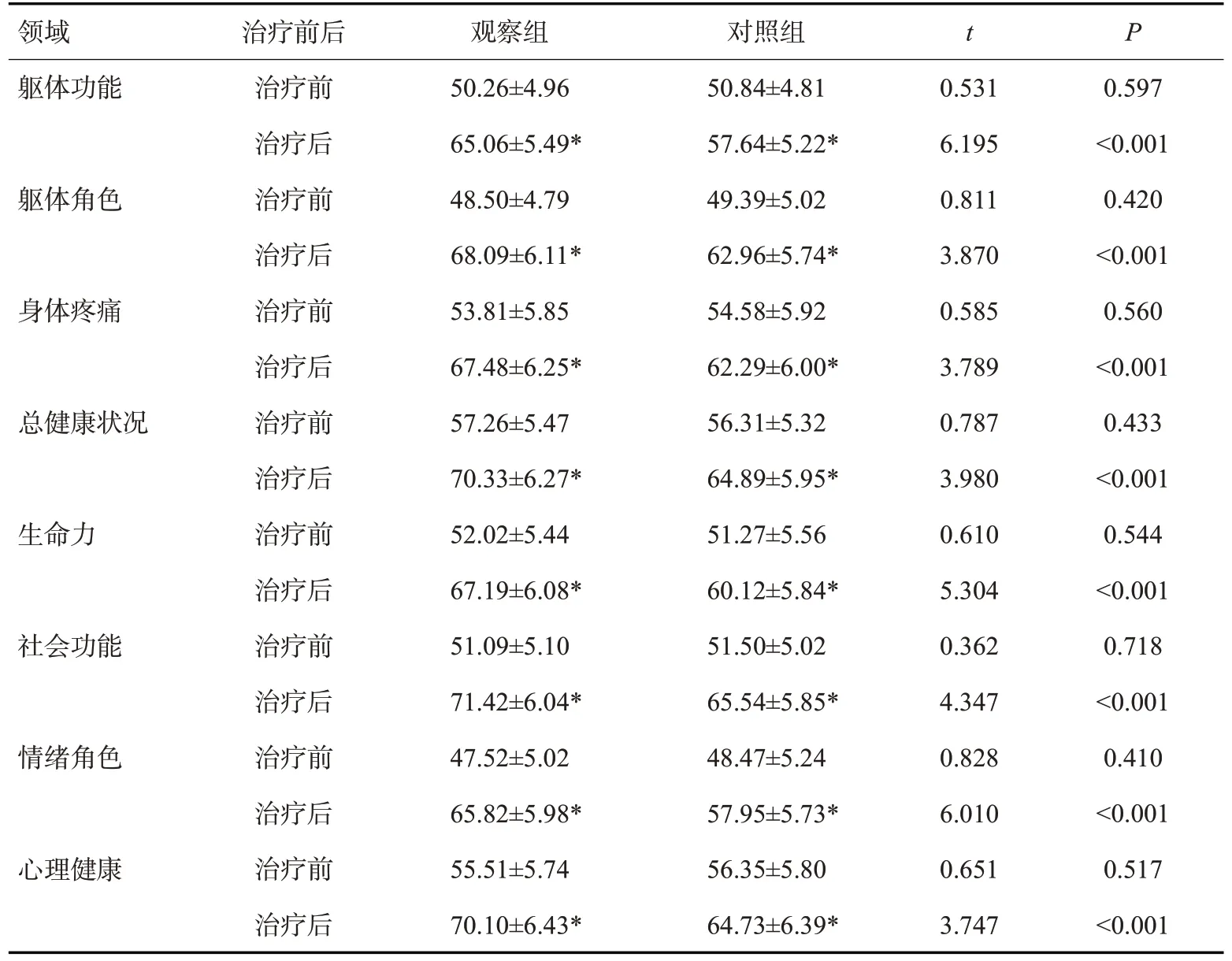
表6 两组生命质量比较Tab.6 Comparison of quality of life between the two groups(n=40,Mean±SD,score)
3 讨论
免疫治疗是系统性癌症治疗的额外选择,PD-1可在活化的T细胞、B细胞中表达,在正常情况下可与其配体PD-L1相结合,从而对主要组织相容性复合体-CD3介导的T细胞活化途径起到拮抗作用,从而防止因T细胞过度活化而导致组织损伤和炎症,以此肿瘤细胞可通过高表达PD-L1来逃避T细胞的杀伤作用[11-13]。帕博利珠单抗是一种PD-L1免疫抑制剂,本质上是一种单克隆免疫球蛋白G4类抗PD-1抗体,其可增强T细胞识别肿瘤细胞的能力,从而提高机体免疫应答以发挥杀伤肿瘤细胞的目的,现已被批准用于化疗联合一线治疗晚期的非小细胞肺癌[14]。有研究显示,相较于单独化疗,帕博利珠单抗联合铂类化疗对延长患者总生存率效果更好[15]。在本研究中,观察组客观缓解率和疾病控制率均高于对
照组,提示帕博利珠单抗联合诱导化疗、放疗治疗可提高中晚期肺鳞癌患者的临床疗效。从胸部CT中可以看出患者的肺部结构、血管走向及病灶体积,进而在评估患者临床疗效方面具有较高的价值。
肺癌的发生和进展与免疫功能紊乱有关,尤其是与T淋巴细胞有关[16];而在T淋巴细胞中,CD3+亚群表示T细胞的水平,能够反映宿主细胞的免疫情况;CD4+和CD8+T细胞则共同组成CD3+,以共同维持免疫系统平衡,因而在免疫系统中发挥重要作用;CD4+/CD8+比值则可反映机体细胞免疫功能,数值越低,肿瘤发生风险就越高[17-18]。本研究发现,观察组治疗后CD3+、CD4+、CD4+/CD8+比值均高于对照组,CD8+低于对照组,提示帕博利珠单抗联合诱导化疗、放疗可改善患者免疫功能。这是由于帕博利珠单抗可缓解机体免疫抑制,使机体免疫具有正向调节作用,从而促进机体免疫细胞激活,进而增强机体抗肿瘤[19]。CYFRA21-1是细胞角蛋白19可溶性片段之一,与肿瘤细胞的分化和增殖密切相关,将其用于评估肿瘤改善程度具有较高的价值[20];CEA是一种细胞表面糖蛋白,有研究显示肺癌患者血清CEA水平会明显升高,同时其在非小细胞肺癌患者中的表达水平会明显高于健康人群[21];SCC是一种糖蛋白,可在血清中表达,在机体的免疫、发育及正常生理活动中占据重要位置,此外其与恶性肿瘤的侵袭、转移、复发等也有关,是一种具有高特异性的肿瘤标志物[22]。本研究发现,观察组治疗后CYFRA21-1、CEA、SCC水平均低于对照组,提示帕博利珠单抗联合诱导化疗、放疗对降低血清肿瘤标志物水平效果更佳,考虑可能是帕博利珠单抗增强了机体抗肿瘤作用,因而使得机体肿瘤标志物水平降低。两组不良反应总发生率差异无统计学意义,提示帕博利珠单抗联合诱导化疗、放疗治疗方案具有一定的安全性。本研究的不良反应大多为1~2级,停药后症状可缓解,不良反应可控。生活质量能够反映患者最直接的感受,是评估肿瘤治疗效果的重要组成部分[23],观察组治疗后生活质量评分均明显高于对照组,提示帕博利珠单抗联合诱导化疗、放疗治疗可提升患者生活质量。
综上,诱导化疗、放疗基础上给予帕博利珠单抗对治疗中晚期肺鳞癌患者具有较好的疗效,有效改善T淋巴细胞亚群和肿瘤标志物水平,安全性好,可提高生命质量,值得临床考虑。本研究的创新点在于,着重分析了帕博利珠单抗联合放化疗对中晚期肺鳞癌患者的治疗效果,通过了解帕博利珠单抗对此类患者的作用为临床合理选择治疗方法提供了依据。
