磁共振表观扩散系数直方图和血清CA125有助于评估子宫内膜样腺癌的病理组织学特征
2022-07-19王宏睿李金玲张克勤
王宏睿,李金玲,张 强,张克勤,张 虎,
滨州医学院附属医院1放射科,3检验科,山东 滨州 256603;2滨州医学院医学影像学院,山东 烟台264003
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,近年来,子宫内膜癌的发病率在全世界范围逐年升高,严重威胁女性尤其是年轻女性的健康[1]。早期诊断和治疗子宫内膜癌是提高患者生存率的关键,现阶段诊断子宫内膜癌首选的无创检查方式是MRI。研究显示,表观扩散系数(ADC)值有助于评价子宫内膜癌的肌层侵犯深度、组织学分级、分期和患者的预后[2-3]。直方图分析是一种影像组学中的纹理分析,它通过最大值、最小值、各百分位数值等多个参数反映图像灰度的变化及分布情况,反映病变的异质性,使临床医生更好地分析病变的弥散特点。既往研究显示ADC直方图分析对于鉴别子宫内膜癌与宫腔其他良性肿瘤及鉴别子宫内膜癌高低分化有重要的意义[4-6],但是目前尚无子宫内膜腺癌ADC直方图联合血清肿瘤标记物与组织分化程度、微卫星的相关性研究。本研究收集68例子宫内膜腺癌的ADC值进行直方图分析和血清肿瘤标记物,以新的视角对子宫内膜腺癌病理组织学进行研究,现报道如下。
1 资料与方法
1.1 一般资料
收集我院2019年10月~2021年1月首诊且术后经病理证实的68例子宫内膜腺癌患者的相关临床资料。纳入标准:磁共振图像清晰,能满足诊断及图像后处理需要;原发子宫内膜腺癌患者;扫描后7 d内行手术获得明确病理结果。排除标准:检查前接受过放、化疗治疗的患者;扫描序列不完整或图像不符合诊断标准。68例患者的年龄范围为34~74岁,临床症状包括:绝经后患者出现阴道不规则出血且无痛,未绝经妇女则表现为月经延长并经量增多。所有患者在术前均行盆腔MRI平扫+扩散加权成像(DWI)+动态增强扫描并签署知情同意书。
1.2 病理学检查方法和结果判定
按照2009年国际妇产科学联盟分级方法,将子宫内膜腺癌分为高分化、中分化及低分化3个级别。由于低分化患者的预后及5年生存率明显低于中高分化,因此将低分化归为低分化组,中高分化归为高分化组。Ki-67指数是根据显微镜各视野下表达阳性细胞百分比的平均值计算得到的。采用免疫组化法检测4种MMR蛋白表达情况,微卫星稳定组为4种MMR蛋白皆表达,而微卫星不稳定组为其中1种及以上MMR蛋白表达缺失。
1.3 血清肿瘤标志物检测方法
检测人体血清中糖类抗原125(CA125)含量。空腹采集受检者静脉血2 mL,并以4500 r/min的转速离心60 min以分离血清,将分离后的标本在-70 ℃的冰库中保存。检测方法采用电化学发光法,仪器采用罗氏e602全自动电化学发光免疫分析仪及相关试剂,并严格按照说明书进行各项操作。
1.4 仪器与方法
采用Discovery 750W 超导磁共振(通用电气),相控阵8通道盆腔专用线圈。嘱患者仰卧位,行轴位扫描。包括以下序列:T1WI、T2WI、DWI以及动态增强扫描。DWI主要包括以下扫描参数:采用单次激发平面回波SEEPI序列,b=0、800 s/mm2,TR:4000 ms,TE:38 ms,视野33 cm×33 cm,矩阵128×128,层厚5 mm。
1.5 直方图分析
把患者工作站的图像以DICOM格式拷贝到个人电脑进行分析。使用第三方FireVoxel软件处理图像,参照磁共振平扫及增强图像在ADC图上手动勾画肿瘤的感兴趣区(ROI)边缘,剔除肿瘤囊变、坏死、出血区域,软件自动生成直方图数据,包括平均值、最小值、最大值、第1百分位数(P1)、第5百分位数(P5)、第10百分位数(P10)、第25百分位数(P25)、第50百分位数(P50)、第75百分位数(P75)、第90百分位数(P90)、第95百分位数(P95)值。选择ROI时,均由2名具有10年以上盆腔肿瘤诊断经验医师进行双盲法判读,当意见不统一时,由第3名具有15年以上工作经验的副主任医师进行最后的判读。每位观察者在肿瘤实性区域勾画3个ROI,获取每个ROI的参数值,然后分别将每位观察者的3个参数值取平均值,最后再将2位观察者测得的平均值再平均作为最后的参数值(图1A~F)。
1.6 统计学分析
采用SPSS23.0统计软件对试验数据进行统计分析。对2名测量者计算组内相关系数来评价测量结果的一致性。对子宫内膜癌不同病理组织分化程度、微卫星稳定情况的ADC直方图参数、Ki-67和CA125采用单因素方差分析和t检验;通过ROC曲线评价ADC直方图参数对子宫内膜腺癌不同病理组织分化程度的诊断效能;通过Spearman 相关分析ADC 直方图参数、CA125与组织分化程度、Ki-67的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 病理、血清CA125及临床分期结果
纳入试验结果的68例患者均为子宫内膜样腺癌。按照2009年国际妇产科学联盟分级方法进行该组肿瘤的归类:高分化27例,中分化28例,低分化13例。微卫星稳定组51例,不稳定组17例。CA125结果中57例正常,11例患者升高,其中高分化3例,中分化3例,低分化5例。临床分期:I期为58例,Ⅱ期4例,III期为3例,IV期为3例。典型案例(图1A~F)。

图1 患者女,49岁,子宫内膜腺癌(中分化),微卫星稳定(临床分期为三期)Fig.1 A 49-year-old female patient with endometrial adenocarcinoma (moderately differentiated),microsatellite stable(clinical stage:stage III).
2.2 2名测量者所得各参数值之间一致性分析
子宫内膜癌病灶的ADC平均值、最小值、最大值、P1、P5、P10、P25、P50、P75、P90、P95值的组内相关系数分别为:0.974、0.957、0.929、0.957、0.973、0.984、0.924、0.975、0.957、0.952、0.935,2名医师测得参数具有良好的一致性。
2.3 子宫内膜腺癌不同组织分化程度的ADC直方图参数、Ki-67、CA125比较
ADC直方图所有参数和Ki-67在子宫内膜癌不同分化程度的差异均有统计学意义(P<0.05)。进一步LSD-t检验提示,高分化、中分化及低分化组的ADC平均值、最大值、P5、P10、P25、P50、P75、P90、P95、Ki-67的均值差异均有统计学意义(P<0.05),低分化组低于高分化组,中分化组均值介于两者之间。最小值及P1值在高分化与低分化组、中分化与低分化组的差异有统计学意义。CA125值仅在低分化组与高分组组间的差异有统计学意义(表1~2)。
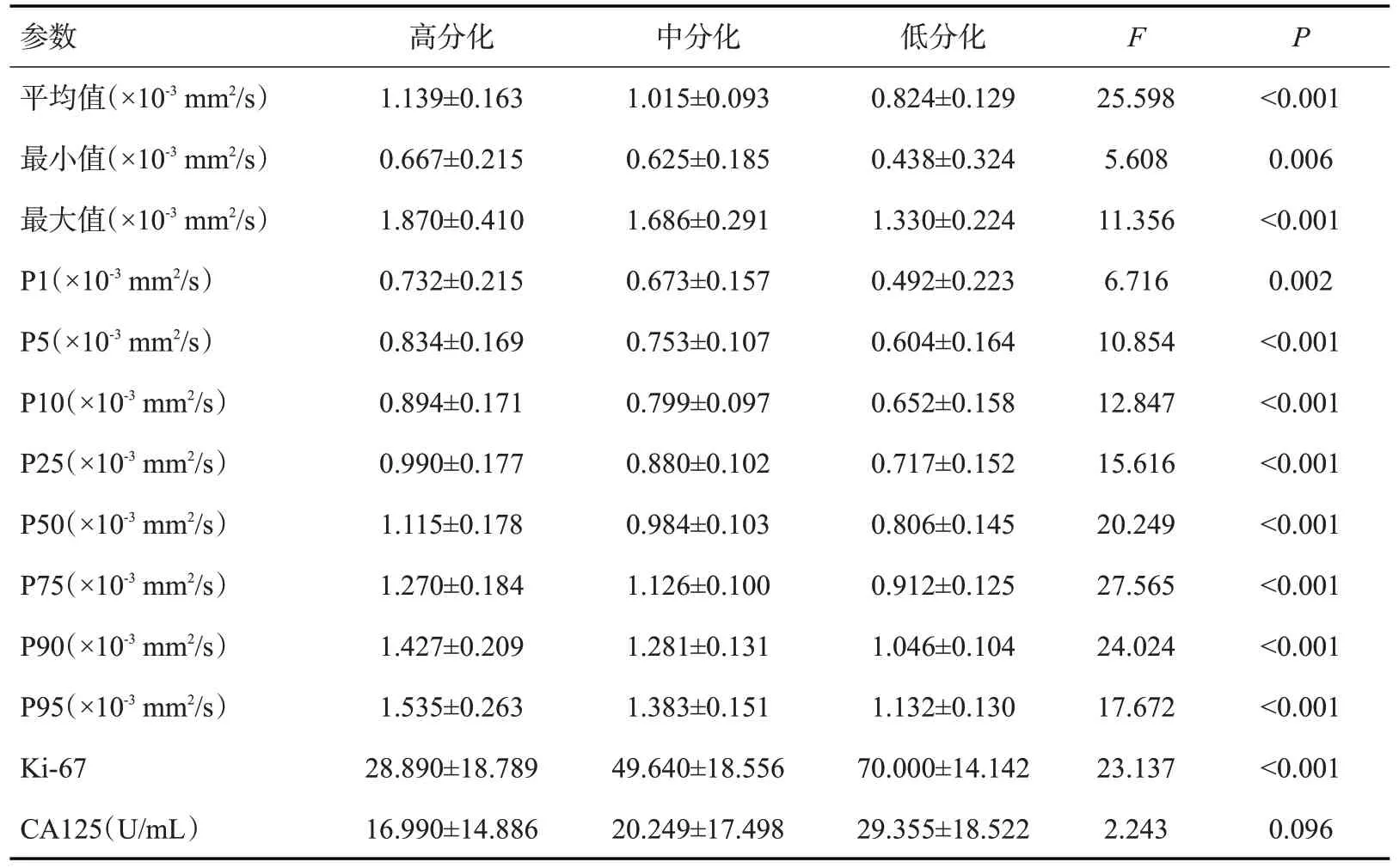
表1 子宫内膜腺癌不同分化程度的ADC直方图参数、Ki-67、CA125的比较Tab.1 Comparison of ADC histogram parameters,Ki-67 and CA125 in endometrial adenocarcinoma with different degrees of differentiation(Mean±SD)

表2 子宫内膜腺癌不同分化程度的ADC直方图参数、Ki-67、CA125差异的两两比较Tab.2 Pairwise comparison of ADC histogram parameters,Ki-67,CA125 in endometrial adenocarcinoma with different degrees of differentiation
2.4 子宫内膜腺癌的微卫星稳定与不稳定组的ADC直方图参数、Ki-67、CA125比较
ADC直方图参数、Ki-67、CA125在子宫内膜腺癌的微卫星稳定与不稳定两组中均数的差异无统计学意义(P>0.05,表3)。

表3 子宫内膜腺癌的微卫星稳定与不稳定组的ADC直方图参数、Ki-67、CA125比较Tab.3 Comparison of ADC histogram parameters,Ki-67 and CA125 between microsatellite stable and unstable groups in endometrial adenocarcinoma(Mean±SD)
2.5 ADC直方图参数对不同分化程度子宫内膜腺癌的ROC曲线分析
将中及高分化程度的子宫内膜癌合并为一组,低分化子宫内膜癌为一组;统计两组的ROC曲线分析获得平均值对应的曲线下面积0.919(P<0.001),最小值值对应的曲线下面积0.760(P=0.004),最大值对应的曲线下面积0.870(P<0.001)、P1 值对应的曲线下面积0.769(P=0.003)、P5值对应的曲线下面积0.817(P<0.001)、P10值对应的曲线下面积0.824(P<0.001)、P25值对应的曲线下面积0.865(P<0.001)、P50值对应的曲线下面积0.887(P<0.001)、P75值对应的曲线下面积0.934(P<0.001)、P90值对应的曲线下面积0.937(P<0.001)、P95值对应的曲线下面积0.912(P<0.001)。
2.6 ADC 直方图参数、CA125 与病理组织分化程度、Ki-67的Spearman相关分析
Spearman相关分析显示,最小值、最大值、P1、P5与子宫内膜癌分化程度呈低等程度负相关关系(r=-0.350、-0.497、-0.389、-0.491,P<0.05);平均数、P10、P25、P50、P75、P90、P95与子宫内膜癌分化程度呈中等程度负相关关系(r=-0.657、-0.527、-0.565、-0.617、-0.672、-0.644、-0.586,P<0.05);平均数、最大值、P10、P25、P50、P75、P90、P95与Ki-67呈低等程度负相关关系(r=-0.445、-0.458、-0.308、-0.354、0.412、-0.469、-0.473、-0.483,P<0.05,表5)。

表4 ADC直方图参数对不同分化程度子宫内膜腺癌的ROC曲线分析Tab.4 ROC curve analysis of ADC histogram parameters for endometrial adenocarcinoma with different degrees of differentiation

表5 子宫内膜腺癌患者的病理组织分化程度、Ki-67与ADC直方图参数、CA125的相关性分析Tab.5 Correlation analysis of histological differentiation degree,Ki-67 and ADC histogram parameters and CA125 in patients with endometrial adenocarcinoma
3 讨论
子宫内膜癌病理分化程度和微卫星不稳定是预测淋巴转移和评估患者预后的重要指标,子宫内膜癌患者的分化程度越低、微卫星越不稳定,其早期淋巴结和远处转移概率就越大,术后复发率越高,生存预后时间也就越短[1-3,6]。术前准确判断子宫内膜癌的临床分期、组织分化程度及微卫星情况对子宫内膜癌患者的治疗方案的选择和预后极为重要。MRI平扫+DWI+动态增强序列能够明确子宫内膜癌的病灶位置、临床分期和病变浸润深度,但该检查对于病理的判断能力有限。ADC直方图分析作为新兴的影像组学,能特异反映病变扩散的异质性、较全面地了解病变的扩散特征及无创准确评估肿瘤的病理特点。
本研究通过回顾分析68例子宫内膜样腺癌ADC直方图参数与病理组织分化程度的发现:高中低分化3组的ADC平均值、最大值、P5、P10、P25、P50、P75、P90、P95的差异均有统计学意义(P<0.05),最小值及P1值的平均值差异只在高分化与低分化组、中分化与低分化组有统计学意义,这与既往文献报道[6-11]一致。DWI序列能从分子水平反映人体生理和病理状态下各种人体器官中水分子的变化,能够较早地发现组织含水量的变化,及时反映机体病理生理状态。通过测量ADC值对组织含水量的改变进行定量评估[5,7,11-13]。人体组织中的细胞的多少、细胞核浆比、细胞膜完整性及大分子物质数量等因素均影响水分子弥散程度,子宫内膜癌患者的肿瘤细胞繁殖旺盛,细胞数量就会增加,细胞内外水含量也就越多;肿瘤组织细胞结构畸形紊乱,导致细胞核浆比变大,细胞外间隙减小,使得水分子弥散受限。子宫内膜癌的肿瘤细胞分化程度低,细胞倍增时间短,单位容积内细胞密度大,细胞外间隙小,使得水分子扩散严重受限,因此子宫内膜癌分程度化越低其ADC值越低[7-13]。ADC直方图参数在评估子宫内膜癌患者的分化程度具有重要的临床价值。

图2 ADC直方图参数对不同分化程度子宫内膜腺癌的ROC曲线分析Fig.2 ROC curve analysis of ADC histogram parameters for endometrial adenocarcinoma with different degrees of differentiation.
本研究也分析了ADC 直方图参数与Ki-67 的变化:三组Ki-67均值的差异有统计学意义,Ki-67值越高,子宫内膜癌分化程度越差。这与前人在研究肾透明细胞癌、颅脑胶质瘤等恶性肿瘤分化程度与Ki-67值关系的研究[14-16]结果相一致,该研究认为Ki-67是核增值抗原即位于细胞核内的一种非组蛋白,是病理判断肿瘤细胞是否活跃的一个非常可靠的指标。Ki-67值越高,说明处于增值期的肿瘤细胞越多、细胞增殖越快,细胞异型性越显著,组织分化程度也就越低,患者预后就越差。因此,Ki-67值的高低在评估子宫内膜癌患者的预后具有重要临床价值。
本研究还发现CA125只在高分化与低分化组组间均数差异具有统计学意义,这与既往研究[17-19]结果大体一致。CA125是早期监测子宫内膜癌及卵巢癌的重要血清肿瘤标志物,有学者认为人体组织内一些自我保护屏障发生破坏时,部分肿瘤细胞就会脱落游离从而导致血清CA125升高;肿瘤生长越快,细胞异型性越明显,分化程度越低,肿瘤细胞脱落越多,血清中含有CA125的肿瘤就越多,导致检测数值也就越高[18]。而CA125在其他两组间的差异无统计学意义,这可能与本研究受试者绝大多数位于I期子宫内膜腺癌有关。
微卫星是近年研究的热点,其不稳定性是一种发生在基因组微卫星上由于错配、缺失等原因导致的突变,已作为子宫内膜癌的发病机制被临床实验广泛研究,在子宫内膜癌治疗及预后评估等方面起到重要作用。目前确定4种错配修复蛋白的表达情况在子宫内膜癌的患者肿瘤组织中,即MLH-1、MSH-2、MSH-6和PMS-2[20]。国内外学者已开始利用MRI技术术前预测子宫内膜癌微卫星状态[21-24]。本研究发现,ADC 直方图参数、Ki-67、CA125在子宫内膜腺癌的微卫星稳定与不稳定两组中均数的差异没有统计学意义,这与既往研究[22,24]不一致,可能是因本研究两组病例的病理组织类型构成、临床分期等情况大致相同导致。
本研究对子宫内膜癌组织分化程度进行ROC曲线分析,发现P90 对应的曲线下面积最大,诊断效能最高。Spearman相关性分析进一步得出最小值,最大值、P1、P5与子宫内膜癌分化程度呈低等程度负相关关系;平均数、P10、P25、P50、P75、P90、P95与子宫内膜癌分化程度呈中等程度负相关关系。平均数、最大值、P10、P25、P50、P75、P90、P95与Ki-67呈低等程度负相关关系。这说明低分化程度子宫内膜癌患者的肿瘤细胞繁殖旺盛,细胞异型性越明显,核浆比越大,细胞外空间就越窄,水弥散受限越严重,病灶在DWI图像上信号越高,测量的ADC值越低。这强有力地证明了ADC直方图参数能在术前无创评估子宫内膜癌患者的组织分化程度及Ki-67值的高低。
综上,ADC直方图参数和血清CA125在预测子宫内膜样腺癌的组织分化程度和Ki-67值有重要的临床价值,但是对微卫星稳定情况的评价意义不大。
