含五种RNA病毒核酸假病毒的制备及特性研究
2022-07-18程巧珍伍义行叶子弘廖学俊胡华军
程巧珍,陈 春,应 婷,伍义行,叶子弘,廖学俊,胡华军
(中国计量大学 生命科学学院 浙江省生物计量与检验检疫技术重点实验室,浙江 杭州 310018)
随着国内外细胞治疗技术的迅速发展,细胞治疗在癌症、血液病、心血管病、糖尿病等治疗上显现出越来越高的应用价值[1]。细胞治疗主要包括肿瘤细胞免疫治疗和干细胞治疗,细胞制剂是细胞治疗中的重要制剂,所以在生产管理和质量控制上需要严格要求。这不仅顺应了国际上细胞制剂标准化制备和应用的主流趋势,也直接影响到细胞治疗的安全性和有效性。另外细胞制剂中内外致病因子的污染是影响细胞制剂生产管理和质量控制中关键因素之一。其中RNA病毒是影响人类健康的重要病原体,在世界范围内可引起致命性疾病的散发、流行或大流行。RNA病毒中HCV、HIV-1/2、HTLV-1/2在世界范围内流行,并具有相似的传播方式,还存在很多合并感染,已被世界卫生组织国际癌症研究机构列入致癌物清单中[2-3]。同时国内细胞制剂相关的标准,如《干细胞制剂质量控制及临床前研究指导原则(试行)》(2015国家卫生和计划生育委员会办公厅和国家食品药品监督管理总局)、《免疫细胞制剂制备质量管理自律规范》(2016中国医药生物技术协会)、《干细胞制剂制备质量管理自律规范》(2016中国医药生物技术协会)、《干细胞通用要求》(2017国家标准委)、《CAR-T细胞制剂制备质量管理规范》(2018中国医药生物技术协会)团体标准征求意见稿等都规定,对细胞制剂中的RNA病毒包括但不限于HIV、HTLV、HCV病毒明确要求检测。
由于细胞制剂来源于供体的细胞培养物,经初检合格的供体细胞经历了多代的分离、纯化和培养过程,同时有些供体细胞可能存在整合前病毒或者漏检,其细胞内的RNA病毒复制量可能随宿主细胞的状态而改变,导致细胞制剂中RNA病毒的抗原和抗体都很难检测。而细胞制剂中RNA病毒的核酸检测方法敏感性高,特异性高,“窗口期”漏检率低已成为重要的质控内容。目前针对RNA病毒包括HCV、HIV-1/2、HTLV-1/2病毒有多种核酸检测方法,如荧光定量PCR法、转录介导的扩增系统(TMA)法和核酸序列依赖扩增系统(NASBA)法,以及bDNA技术和数字PCR技术等[4-8]。为了更准确地评价核酸检测结果的可靠性,设立核酸定性定量检测的质控品成为不可或缺的一部分。一方面,针对这些RNA病毒核酸检测的阳性质控品常使用临床样本中的活病毒、灭活病毒及裸露的RNA,它们存在有生物安全隐患、灭活不彻底、成本高、提纯难、稳定性差等缺陷。近年来应用的噬菌体装甲RNA则基本克服了上述缺陷,随着稳定性、安全性和准确性的提高,已经广泛应用于RNA病毒检测质控品[9]。由于目前大多数质控品都基本只针对某一种RNA病毒,很少同时作为多种RNA病毒检测的核酸标准品。对此,本研究的目的是制备一种装载HCV、HIV-1/2、HTLV-1/2这五种RNA病毒核酸片段的假病毒,以作为细胞制剂中上述五种RNA病毒核酸检测的阳性质控品。
1 材料方法
1.1 菌株、质粒
大肠杆菌Trans5α和E.coliBL21(DE3)感受态购自北京全式金生物技术有限公司,pACY-CDuet-1质粒(Trans5α)购自北京华越洋生物科技有限公司。
1.2 主要试剂和仪器
SanPrep柱式质粒DNA小量抽提试剂盒和SanPrep柱式DNA胶回收试剂盒(一同购自上海生工),RNA/DNA Extraction Kit试剂盒,和逆转录试剂盒(均购自北京宝日医生物技术有限公司),核酸内切酶为KpnI和PacI,BamHI和NotI(购于杭州自创试生物科技有限公司),氯霉素(购自北京索莱宝科技有限公司);ZHWY-100B恒温培养振荡器(上海智城分析仪器制造有限公司),EPS300电泳仪和Tanon-1600凝胶成像系统(上海天能科技有限公司),16K-R高速冷冻离心机(长沙市鑫奥仪器仪表有限公司),XP基因扩增仪器(杭州博日科技有限公司),H7650透射电子显微镜(TEM)(日本日立公司)。
1.3 基因序列合成
参考GenBank中MS2噬菌体(NC_001417.2)、HCV(D11168.1)、HIV-1(MG760423.1)、HIV-2(MH681607.1)、HTLV-1(LC210065)及HTLV-2(AF074965.1)进行MS2噬菌体与五种RNA病毒保守序列串联核酸片段的设计,并分别在五种RNA病毒保守序列串联基因5′端加上KpnI酶切位点及MS2的由19个碱基构成的包装位点(C-variant pac sites),3′端加上PacI酶切位点及C-variant pac sites;在MS2基因5′端加上BamHI酶切位点,3′端加上NotI酶切位点,都由生工生物工程(上海)股份有限公司合成,并提供两种包含目的片段的PUC-SP质粒,命名为PUC-SP-5Virus和PUC-SP-MS2质粒。MS2片段(1 660 bp)的通用引物pACYCDuetUP1和DuetDOWN1以及5Virus保守基因串联片段(1 458 bp)(序列信息如图1)的引物DuetUP2和T7t由生工生物工程(上海)股份有限公司合成。

图1 五种病毒保守基因串联片段的序列信息
1.4 pACYCDuet-1-MS2-5Virus质粒的构建
对PUC-SP-MS2质粒和pACYCDuet-1载体采用BamHI和NotI双酶切,常规电泳,割胶回收后,将MS2目的片段和线性载体pACYCDuet-1进行连接。再将连接产物转化感受态细胞Trans5a,涂板挑单菌落培养扩增,提质粒并利用引物pACYCDuetUP1和DuetDOWN1进行PCR扩增验证,鉴定为阳性中间质粒命名为pACYCDuet-1-MS2。
然后对pACYCDuet-1-MS2中间质粒和PUC-SP-5Virus质粒分别同时用KpnI和PacI双酶切,常规电泳,割胶回收5Virus目的片段和线性载体pACYCDuet-1-MS2进行连接,将连接产物转化感受态细胞Trans5a,涂板挑单菌落培养扩增,提质粒并进行PCR及测序鉴定。PCR鉴定分别对MS2和5Virus两个目的片段验证,最终鉴定为阳性重组质粒命名为pACYCDuet-1-MS2-5Virus。
1.5 pACYCDuet-1-MS2-5Virus质粒转化菌的诱导表达及纯化及SDS-PAGE分析
将重组质粒pACYCDuet-1-MS2-5Virus转化到感受态细胞E.coliBL21(DE3)中,并涂布含有25 mg/mL氯霉素的琼脂平板上,挑单菌落过夜活化作为母液。从母液取出1 mL按1∶100的比例接种到100 mL的LB培养基中220 r/min 37 ℃培养至菌液OD600 nm值达到0.6 h,加入物质的量浓度为0.5 mmol/L的IPTG诱导培养6 h,12 000 r/min离心5 min去上清,收集菌体沉淀,细菌裂解液重悬菌体37 ℃水浴30 min,再于4 ℃下超声波破碎,条件为400 W超声5 s间歇10 s,总共超声作用5 min待菌液透明后,10 000 r/min 4 ℃离心10 min收集上清液转移到超滤离心管(Millipore Ultra-15 10 kD)中4 000 r/min离心1 h纯化浓缩。
再分别取IPTG诱导后重组菌液和未经诱导的菌液即对照组各1 mL,12 000 r/min离心1 min收集菌体沉淀。加入30 μL PBS缓冲液溶解,加入等体积的蛋白上样缓冲液混匀,煮沸6 min,离心各取上清液10 μL上样,进行SDS-PAGE电泳分析。同时,另取纯化浓缩好的5V 10 μL在同条件下处理分析。
1.6 电镜检测
取浓缩的5V 20 μL在电镜观察。
1.7 5V DNase I、RNase A抗性鉴定及保存期试验
1.7.1 5V的DNase I处理及鉴定
将浓缩后的5V稀释1 000倍,分为6组,其中3组加入终浓度分别达到100 U/mL脱氧核糖核酸酶,另外3组加入终浓度为50 U/mL脱氧核糖核酸酶(DNase I),37 ℃处理1 h,加入终止液65 ℃作用15 min,之后将每一组分成2份,1份用RNA/DNA提取试剂盒抽提RNA/DNA,再去除DNA之后进行RT-PCR扩增。另一份不经反转录直接PCR扩增。扩增产物用1%的琼脂糖凝胶电泳进行检测。
1.7.2 5V的核糖核酸酶抗性试验
取100倍稀释度的5V样本3组,每组两份,分别加1 mg/mL核糖核酸酶(RNase A)其中1组加10 μL,另一组加20 μL,37 ℃水浴加热25 min,同时设立不加RNaseA处理的对照组。将所有样品进行RNA抽提并进行RT-PCR鉴定。
1.7.3 5V保存期试验
取稀释100倍的5V放置在-20 ℃冰箱6个月后,分别取出3管抽提RNA并进行RT-PCR鉴定。
2 结果
2.1 重组质粒pACYCDuet-1-MS2-5Virus质粒构建结果
如图2所示,用引物DuetUP2/T7t和pA-CYCDuetUP1/DuetDOWN1对pACYCDuet-1-MS2-5Virus质粒进行PCR扩增,电泳结果显示用引物DuetUP2/T7t扩增出条带片段大小约为1 500 bp;用引物pACYCDuetUP1/DuetDOWN1扩增出条带片段大小约为1 700 bp,两种引物都扩增的条带大小与目的片段相同,进一步测序结果正确。证明重组质粒pACYCDuet-1-MS2-5Virus质粒构建成功。

M—Marker;1—阳性对照(MS2目的片段);2—阳性对照(5Virus目的片段);3、4、5—pACYCDuet-1-MS2-5Virus PCR验证MS2片段;6、7、8—pACYCDuet-1-MS2-5Virus PCR验证五种RNA病毒片段;9—阴性对照图2 pACYCDuet-1-MS2-Virus质粒PCR鉴定图
2.2 pACYCDuet-1-MS2-5Virus/BL21(DE3)重组菌诱导表达及5V纯化结果
如图3所示,SDS-PAGE电泳显示重组菌pACYCDuet-1-MS2-5Virus/BL21(DE3)诱导表达泳道出现了明显的12 kD的目的蛋白带,而对照菌体未出现目的条带,表明重组菌获得了有效表达;经超滤离心管浓缩纯化的5V电泳泳道只出现了噬菌体单一衣壳蛋白单体的唯一条带、大小约为12 kD,表明重组的5V获得高效纯化。电镜下观察到直径约30 nm的5V,证明5V成功制备(图4)。

M—Marker;1—BL21(DE3)空菌;2—未加诱导剂的PACYC-1-MS2-5Virus重组菌;3—加IPTG诱导的PACYC-1-MS2-5Virus重组菌;4—纯化的5V图3 SDS-PAGE电泳图

图4 5V电镜图40 000×Figure 4 Circular virus particles 40 000× of 5V
2.3 5V DNase I、RNase A抗性鉴定和保存期试验结果
2.3.1 5V DNase I处理后的RT-PCR鉴定结果

M—Marker;1,9—阳性对照;2、4、6—5V稀释1 000倍经过100 U/mL DNase I处理后进行RT-PCR;3、5、7—5V稀释1 000倍经过100 U/mL DNase I处理后未经反转录直接进行PCR;8,10—阴性对照
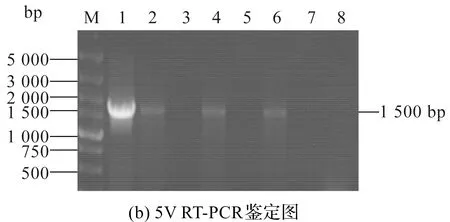
M—Marker; 1—阳性对照;2、4、6—5V稀释1 000倍经过50 U/mL DNase I处理后进行RT-PCR;3、5、7—5V稀释1 000倍经过50 U/mL DNase I处理后未经反转录直接进行PCR;8—阴性对照图5 5V 脱氧核糖核酸酶抗性结果图
如图5(a)(b)所示,琼脂糖电泳检测,结果进行RT-PCR的各组在1 500 bp扩增出明显的目的条带,而未经反转录直接PCR的对照组未见条带。结果表明5V里确实包裹了五种RNA病毒基因的RNA序列,而且完全去除了5V掺杂的质粒DNA杂质的残留。
2.3.2 5V RNase A处理后的RT-PCR鉴定结果
如图6,将100倍稀释的5V用1 mg/mL的RNase A 10 μL/20 μL处理后,提取RNA后进行RT-PCR实验组和对照组在1 500 bp扩增出明显的目的条带。

M—Marker;1—阳性对照;2、3、4—5V稀释100倍经过10 μL RNase A处理后RT-PCR;5、6、7—5V稀释100倍经过20 μL RNase A处理后RT-PCR;8—阴性对照图6 5V核糖核酸酶抗性结果图
2.3.3 5V的保存期试验
将5V稀释100倍后分别放置-20 ℃冰箱6个月后进行RT-PCR鉴定,同时未进行反转录的5V样品作为对照结果如图7。

M—Marker;1—阳性对照;3、5、7—5V稀释100倍在-20 ℃保存6个月后RT-PCR;2、4、6—5V稀释100倍在-20 ℃保存6个月后直接PCR;8—阴性对照图7 5V保存期试验图
3 讨 论
近年来装甲RNA技术已被广泛应用于核酸检测,该技术可以通过基因重组技术将病毒靶基因片段非特异性地包装到噬菌体病毒衣壳內从而构建假病毒颗粒。假病毒不能自己复制,在实验的过程中没有致病性,有蛋白质外壳包裹具有耐核酸酶作用稳定性好,制备高效,可以对核酸检测的全过程进行质控。据国内外研究报道,利用装甲RNA技术已经成功构建了不同的RNA病毒的装甲RNA质控品,包括丙型肝炎病毒(hepatitis C virus)、诺如病毒(norovirus)、流感病毒(influenza virus)、寨卡病毒(zika virus)、轮状病毒(rota virus)、风疹病毒(rubella Virus)以及人类免疫缺陷病毒(human immunodeficiency virus)、新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)等[10-16]。
理论上MS2噬菌体装甲RNA最大的包装片段为4 kbp[17],到目前为止报道到文献中MS2装甲RNA最大的外源RNA包装长度为3 034 bp[13]。本研究制备的MS2装甲RNA包装的靶基因为HCV、HIV-1/2、HTLV-1/2这五种病毒保守基因序列的串联长度约1 500 bp。选择这些病毒保守序列主要依据目前通行的国际检测标准、行业标准,以及国内外相关病毒检测的文献报道、检测技术规范等[11,18-24]。另外根据这五种RNA病毒各自的不同地区的毒株基因全序列及多种亚型病毒基因全序列采用MEGA 3.0软件进行比对分析后确定相应的保守基因序列,并在进行全物种BLAST比对验证。本研究所制备的装载五种RNA病毒核酸片段的假病毒5V,纯度高,能抵抗高浓度的DNase I和RNase A的降解,具有良好的稳定性,而且-20 ℃条件下易于保存。假病毒5V不具备病毒的传染性,具有良好的生物安全性。同时假病毒5V由于携带了五种RNA病毒(HCV、HIV-1/2、HTLV-1/2)的遗传信息,可以同时作为这五种病毒的模拟物应用到对病毒核酸提取、反转录、扩增以及核酸定量整个过程的质量监测,满足在细胞制剂的产品检测中对核酸阳性质控品的基本要求。
