内热针疗法对膝骨性关节炎兔软骨下骨成骨细胞凋亡及Fas和FasL表达的影响❋
2022-07-18陈耘东田心保张金晨赖喆蓥李小龙田富宝林瑞珠许建峰
陈耘东,田心保,张金晨,2,赖喆蓥,李小龙,田富宝,林瑞珠,2△,许建峰,2△
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院,银川 750004)
膝骨性关节炎(knee osteoarthritis,KOA)是临床最常见的OA类型,常累及关节和关节周围组织,如关节软骨、软骨下骨和滑膜,最终导致患者膝关节疼痛和功能障碍[1,2],其发病率高、病程长,严重影响患者的生活质量[3,4]。研究发现,软骨下骨在KOA发生发展中起重要作用[5,6]。成骨细胞作为软骨下骨中维持骨形成的主要细胞,其凋亡加速会抑制软骨下骨形成,导致骨重塑失衡,破坏骨稳态,引发KOA的演变[7,8]。成骨细胞的凋亡与死亡因子(factor associated suicide,Fas)、Fas配体(fas ligand,FasL)表达密切相关[9],是介导细胞凋亡信号传导途径的重要系统。FasL是Fas的配体,通过与Fas结合激活凋亡信号,使其由细胞表面传导至细胞内,促进一系列酶介导的级联反应,并最终诱导细胞凋亡[10]。因此,调控软骨下骨成骨细胞的凋亡及其增殖活化、延缓其功能衰退成为控制KOA病情发展的关键。目前,对于KOA还没有很好的治疗方法,主要采用非甾体消炎药物、基因疗法、针刺、中药、手术等,所有治疗方法都是为改善症状及关节功能[11,12]。团队前期研究发现,内热针疗法对KOA实验兔具有良好的治疗效果[13],但内热针治疗KOA作用机制的认识还较缺乏了解。因此本实验拟探讨内热针对兔KOA模型的治疗效果,分析其对软骨下骨成骨细胞凋亡及Fas、FasL 表达的影响,进一步明确其治疗KOA的部分作用机制。本研究通过宁夏医科大学总医院医学科研伦理审查委员会批准(批准号2018064)。
1 材料与方法
1.1 试剂
TUNEL细胞凋亡检测试剂盒(货号YT137),北京百奥莱博科技有限公司;Fas抗体(货号abs135556,稀释比1∶200)、FasL抗体(货号abs130094,稀释比1∶200),爱必信(上海)生物科技有限公司;二抗山羊抗兔(货号ab140509),美国Abcam 公司;苏木素与伊红染色液(货号PH0516),福州飞净生物科技有限公司。
1.2 仪器
内热针(货号RS15 A,直径0.5 mm,针总长100 mm,针体长65 mm,针柄长35 mm,针柄直径2.2 mm)、内热针治疗仪(KF型40路内热针治疗仪),中国济宁佳科医疗科技有限公司;RM2235型石蜡切片机,Leica公司;BX51型显微镜,Olympus公司。
2 方法
2.1 动物与分组
30只6月龄清洁级健康新西兰大白兔,雌雄各半,体质量(2.5±0.2)kg,由西安交大动物中心提供,实验动物生产合格证号SCXK(宁)2018-0017。大白兔饲养于西安交大动物中心,单笼饲养,12 h昼夜交替,实验室维持一定的温度(22±2)℃和湿度(50%±15%),动物自由摄食与饮水,所有动物适应性喂养7 d。采用随机数字表法将30只新西兰兔分为空白组10只,造模组20只。采用Hulth法制备兔KOA模型,造模成功后再随机分为模型组治疗组各10只。
2.2 造模方法
采用改良Hulth造模方法[14],实验兔适应性喂养7d后开始造模。手术经兔耳缘静脉注射3%戊巴比妥钠溶(1 mL/kg)进行麻醉,麻醉后将实验兔固定于手术台上,对左后肢膝关节局部剃毛、备皮、铺巾和消毒。取左膝关节内侧进行长约3 cm的纵切口,切断内侧副韧带暴露关节腔,然后切除内侧半月板并切断前交叉韧带。止血后冲洗关节腔,抽屉实验检查阳性后清创缝合敷贴包扎。上述步骤严格按无菌操作程序进行,连续7d对实验兔进行局部注射青霉素钠20万 U/只以避免术后感染及炎症反应,术后伤肢不固定,自主活动,单笼饲养。造模术后4周可制备兔KOA模型[15],造模成功后次日进行行为学评价。造模4周后,随机抽取空白组和造模组各2只实验兔,麻醉后对实验兔左膝关节行影像学X线检查。
2.3 干预方法
于造模4周后进行治疗干预。将治疗组实验兔固定于兔台上,在兔左膝关节周围进行内热针布点:选髌上正中点与肢体纵轴的垂直线两侧各定位 1点,共计2点;髌下正中定1点,内外膝眼各1点,共计5点。进针后针尖抵触骨膜后停止进针,针体连接内热针治疗仪后设定温度为 42 ℃,治疗时间为20 min,每周1次,共治疗4次。其他2组实验兔仅兔台固定相同时间不采取任何干预。
2.4 行为学评价
于干预前和末次内热针干预后次日根据改良Lequesne MG量表进行各组实验兔行为学评价,包括局部疼痛度(0~3 分)、步态(0~3 分)、关节肿胀程度(0~2 分)、关节活动范围(0~3 分)4个方面,分数越高提示病变越严重。①疼痛程度(局部疼痛刺激反应:用手指挤压膝关节,按刺激反应程度不同分为4个等级):无异常疼痛反应记0分;患肢出现收缩记1分;患肢收缩、痉挛伴轻度全身反应记2分;患肢剧烈收缩痉挛、全身颤抖、乱窜、挣扎记3分;②步态改变(按照患肢行走、奔跑时的步态分为4个等级):正常行走记0分;患肢奔跑时轻度跛行、踏地有力记1分;患肢参与行走但跛行明显记2分;患肢不能参与行走、不能触地、蹬地记3分;③关节活动范围(按照患肢膝关节活动范围角度分为4个等级,其中以伸直位为 0°):0分为≥90°;1 分为≥45°且<90°;2分为≥15° 且<45°;3分为≤15°;④关节肿胀程度(按照关节的肿胀程度分为3个等级):无肿胀记0分;轻度肿胀、骨性标记线变浅记1分;重度肿胀、骨性标记线消失记2分。
2.5 软骨下骨取材
行为学评价后,3组实验兔均采用空气栓塞法处死,每组各取材10只。将处死的实验兔固定于兔台上,伸直实验兔左后肢,用手术刀暴露膝关节腔,咬骨钳截取胫骨干骺端完整地剔除周围软组织,精确分离关节软骨下骨。得到的软骨下骨组织分为2份,一份置于40 g/L 多聚甲醛液固定 2 d,10%EDTA 脱钙液 2 周,常规脱水石蜡包埋、切片,制备石蜡切片,用于HE染色、TUNEL染色法检测;另一份置于冻存管内,放入-80 ℃冰箱保存,供蛋白免疫印迹法和实时荧光定量PCR检测使用。
2.6 HE染色
观察各组实验兔左膝关节软骨下骨组织的病理学改变。取石蜡包埋块4 μm切片,脱蜡后常规HE染色,光镜下观察软骨下骨组织病理学改变。
2.7 TUNEL法检查成骨细胞凋亡情况
取石蜡包埋块,蜡块切成4 μm的切片,常规脱蜡后行TUNEL染色、封片,光学显微镜下观察软骨下骨的病理改变。TUNEL 染色阳性标记为核染色为黄或棕黄色,并计算细胞凋亡率。
2.8 蛋白免疫印迹法检测软骨下骨组织中Fas、FasL蛋白表达
取-80 ℃冰箱保存的软骨下骨组织约50 mg,液氮下研磨至粉末状,用PBS洗涤1次后加入裂解液,提取软骨下骨总蛋白测量其浓度,制备分离胶和浓缩胶,上样并经过SDS-Page凝胶电泳、剥胶、转膜,分别加入Fas、FasL一抗,4 ℃孵育过夜,二抗孵育1 h,然后ECL 显影、定影、洗片、凝胶、成像。采用Image-Pro Plus软件分析,参照以GAPDH为内参蛋白,以目标蛋白与内参的灰度值比值作为目标蛋白的相对表达量。
2.9 实时荧光定量PCR检测软骨下骨组织中Fas、FasL的mRNA表达
取-80 ℃冰箱保存的软骨下骨组织约50 mg,液氮下研磨至粉末状,细胞裂解法提取软骨下骨总RNA,并用核酸蛋白检测仪检测每个样本浓度。按照逆转录试剂盒说明配成逆转录体系,得到cDNA待用,以其为模板进行RT-PCR扩增。引物序列如下:Fas:F 5′-CCTGTATTGCTGGCTCACTG-3′,R 5′-GTG TACTCCTCCCCTTCCTG-3′; FasL:F 5′-TGGCTCA CTGTCCACAAGTA-3′,R 5′-TGTCTGTGTACTCCT CCCCT-3′; GAPDH:F 5′-CACTTGAAGGGTGGAGC CAAA-3′,R 5′-GCATTGCTGACAATCTTGAGTGA-3′。反应条件:95 ℃预变性30 s 循环1次;95 ℃ 5s,62 ℃ 30 s 循环40次;95 ℃ 1 min,95 ℃ 30 s 循环1次。每个样本设3个复孔,根据各组Ct值计算2-△△Ct值。
2.10 统计学方法
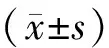
3 结果
3.1 KOA实验兔模型的建立
图1示,KOA实验兔模型建立结束后,分别对空白组及模型组2只实验兔进行影像学X线检查。结果显示,与空白组比较,模型组实验兔左膝关节间隙变窄,有骨赘形成,表明造模成功。

图1 造模后空白组与造模组实验兔左膝关节影像学X线结果比较
3.2 各组实验兔行为学 Lequesne MG 评分比较
表1示,干预前与空白组比较,模型组、治疗组实验兔Lequesne MG 评分均升高(P<0.05),提示造模成功。干预后与模型组比较,治疗组实验兔Lequesne MG 评分降低,差异有统计学意义(P<0.05)。

表1 各组实验兔干预前后 Lequesne MG 量表评分结果比较(分,
3.3 各组实验兔软骨下骨组织形态学结果比较
图2示,HE染色结果显示,与空白组比较,模型组实验兔膝关节软骨下骨存在骨小梁变细、断裂、连续性中断、排列疏松、间隙变大等改变;干预后与模型组比较,治疗组实验兔膝关节软骨下骨可见骨小梁增粗增多,排列密集,间隙变窄。
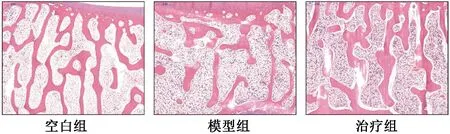
图2 各组实验兔HE染色(放大倍数×200)检查软骨下骨组织形态学变化
3.4 TUNEL染色观察各组实验兔软骨下骨组织中成骨细胞凋亡水平比较
图3示,通过TUNEL染色分析软骨下骨中成骨细胞凋亡,与空白组比较,模型组成骨细胞凋亡阳性表达明显增加,且凋亡率显著升高,差异有统计学意义(P<0.001)。经内热针干预后,成骨细胞凋亡阳性表达明显减少且凋亡率明显降低,差异有统计学意义(P<0.001)。

注:与空白组比较:***P < 0.001;与模型组比较:###P < 0.001;红色△→成骨细胞凋亡的阳性表达
3.5 各组实验兔软骨下骨组织中Fas、FasL mRNA及蛋白表达的比较
图4示,与空白组比较,模型组软骨下骨组织中Fas、FasL蛋白及mRNA表达水平显著升高(P<0.001);干预后与模型组比较,治疗组软骨下骨组织中Fas、FasL的蛋白表达水平显著降低(P<0.001);与模型组比较,治疗组软骨下骨组织中Fas、FasL的mRNA表达水平明显降低(P<0.05)。

注:与空白组比较:***P<0.001;与模型组比较: #P<0.05,###P<0.001
4 讨论
KOA是一种常见于中老年人群的以膝关节软骨退变、骨赘增生、软骨下骨改变和滑膜炎为特征的慢性退行性关节疾病[16],主要表现为进行性膝关节疼痛、肿胀、僵硬及功能障碍等,给患者和家庭社会带来沉重的经济负担[17]。因此,寻求有效防治KOA的方法不仅可以提高患者的生活质量,还可以降低KOA晚期膝关节置换率,减轻疾病给患者带来的痛苦及社会经济负担。
KOA属于中医学痹病范畴,本病的病因病机的论述可追溯到《黄帝内经》。《素问·痹论篇》记载:“风寒湿三气杂至,合而为痹”,指出其基本病机为肝肾不足,风寒湿邪侵袭,导致关节运动障碍,造成局部疼痛[10]。因此对于 KOA 的治疗应以补肝益肾、祛风寒湿、温经通络为主[18]。而中医学认为内热针疗法可温经散寒、活血通络、缓解局部肿胀、松解黏连组织,加强针刺的作用[19]。内热针疗法作为一种新的以软组织外科学无菌性炎症致痛学说为理论依据的非药物疗法[20],在治疗KOA的临床研究中表明,可有效改善患者临床症状,减轻膝关节疼痛效果[21,22]。
研究表明,软骨下骨的骨重塑异常被认为是KOA的发病机制和病理过程的重要因素[23]。在KOA的发展过程中,软骨下骨质增生、关节间隙变窄等形态学改变最终导致关节畸形和功能障碍[24]。X线检查是诊断KOA最重要的方法之一[25],因此,在本实验中我们进行影像学X线检查,以鉴定采用Hulth法制备的KOA模型。X线检查结果显示,与空白组比较,造模组实验兔左膝关节关节间隙变窄并有骨赘形成,表明成功制备了兔KOA模型。本实验采用手术诱导中Hulth法成功制备兔KOA模型,在其病理进展初期即出现软骨下骨改变,即HE染色结果表明,模型组实验兔膝关节软骨下骨存在骨小梁变细、断裂、连续性中断、排列疏松、间隙变大等改变,经内热针干预后可明显改善上述病理变化。上述结果与YANG等[26]研究发现手术诱导法制备的KOA模型软骨损伤继发于软骨下骨改变的结果相一致。
正常软骨下骨的骨重塑通过成骨细胞的成骨活性和破骨细胞降解活性维持一个动态平衡[27]。在KOA的病程发展过程中,动态平衡破坏,成骨细胞代谢活动改变,软骨下骨出现结构上的改变,导致软骨下骨的骨重塑失衡,破坏骨稳态[28]。研究发现,软骨下骨成骨细胞凋亡加速,骨形成下降,导致骨量减少,骨重塑异常[29]。在本研究采用TUNEL染色检测软骨下骨成骨细胞凋亡情况,结果显示内热针能显著降低KOA模型兔膝骨关节软骨下骨中成骨细胞数量及凋亡指数,提示内热针干预抑制KOA兔膝关节软骨下骨成骨细胞的凋亡,修复和减轻膝关节软骨下骨的损伤。
而有研究表明,Fas、FasL能够调控软骨下骨成骨细胞的凋亡[9]。Fas是位于细胞膜上的一个受体,属Ⅰ型膜蛋白及肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员;FasL是Ⅱ型膜蛋白,胞外区与肿瘤坏死因子家族高度同源。FasL是Fas的配体,通过与Fas结合激活凋亡信号,使其由细胞表面传导至细胞内,促进一系列酶介导的级联反应,并最终诱导细胞凋亡[10]。武中庆等[30]探究右归饮对兔膝骨关节炎软骨细胞凋亡机制研究发现,中药右归饮能通过下调Fas、FasL蛋白表达显著抑制KOA模型中软骨细胞的过度凋亡,控制KOA的进一步发展。所以,此次实验在上述研究基础上,进一步探讨内热针对KOA模型中软骨下骨成骨细胞凋亡的可能机制。而本研究同样证明,内热针治疗兔KOA模型能通过下调Fas、FasL的表达,缓解KOA中软骨下骨成骨细胞的凋亡,达到缓解膝关节软骨下骨组织损伤的目的。
综上所述,内热针疗法能显著改善 KOA 实验兔的组织病理学变化,抑制 KOA中软骨下骨成骨细胞的凋亡,其作用途径可能与下调Fas和FasL的表达密切相关,其对KOA实验兔的损伤修复具有积极作用。但是KOA的发生发展是多种因素共同作用的结果,内热针疗法是否能通过其他途径抑制软骨下骨成骨细胞的凋亡或促进软骨下骨的修复,有待进一步的研究与验证。
