高脂血症与颈动脉粥样硬化斑块的关系研究
2022-07-18冯莹印宋金玉曹立荣纪盛章
冯莹印,高 晓,宋金玉,曹立荣,纪盛章
(天津市第四中心医院放射科,天津 300140)
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)每年造成1790 万人死亡,占全球死亡总人数的31%,因此成为当今死亡的第1 大原因[1],也是我国居民死亡的主要原因[2]。动脉粥样硬化涉及多种过程,如氧化应激和炎症[3],包括许多可改变的危险因素,如血脂异常、吸烟、高血压和糖尿病。高脂血症作为心脑血管疾病,特别是动脉粥样硬化的重要危险因素,在一般人群中较为常见,是中老年人的常见病。血脂过高可引起脂质代谢紊乱,特别是胆固醇,被认为是动脉粥样硬化的关键因素。大型随机双盲试验表明[4],药物诱导的低密度脂蛋白胆固醇(LDL-C)降低,尤其是他汀类药物,可降低ASCVD 和全因死亡率。颈动脉粥样硬化作为动脉粥样硬化的一种重要形式,卒中是其主要后果。颈动脉斑块的组成与动脉粥样硬化性脑血管事件显著相关[5]。既往研究表明[6,7],血脂与颈动脉粥样硬化斑块有关。因此,有必要对高脂血症患者的颈动脉粥样硬化斑块特征进行进一步研究,分析高脂血症与颈动脉粥样硬化斑块之间的关系,为伴有高脂血症的颈动脉粥样硬化患者风险分层管理提供线索。
1 资料与方法
1.1 一般资料 研究对象来自中国动脉粥样硬化风险评估(CARE-Ⅱ)[8],回顾性分析2011 年5 月-2015 年12 月CARE-Ⅱ研究中584 例因急性缺血性脑卒中或短暂性脑缺血发作行颈动脉高分辨MRI 血管壁成像患者,男418 例,女166 例;年龄26~87 岁,平均年龄(61.50±10.13)岁。纳入标准:①年龄18~80 岁;②超声确定症状侧颈总动脉分叉上下2 cm 范围内存在粥样硬化斑块。排除标准:①心源性中风;②颅内出血、感染、肿瘤;③颈部放疗史;④幽闭恐惧症;⑤MRI 检查禁忌证。收集患者性别、年龄、体重指数(BMI)、吸烟史、高血压史、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)、总胆固醇(TC)、甘油三酯(TG)、冠心病病史和心血管疾病家族史。高脂血症依据2016 中国成人血脂异常防治指南定义为至少符合以下任意一项:空腹总胆固醇>220 mg/dl,甘油三酯>150 mg/dl,低密度脂蛋白>140 mg/dl,高密度脂蛋白<40 mg/dl。高危斑块定义为AHAⅥ型斑块或最大脂质坏死核心(lipid rich necrotic core,LRNC)面积百分比>40%[9]。该研究已获得机构伦理审查委员会的批准。
1.2 颈动脉高分辨MRI 血管壁成像 使用专用的8通道相控阵表面线圈,CARE-Ⅱ所有患者均在3.0T磁共振扫描仪上进行检查,使用标准化的多对比成像协议获取颈动脉血管壁图像。成像中心为症状侧颈动脉分叉处。扫描参数见表1。
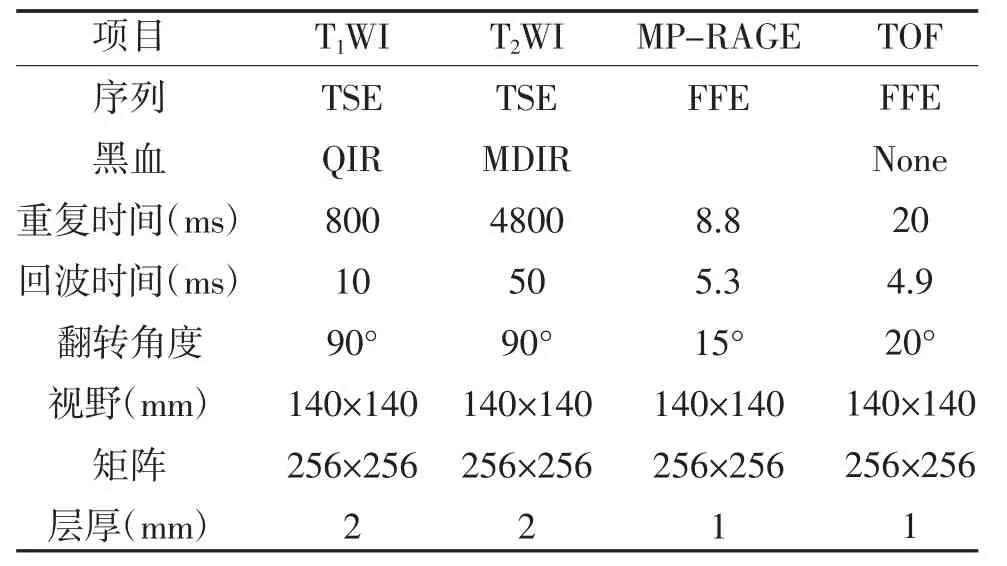
表1 颈动脉高分辨MRI 扫描参数
1.3 图像分析 颈动脉血管壁图像由2 名经验丰富的放射科医生采用双盲法使用专业软件CASCADE进行独立分析。两位评价者都有3 年以上的心血管斑块成像经验。如意见不一致,经协商确定。首先对图像质量进行4 分制评分(1=差,血管壁分辨不清;2=良,血管壁边缘可见;3=好,血管壁显示清晰;4=优,血管壁及斑块显示非常清晰),质量评分≤2 分的图像被排除在本研究之外。在轴位图像手动勾画颈总动脉或颈内动脉管腔和管壁边界,测量并计算平均、最大管壁厚度、平均管壁面积、平均管壁体积、平均管腔面积、平均总血管面积、平均标准化管壁指数。平均标准化管壁指数=(总血管面积-管腔面积)/总血管面积。钙化、LRNC、斑块内出血(intraplaque hemorrhage,IPH)、纤维帽破裂采用标准[9,10]进行鉴定和量化。
1.4 观察指标 将患者分为高脂血症组和非高脂血症组,比较两组症状侧颈动脉粥样硬化斑块特征和临床特征,评估高脂血症与颈动脉斑块特征的相关性,分析颈动脉粥样硬化斑块特征与血脂成分的相关性。
1.5 统计学方法 所有数据使用SPSS 24.0 进行分析,计量资料采用(±s)表示,行独立样本t检验;计数资料采用[n(%)]表示,行χ2检验;采用Logistic 回归分析(二元变量)评估高脂血症与颈动脉斑块特征的相关性;应用多元线性或Logistic 回归分析颈动脉粥样硬化斑块特征与血脂的相关性。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组一般资料及实验室指标比较 入组高脂血症组351 例(60.10%),非高脂血症组233 例(39.90%)。两组年龄、性别、吸烟史、高血压史、收缩压、舒张压、冠心病史比较,差异无统计学意义(P>0.05);两组心血管病家族史、糖尿病史、BMI、TC、TG、LDL-C、HDL-C 比较,差异有统计学意义(P<0.05),见表2。
表2 两组一般资料及实验室指标比较[±s,n(%)]
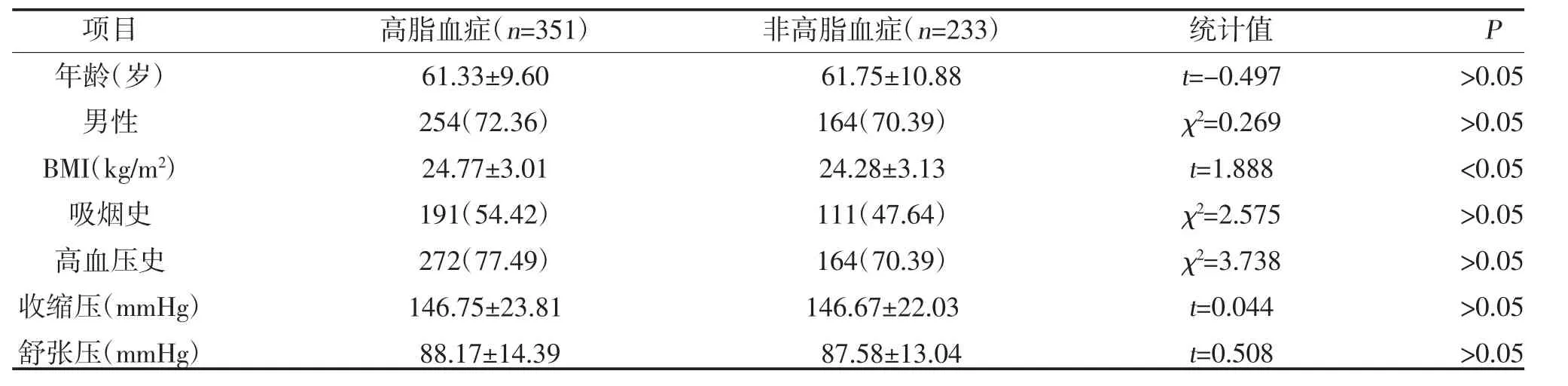
表2 两组一般资料及实验室指标比较[±s,n(%)]
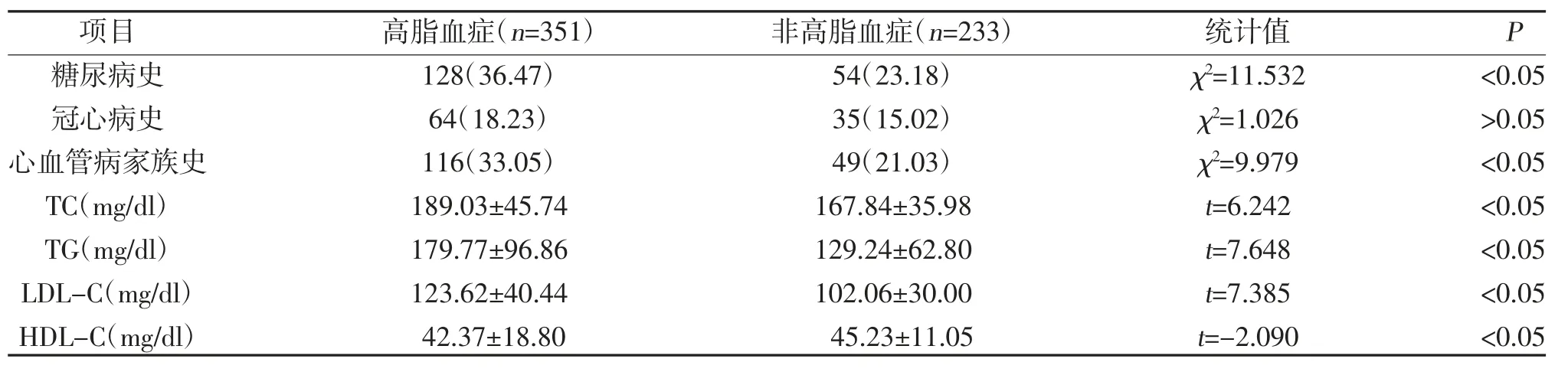
表2(续)
2.2 两组颈动脉斑块特征比较 两组平均管腔面积、最大管壁厚度、平均管壁厚度、平均标准化管壁指数、LRNC 发生率、LRNC 体积百分比、IPH 发生率比较,差异有统计学意义(P<0.05),见表3。
表3 两组颈动脉斑块特征比较[±s,n(%)]
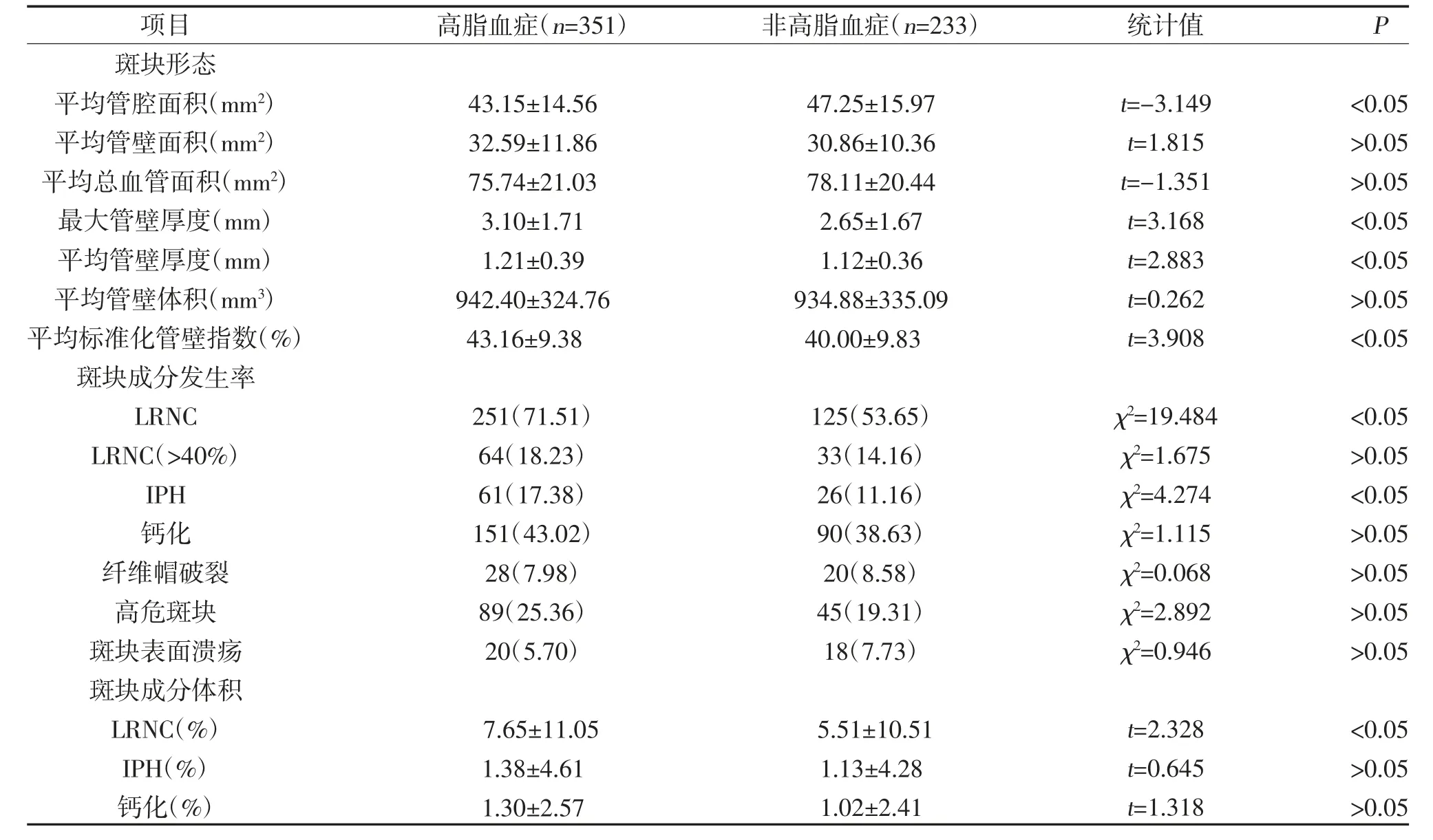
表3 两组颈动脉斑块特征比较[±s,n(%)]
2.3 高脂血症和颈动脉斑块的相关性 Logistic 回归分析显示,高脂血症与平均管腔面积(OR=0.983,95%CI:0.972~0.995,P<0.05)、LRNC (OR=1.998,95%CI:1.399~2.853,P<0.05)相关;校正性别、年龄、高血压、糖尿病、BMI、心血管病家族史后,高脂血症与平均管腔面积(OR=0.983,95%CI:0.972~0.995,P<0.05)、LRNC (OR=1.851,95%CI:1.282~2.673,P<0.05)仍相关,见图1、图2;而高脂血症与管壁体积及平均标准化管壁指数在校正临床特征前后均不相关,见表4。

表4 高脂血症与颈动脉斑块的相关性

图1 男性高脂血症患者颈动脉硬化斑块LRNC 在各序列的表现
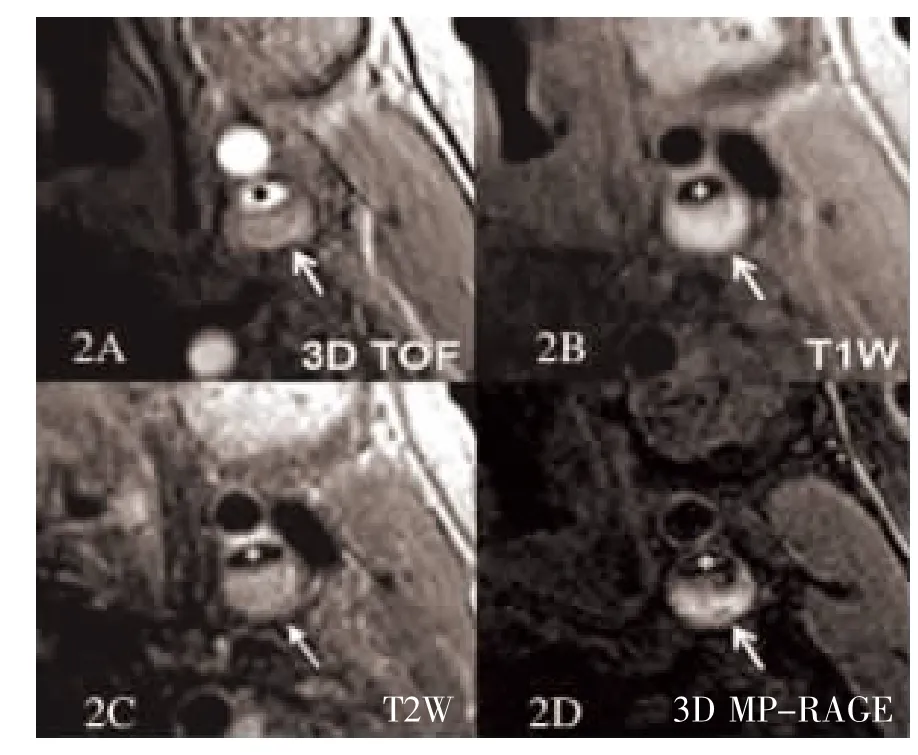
图2 男性高脂血症患者颈动脉斑块中IPH 在各序列的表现
2.4 高脂血症脂质谱与颈动脉斑块的相关性 应用Logistic 回归分析并校正性别、年龄、高血压、糖尿病、心血管病家族史、冠心病、BMI 后,TC 与平均管腔面积负相关(β=-0.040,95%CI:-0.073~-0.006,P=0.020),与最大管壁厚度正相关(β=0.005,95%CI:0.001~0.009,P=0.015),与IPH(OR=1.009,95%CI:1.002~1.016,P=0.009)及AHA Ⅵ型斑块(OR=1.009,95%CI:1.002~1.015,P=0.007)相关。LDL-C、TG、HDL-C 在校正临床特征前后与颈动脉斑块特征均不相关。
3 讨论
本研究采用高分辨MRI 血管壁成像技术比较了高脂血症患者和非高脂血症患者颈动脉斑块的特征差异,结果发现高脂血症患者平均管腔面积更小,最大、平均管壁厚度更厚,平均标准化管壁指数更大,LRNC、IPH 发生率更高、LRNC 体积更大,提示高脂血症患者未来缺血性卒中风险更高。高脂血症与平均管腔面积负相关,与LRNC 相关,这点需要在临床管理中加以重视。
3.1 高脂血症致动脉粥样硬化机制 高脂血症是动脉粥样硬化的重要危险因素,高TC、LDL-C、TG 和/或低HDL 水平的血脂异常与人类动脉粥样硬化的发生和发展密切相关。在所有种类的脂质中,胆固醇被认为是动脉粥样硬化的关键因素[3]。通常认为,当血液中存在过多的胆固醇,LDL-C 沉积在内皮下间隙,并形成多余的氧化型低密度脂蛋白(ox-LDL),ox-LDL 通过血管细胞中的促炎因子导致内皮功能障碍和单核细胞重新聚集到动脉内膜[11],然后单核细胞分化成巨噬细胞,巨噬细胞吸收脂蛋白成为泡沫细胞,最终导致脂肪条纹的形成——这是早期动脉粥样硬化的标志[12],随后脂纹逐渐发展成严重的动脉硬化斑块。
3.2 血脂与颈动脉粥样硬化斑块 研究表明[13-16],脂质谱与颈动脉斑块显著相关,在颈动脉斑块的病理生理学中起着关键作用[17,18]。本研究中,高脂血症与平均管腔面积负相关,进一步证实高脂血症加重颈动脉粥样硬化发展。本研究发现,管壁体积、平均标准化管壁指数在校正临床特征后与高脂血症不相关,表明高脂血症没有加重颈动脉斑块负荷。本研究中,TC、LDL-C、TG、HDL-C 与管壁体积和平均标准化管壁指数均不单独相关,TC 与最大管壁厚度呈正相关,表明单独的TC、LDL-C、TG、HDL-C 同样没有增加颈动脉斑块负荷。既往研究指出[19],颈动脉壁体积或斑块负荷与HDL-C 水平显著相关,平均标准化管壁指数与HDL-C 浓度呈负相关、与LDL-C 正相关。Virani SS 等[15]的研究中,TC、LDL-C在校正混杂因素后与最大管壁厚度、颈动脉壁体积、平均标准化管壁指数相关,与HDL-C 不相关,这之前的研究结果存在差异。本研究结果与前期研究同样存在差异,其原因可能是入组人群不同和临床因素差异造成。
本研究发现,高脂血症与LRNC 相关,与LRNC体积百分比不相关,进一步分析后发现TC、LDL-C、TG、HDL-C 与LRNC 的存在及体积百分比均不单独相关,与Virani SS 等[15]的研究一致。有研究表明[20],在冠心病患者中低水平HDL-C 与LRNC 体积的增加显著相关。Wasserman BA 等[21]的研究发现,TC 和LDL-C 与LRNC 的存在和LRNC 体积增加相关,这与之前的研究结果存在争议,且与本研究结果也不同。本研究人群存在前循环缺血症状,且TC、TG、LDL-C 的水平较高,HDL-C 水平较低,这可能是导致结果不同的原因。Gao X 等[22]研究发现,在症状性患者中2 型糖尿病与LRNC 存在显著相关。另有学者指出高水平TC 是LRNC 存在的唯一危险因素[20]。因此,关于LRNC 存在的危险因素还需进一步研究。本研究发现,高水平TC 与AHAⅥ型斑块和IPH 的存在相关,表明高水平TC 患者存在更多的高风险斑块。Zhao XQ 等[23]研究发现,Lp(a)、HDL-C、ApoA1水平与AHAⅥ型斑块和IPH 的存在显著相关,与TC 水平不相关。本研究Ⅵ型斑块及IPH 较少,未来TC 与高风险斑块的相关性需要进一步研究。
本研究存在一定局限性。首先,本研究为横断面研究,没有对高脂血症的分类加以细致区分,对于高脂血症持续时间、治疗时间等信息没有收集,这些因素可能会对颈动脉斑块产生影响。其次,在本研究中,LRNC 是在未曾强化的MRI 序列上识别,当LRNC 伴有出血时可能会高估LRNC。
综上所述,高脂血症患者颈动脉粥样硬化更严重,未来缺血性卒中风险更高。高水平TC 与高风险斑块相关,在临床管理治疗中应重点关注。
