散发性脑动静脉畸形KRAS突变及其与临床特征的关系
2022-07-16李昊许宏远押小龙曹勇
李昊,许宏远,押小龙,曹勇,2
脑动静脉畸形(brain arteriovenous malformation,BAVM)临床表现多样,其中颅内出血是其最严重也是最常见的症状[1]。在BAVM中,颅内出血的年发病风险为2%~4%,相关死亡率约为10%[2-3]。针对散发性BAVM的研究发现BAVM组织中存在Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)激活型体细胞突变,突变率在28.5%~76.2%不等[4-8],提示KRAS基因突变可能与BAVM的发生、发展存在一定关联。此外,KRAS突变是否与BAVM的临床特征有关还尚不清楚。因此,有必要进一步探究KRAS突变与BAVM发生之间的关系以及这些突变与患者临床特征的关联。
1 对象与方法
1.1 研究对象 本研究采用回顾性分析的方法,连续纳入2017-2019年就诊于首都医科大学附属北京天坛医院神经外科的BAVM患者。纳入标准:①经过DSA或CTA诊断为BAVM;②患者或家属签署知情同意并接受外科手术治疗;③无BAVM家族史;④切除的病变部位进行了福尔马林固定和石蜡包埋(formalin-fixation and paraffin-embedding,FFPE)处理且样本保存良好。排除标准:①未接受手术治疗;②接受外科手术治疗但是不能获取组织标本或标本未达到检测标准;③家族性BAVM。
BAVM的诊断是依据DSA发现动静脉畸形团和动静脉分流,并且经过病理学检查确诊。从病历资料中提取相关数据,包括入院年龄、性别、首发症状(包括脑出血、癫痫、头痛、其他等)。根据术前头颅MRI判读BAVM的位置、最大直径(矢状位)、体积[计算公式:(长×宽×高)/2]。
1.2 DNA检测 从5 μm的FFPE组织切片中提取DNA。将显微组织切片与组织裂解缓冲液(Qiagen,Hilden)混合后,在98 ℃下热处理15 min,然后在56 ℃下用蛋白酶K消化3 d。采用DNeasy组织血液试剂盒(DNeasy tissue and blood k it,Qiagen)提取DNA。使用NanoDrop ND-1000荧光光谱仪(NanoDrop,Wilmington,DE)对提取的DNA进行定量测定。通过PCR扩增KRAS的指定区域(检测位点为chr12:25398284)。KRAS的PCR引物是使用Primer 3软件的修改版本设计的,引物序列如下:正向,GGTCCTGCACCAGTAATATGC;反向,ATTAACCTTATGTGTGACATGTTC。用该引物扩增170~240 bp之间的产物。使用2步方案进行PCR扩增,在单个Hiseq泳道中将所有批次样品的PCR产物一起测序。最后产物进一步进行超深度测序,使用之前开发的LEMONADE流程过滤筛选合格数据并检测KRAS基因位点突变[9]。
1.3 统计分析 采用 Python 3.8进行统计分析,连续性变量符合正态分布,采用表示。分类变量采用例数和率表示,若分类表格中有频数<5,则采用Fisher确切概率,否则采用Pearsonχ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床特点 本研究共纳入145例BAVM患者,均为汉族,其中男性94例,女性51例,年龄3~61岁,以脑出血为首发症状者居多(48.3%)。只有1例患者在BAVM切除术前接受了血管内部分栓塞治疗(表1)。
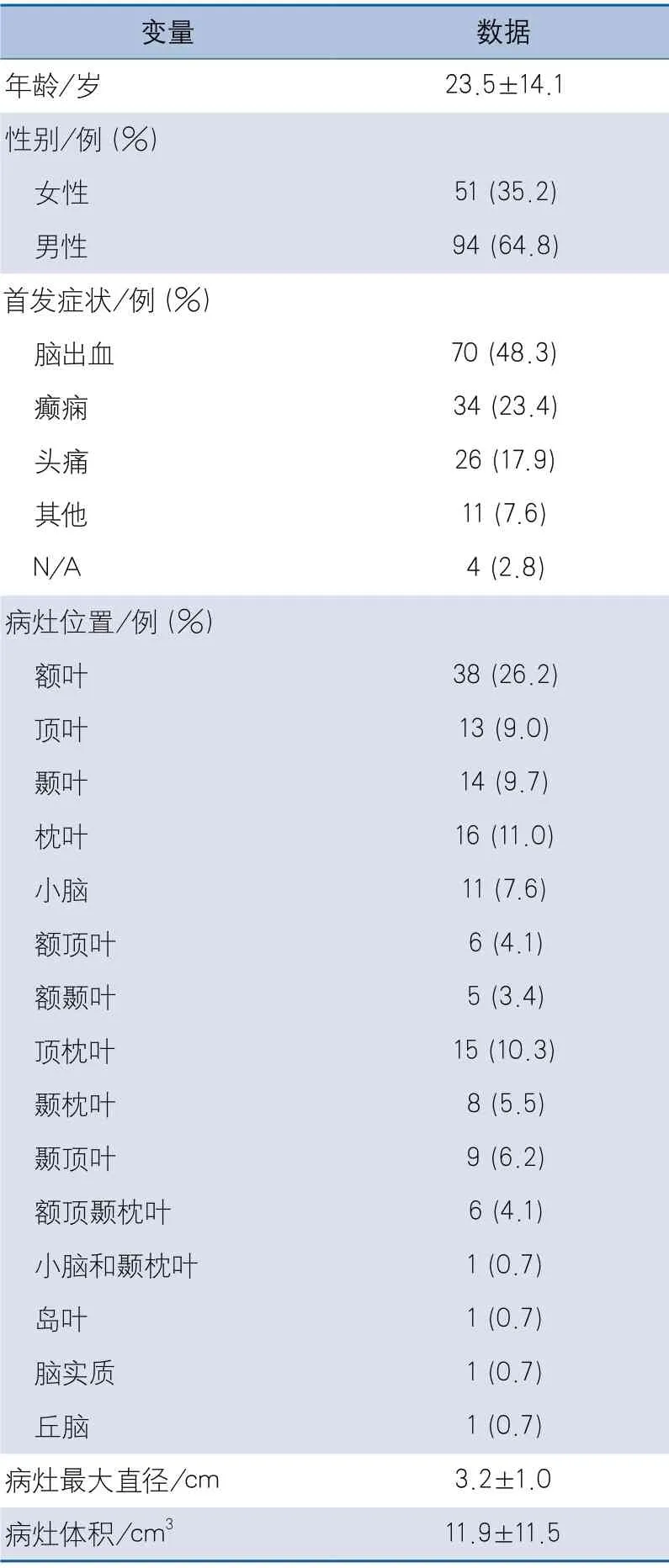
表1 临床特征数据汇总
2.2KRAS突变检测 145例样本中有63例有KRAS体细胞突变,其中41例(28.3%)样本检测到c.35G→A(G12D)突变,14例(9.7%)样本检测到c.35G→T(G12V)突变。此外,还发现了其他研究很少报道的几种KRAS突变,包括c.34G→T(G12C)突变8例(5.5%)、c.34G→A(G12S)突变7例(4.8%)、c.35G→C(G12A)突变2例(1.4%)、c.34G→C(G12R)突变1例(0.7%),其中有8例(5.5%)样本包含1个以上的KRAS突变体。
2.3KRAS突变与BAVM临床特征的关系KRAS突变组(63例)和非突变组(82例)的性别、年龄、首发症状(包括脑出血、癫痫、头痛等)、病灶最大直径、病灶体积之间的差异均无统计学意义(表2)。
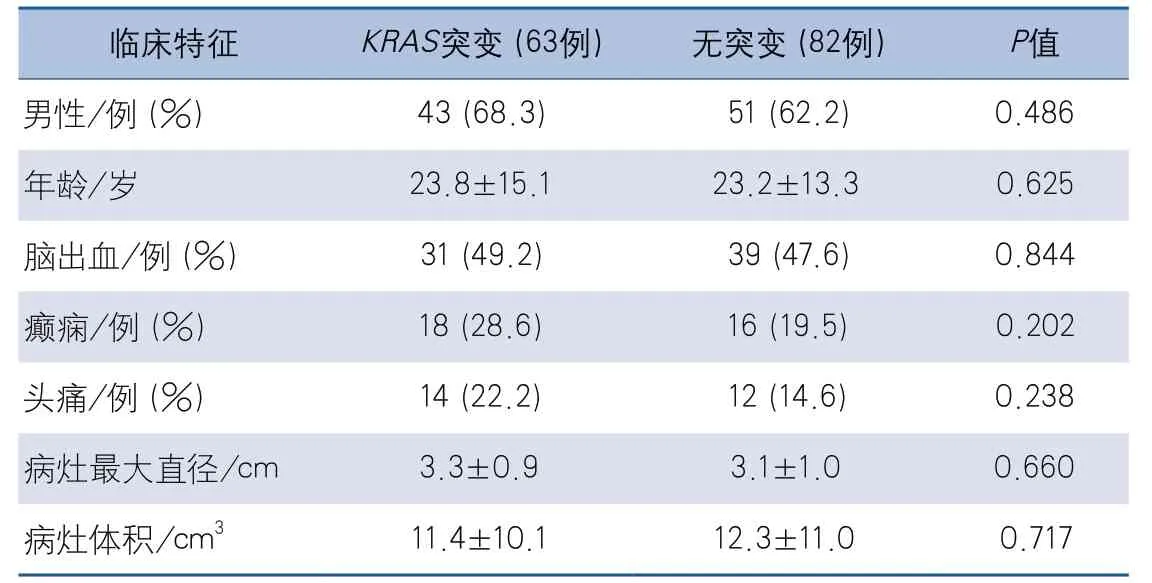
表2 KRAS突变组与无突变组临床特征比较
3 讨论
KRAS属于大鼠肉瘤病毒癌基因(rat sarcoma viral oncogene,RAS)家族,RAS是一种鸟苷三磷酸酶(guanosine triphosphatases,GTPase)开关信号蛋白,可以与鸟苷二磷酸(guanosine diphosphate,GDP)和鸟苷三磷酸(guanosine triphosphate,GTP)相结合,调控自身活动状态。RAS基因突变会破坏鸟嘌呤切换周期,并将RAS蛋白“锁定”在与GTP结合的功能状态,从而激活下游信号通路[10-11]。有研究发现KRAS突变发生于BAVM组织的内皮细胞,主要通过激活脑血管内皮细胞中的有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular regulated protein kinases,ERK)信号通路损伤内皮细胞连接[4]。
散发性BAV M的发病机制目前尚不清楚,但是最近的一项研究发现74%(29/39)的病例存在KRAS激活型体细胞突变[4]。动物实验发现,在小鼠内皮细胞中转入Kras突变基因能诱发BAVM,提示KRAS体细胞突变可能是BAVM发生的原因之一,而且仅KRAS基因的突变就足以在体内引发BAVM,提示KRAS突变与BAVM的发生与发展密切相关[12]。内皮间质转化是BAVM的重要病理特点,有研究显示KRAS突变可导致内皮-间质转化,推测内皮-间质转化可能是KRAS突变导致BAVM形成的机制或因素之一[9]。
由于检测技术、样本类型、测序深度和患者种族等不同,不同研究所报告的KRAS突变率存在一定差异。Nikolaev等[4]使用全外显子测序技术检测突变频率,将读长超过0.5%的KRAS变异定义为突变阈值,结果发现46.2%(12/26)的BAVM患者存在相应变异,而采用微滴式数字PCR(droplet digital PCR,ddPCR)检测,发现74.4%(29/39)的BAVM患者存在KRAS突变。研究者分析突变率差异的原因可能是由于读长在基因组上的异质性分布使得特定KRAS点上的读长覆盖度较低,从而导致假阴性结果,而ddPCR能够检出>0.1%突变阈值的基因,检测的准确性相对较高[13],另外,材料(包括新鲜样品和FFPE样品)的差异也可能影响KRAS突变的检测结果[12,14]。本研究在比既往研究更大的样本量中测定KRAS突变,结果发现43.4%(63/145)的BAVM患者存在KRAS突变,与既往研究数据相似。另外,本研究发现G12D突变是最常见的突变类型,也与既往多数研究一致[4-5,9]。此外,在本研究样本量较大的优势下,还发现了一些罕见报道的新的突变类型,如G12C和G12A。值得注意的是,针对G12C突变抑制药物的试验成功,提示KRAS等位基因特异性突变靶向治疗的有效性[15-16],本研究发现的一系列KRAS突变类型,为研发靶向突变药物提供了可能的位点信息。
有多项研究探讨了KRAS突变与BAVM患者临床特征之间的关系[5,7],但目前结论不一致。有研究者发现KRAS突变的病例多以出血为首发症状,还有研究者发现基因(包括KRAS和BRAF)的变异频率与脑和脊髓动静脉畸形病灶的体积呈负相关[5]。本研究未发现患者的临床特征如性别、年龄、脑出血、癫痫、病变最大直径和体积等指标与KRAS基因突变的关联,可能与研究的入选标准、病理取材、检测方式、样本量差异等原因有关。
本研究存在以下不足:首先,本研究中的病变样本是经过FFPE处理的BAVM组织,可能会导致基因检测的准确性下降;其次,本研究仅在KRAS的突变热点(chr12:25398284)附近扩增基因,可能错过其他KRAS突变的位点;再次,本研究未针对发现的不同突变类型进一步分析其与临床特点的关系。后续应进行前瞻性、更多样本量的深入研究来探索KRAS突变与BAVM的病理机制、临床表现的关系。
【点睛】本研究在较大样本量FFPE处理的BAVM组织中发现KRAS突变较常见,除了既往常见的突变位点G12D和G12V外,还发现了既往少见报道的突变位点,特别是G12C和G12A,为研发靶向突变药物提供了可能的位点信息。
