胃癌患者癌组织中PRKDC、FOXK1和RORα表达水平与TNM分期及微卫星不稳定的关系
2022-07-15徐绘婷陈冰燕於潇潇刘红利
徐绘婷,陈冰燕,於潇潇,刘红利
江苏省南通市肿瘤医院检验科,江苏南通 226000
胃癌属于消化系统恶性肿瘤,生存率低,是全球癌症相关死亡的主要原因之一[1]。截至目前,胃癌的病理机制尚未完全阐明。因此,探讨关于胃癌发生发展调控的关键分子,有助于早期胃癌的诊断和晚期胃癌的靶向治疗。DNA依赖性蛋白激酶基因(PRKDC)是DNA修复机制的重要组成部分。PRKDC在多种肿瘤中表达上调或下调,在多种癌前细胞中也有异常表达,提示PRKDC在肿瘤发生中可能起重要作用[2]。叉头框K1(FOXK1)是FOX转录因子的家族成员。其表达水平升高可促进肿瘤细胞增殖、周期转换等;研究发现FOXK1在多种实体瘤中高度表达,包括胃癌等,参与这些肿瘤的发生和发展[3]。有研究表明FOXK1的表达水平升高与胃肠道肿瘤的生长和侵袭存在紧密的关系,可作为此类肿瘤的治疗靶点[4]。视黄酸相关孤儿受体(RORα)在人体脂肪、骨骼肌和脑组织中含量较高[5],研究发现,RORα可调节糖代谢、炎症反应、癌症等[6]。微卫星状态是人类基因组中低于10个核苷酸的短重复序列,约占总基因的10%。微卫星不稳定(MSI)首先在遗传性非息肉病性直肠癌中发现,后来在乳腺癌和子宫内膜癌中发现[7]。目前,MSI在胃癌中被发现的研究甚少,本研究拟通过探讨胃癌患者癌组织中PRKDC、FOXK1和RORα水平与TNM分期及MSI的关系,旨在为临床胃癌的诊治提供新的方向。
1 资料与方法
1.1一般资料 选取2019年3月至2021年2月在本院胃肠外科行手术治疗的102例患者,术后病理检查结果均确诊为胃腺癌,且无肿瘤家族遗传史,术前均未进行放化疗。其中男64例,女38例;年龄44~76岁,平均(59.17±5.12)岁。根据国际抗癌联盟(UICC)于2010年制定的胃癌TNM分期标准将所有患者分为Ⅰ期11例、Ⅱ期35例、Ⅲ期56例。纳入标准:(1)通过病理检查确诊为胃腺癌,符合美国癌症联合委员会(AJCC)与国际抗癌联盟(UICC)联合制定的第7版恶性肿瘤TNM分期、日本第14版《胃癌处理规约》及我国原卫生部2011年版《胃癌诊疗规范》的诊断标准;(2)术前未进行放化疗等相关治疗;(3)临床资料完整;(4)术前均进行胃镜检查;(5)无精神和认知障碍。排除标准:(1)合并其他肿瘤;(2)手术切除不完整;(3)患有心、肝、肾等重要脏器功能障碍;(4)不配合研究;(5)中途退出研究。所有患者均签署知情同意书。本研究符合《赫尔辛基宣言》,经本院伦理委员会审批通过。
1.2方法
1.2.1MSI检测 采用饱和氯化钠法提取组织DNA。反应体积为20 μL,含引物0.4 μmol/L,10×变性裂解缓冲液2 μL,脱氧核糖核苷三磷酸200 mmol/L,TaqDNA聚合酶1单位,基因组DNA 200 ng。反应条件:95 ℃预变性5 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 60 s,共35个循环,72 ℃延伸10 min。PCR产物按1∶5的比例与变性裂解缓冲液混合。97 ℃变性10 min,立即将放入冰水中。160 g/L聚丙烯酰胺凝胶电泳4 h,电泳后银染。如果与正常组织相比,胃癌和癌前病变组织中有额外的DNA等位片段或等位片段游动,则可判断为MSI。如果没有,则是微卫星稳定(MSS)。
1.2.2PRKDC、FOXK1、RORα表达水平检测 将固定在10%中性甲醛溶液中并包埋在石蜡中的样品切成4 μm厚的薄片,用二甲苯脱蜡并逐渐用乙醇水合。切片在柠檬酸钠缓冲液中煮沸15 min以进行抗原修复。在3%双氧水中浸泡10 min,去除内源性酶。每片组织加50 μL山羊血清,封闭半小时。弃山羊血清,分别加入50 μL兔抗人PRKDC单克隆抗体、鼠抗人FOXK1单克隆抗体、RORα一抗孵育,4 ℃过夜。第2天,弃一抗后,加入二抗,孵育半小时,滴下DAB显色剂,显微镜下观察组织颜色。后苏木精复染。依次经70%、80%、90%、95%无水乙醇各5 min,二甲苯20 min后,用中性树脂封膜。在显微镜下观察PRKDC、FOXK1和RORα蛋白表达水平。
1.2.3结果判定 由3位医生分别进行阅片,并对不同意见的病例进行了观察和讨论,以达成一致意见。根据染色强度和染色细胞百分率进行表达水平评估。随机选取3个10×物镜大小的视野进行肿瘤细胞免疫染色半定量评估:0分为阴性,1分为弱阳性,2分为中等阳性,3分为强阳性;染色范围等级得分:0~1%为0分;>1%~25%为1分;>25%~50%为2分,>50%~75%为3分,>75%~100%为4分;根据上述两项得分的总和,将其分为3组:0~1分为阴性表达,>1~4分为弱阳性表达,>4~7分为强阳性表达。阳性表达包括弱阳性表达和强阳性表达。

2 结 果
2.1各期胃癌患者癌组织中PRKDC、FOXK1和RORα表达情况比较 Ⅰ期、Ⅱ期、Ⅲ期胃癌患者癌组织PRKDC、FOXK1、RORα表达水平比较差异有统计学意义(P<0.05),胃癌患者癌组织的PRKDC、FOXK1表达水平:Ⅰ期<Ⅱ期<Ⅲ期,胃癌患者癌组织的RORα表达水平:Ⅰ期>Ⅱ期>Ⅲ期,见表1。
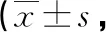
表1 各期胃癌患者癌组织中PRKDC、FOXK1和RORα表达水平比较分)
2.2胃癌患者癌组织中PRKDC、FOXK1和RORα表达水平与TNM分期的关系 以胃癌患者TNM分期(定义“Ⅰ期”=1,“Ⅱ期”=2,“Ⅲ期”=3)作为因变量,将各期患者的癌组织中PRKDC、FOXK1和RORα表达水平作为自变量,纳入多元线性回归模型,结果显示,胃癌患者癌组织中PRKDC、RORα与TNM分期均存在相关性(P<0.05),见表2。

表2 胃癌患者癌组织中PRKDC、FOXK1和RORα水平与TNM分期的关系
2.3MSS组和MSI组胃癌患者癌组织中PRKDC、FOXK1和RORα表达情况比较 根据MSI检测结果为2个组:MSS组52例,MSI组50例。MSS组胃癌患者癌组织中PRKDC、FOXK1表达水平均低于MSI组(P<0.05),RORα表达水平高于MSI组(P<0.05),见表3。
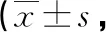
表3 MSS组和MSI组癌组织中PRKDC、FOXK1和RORα表达水平比较分)
2.4MSS组和MSI组胃癌患者癌组织中PRKDC、FOXK1和RORα免疫组化染色情况 PRKDC的阳性表达主要表现为细胞质不同程度着色,高表达时亦会出现细胞核染色;MSS组PRKDC阳性表达率为26.92%(14/52),MSI组PRKDC阳性表达率为78.00%(39/50);MSI组PRKDC的阳性表达率高于MSS组,差异有统计学意义(P<0.05)。FOXK1的阳性表达主要表现为细胞核着色;MSI组FOXK1阳性表达率为72.00%(36/50);MSS组FOXK1阳性表达率为5.77%(3/52);MSI组FOXK1阳性表达率高于MSS组,差异有统计学意义(P<0.05)。MSS组中RORα的染色强度高于MSI组。见图1。
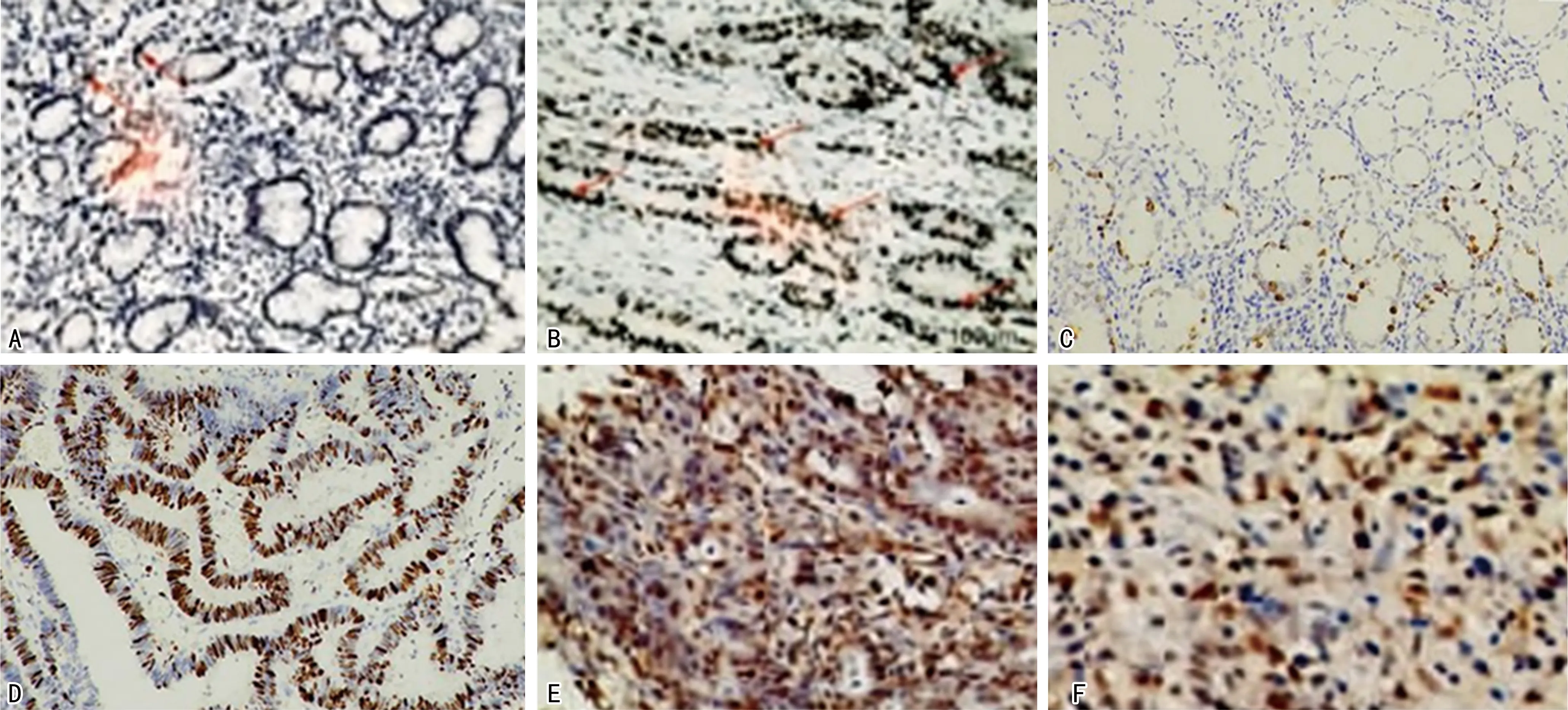
注:A为MSS组PRKDC染色情况;B为MSI组PRKDC染色情况;C为MSS组FOXK1染色情况;D为MSI组FOXK1染色情况;E为MSS组RORα染色情况;F为MSI组RORα染色情况。
2.5胃癌患者癌组织中PRKDC、FOXK1和RORα水平与MSI的关系 以MSI情况(定义“MSS组”=1,“MSI组”=2)作为因变量,将两组患者的癌组织中PRKDC、FOXK1和RORα表达水平作为自变量,纳入多元线性回归模型,结果显示,胃癌患者癌组织中PRKDC、FOXK1表达水平与MSI均存在相关性(P<0.05),见表4。
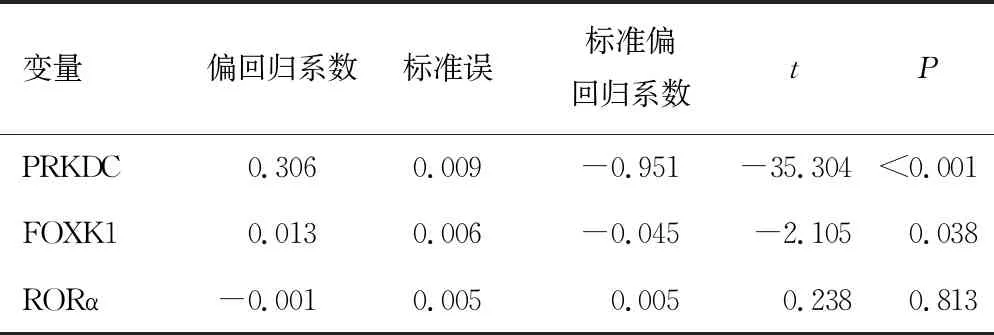
表4 胃癌患者癌组织中PRKDC、FOXK1和RORα水平与MSI的关系
3 讨 论
胃癌高病死率的原因之一是大部分患者被诊断时已为晚期,错过了最佳治疗时机[8]。研究发现,胃癌的标志之一是基因组的不稳定性,这与DNA损伤存在紧密的关系[9]。在DNA损伤的情况下,细胞周期可能受信号通路影响,使得细胞增殖减少。而在肿瘤细胞中,DNA损伤修复途径一般被破坏,导致肿瘤[10]。胃癌是一种病理机制复杂的恶性肿瘤。侵袭和转移是胃癌患者死亡和复发的主因。胃癌转移的途径有包括直接扩散、淋巴结转移、血行转移等。以上各途径都与很多促进胃癌细胞转移的基因有关,这些基因参与细胞迁移、上皮间充质转化、细胞外基质降解等过程[11]。因此,探索预测胃癌侵袭转移的基因对胃癌侵袭转移的早期诊断和预后判断具有重要的临床意义。
PRKDC是丝氨酸/苏氨酸蛋白激酶,是DNA损伤修复的关键酶。除修复双链DNA断裂外,其还参与调节DNA复制、T细胞表面抗原受体重组等[12]。作为一种转录因子,PRKDC调节某些基因表达,在细胞程序性死亡的信号转导中发挥重要作用[13]。研究发现PRKDC表达水平升高,与进展期胃癌和不良预后有关[14]。FOXK1作为FOX家族的成员,其在癌症中的作用有待解释[15]。有研究发现,FOXK1具有癌基因功能,FOXK1的表达水平升高可能促进胃癌的侵袭[16]。因此,FOXK1可作为一种生物标志物来辨别具有更多侵袭性表型的胃癌。恶性肿瘤的发生发展与癌基因的表达密切相关。体细胞的恶性增殖是恶性肿瘤发生的基础,RORα可参与内源性凋亡途径,RORα通过调节芳香烃受体核转运样蛋白1基因、时钟基因的表达,激活大量凋亡蛋白,导致相关凋亡因子的表达,使细胞凋亡呈现不可逆转的进展[17]。RORα参与胃癌的发生发展,调节肿瘤细胞的凋亡[18]。
本研究结果显示,胃癌患者癌组织的PRKDC、FOXK1表达水平:Ⅰ期<Ⅱ期<Ⅲ期,胃癌患者癌组织的RORα表达水平:Ⅰ期>Ⅱ期>Ⅲ期,提示不同TNM分期的胃癌患者其癌组织的PRKDC、FOXK1、RORα表达水平存在差异,且PRKDC、FOXK1表达随TNM分期的增加而不断降低,RORα表达水平随TNM分期的增加而不断升高。进一步分析显示,胃癌患者癌组织中PRKDC、RORα与TNM分期均存在相关性(P<0.05),提示PRKDC、RORα可作为TNM分期的预测因子,随着浸润的加深,PRKDC的表达水平逐渐升高。肿瘤分化程度越低,PRKDC的表达水平越高,可能与丝氨酸/苏氨酸蛋白磷酸化激酶的活性有关。PRKDC可介导肿瘤侵袭相关的多条信号通路,促进肿瘤侵袭[19]。有课题组应用免疫组化染色等实验证实RORα在人体胃癌组织中表达水平显著降低,并且其表达水平与人体胃癌组织的TNM分期显著相关[20],表明RORα的低表达可能参与胃癌的发生和发展,与本研究结果一致。胃癌的特征是宿主的遗传不稳定性,包括癌基因激活和MSI。由于MSI在直肠癌和遗传性非息肉病中发现,在肺癌、食管癌和子宫癌中也有报道,提示MSI也可能参与胃癌的发生和发展。MSI是一种短重复DNA序列(微卫星),发生高频缺失或插入,其是由基因组复制和转录时错配修复系统发生缺陷引起的,当这些蛋白基因发生突变时,会沉默相关蛋白的表达,导致MSI并诱发肿瘤[21],本研究结果显示,MSS组胃癌患者癌组织中PRKDC、FOXK1表达水平均低于MSI组(P<0.05),RORα高于MSI组(P<0.05),提示MSI的胃癌患者癌组织中PRKDC、FOXK1表达水平会升高,RORα表达水平会降低,进一步相关性分析结果显示,胃癌患者癌组织中PRKDC、FOXK1与MSI均存在相关性(P<0.05),提示PRKDC、FOXK1可作为胃癌患者MSI的预测因子。
综上所述,不同TNM分期的胃癌患者其癌组织的PRKDC、FOXK1、RORα表达水平存在差异,胃癌患者癌组织中PRKDC、RORα与TNM分期均存在相关性。MSI的胃癌患者癌组织中PRKDC、FOXK1表达水平会升高,RORα表达水平会降低,胃癌患者癌组织中PRKDC、FOXK1表达水平与MSI均存在相关性。
