蛋白质工程在饲料用酶研发中的应用研究进展
2022-07-15涂涛罗会颖姚斌
涂涛,罗会颖,姚斌
(动物营养学国家重点实验室,中国农业科学院北京畜牧兽医研究所,北京 100193)
蛋白质工程是指以蛋白质分子的结构规律及其生物功能的关系作为基础,采用理性设计、定向进化等技术手段,按照人们意志改变蛋白质的结构和功能或创造全新蛋白质的过程[1]。作为合成生物学中的一门核心基础学科,蛋白质工程对于催化元件功能的靶向定制做出了重要贡献,在食品、轻工、医药、饲料等众多行业中广泛应用[2]。饲料用酶制剂作为饲料添加剂领域最为热门的研究热点之一,以其无残留、无污染、无抗药性等强势优势被广泛推广和应用,极大促进了饲料行业的健康发展。在饲料中添加饲料用酶制剂,不仅可以补充内源消化酶的不足、降解饲料中抗营养因子,提高日粮营养的消化利用,而且还能调节肠道结构和功能,促进畜禽肠道健康,其应用效果已在世界范围内得到公认[3]。目前,《饲料添加剂品种目录》中包含饲料用酶制剂14种,分别为淀粉酶、α-半乳糖苷酶、纤维素酶、β-葡聚糖酶、葡萄糖氧化酶、脂肪酶、麦芽糖酶、β-甘露聚糖酶、β-半乳糖苷酶、果胶酶、植酸酶、蛋白酶、角蛋白酶、木聚糖酶。与其他酶制剂不同,这些饲料用酶在性能方面有着特殊的应用要求。第一,限于饲料加工制粒过程中瞬时高温的工艺要求,饲料用酶必须具有良好的热稳定性;而饲料用酶需要在畜禽体内发挥功能,因此又必须在生理温度下具有高活性。第二,作为饲料添加剂,饲料用酶需要在畜禽动物完整消化道中游离,因此饲料用酶必须在酸性到中性pH 范围内具有高活性。第三,在胃液到肠道环境中存在胃蛋白酶、胰蛋白酶等消化酶,因此饲料用酶必须具有良好的内源性蛋白酶抗性。绝大多数饲料用酶的综合性能都不能完全满足上述三方面的要求,严重影响了饲喂效果,从而限制了其应用和发展。
随着蛋白质工程技术的跨越式发展,基因挖掘、结构解析、分子设计等系统生物学技术为饲料用酶制剂的研发提供了广阔的知识与技术支持[4]。利用蛋白质工程技术,基于结构基础来改造和设计饲料用酶的酶学性能,从而满足饲料工业的应用需求。本文聚焦饲料用酶的热稳定性、pH 依赖性、蛋白酶抗性和催化活性等4 个方面,综述了计算机辅助的蛋白质理性设计技术在饲料用酶制剂研发中的应用研究进展,并展望了未来饲料用酶制剂分子改良的重点方向。
1 热稳定性
饲料制粒加工条件通常为75~85 ℃处理1 min左右,长时间的高温处理一方面会导致淀粉糊化、原料结构改变,另一方面也会使热敏性饲料添加剂失活[5]。因此,饲料用酶在80 ℃条件下短时间处理后的剩余酶活成为评价饲料用酶在热稳定性方面是否具有应用潜力的核心指标[6]。随着结构生物学和生物信息学的迅速发展,基于结构基础的酶热稳定性理性设计准确率也得到了显著提升。表1列举了近几年中在酶热稳定性理性设计方面表现突出的软件。这些策略从不同角度优化了饲料用酶的结构构象,如氢键、盐键、二硫键、疏水核心等,从而实现局部作用网络乃至整体结构的刚性增强,导致饲料用酶的热稳定性提高。例如,Dotsenko 等[21]利 用PremPS 和mCSM 的 计 算方法对Penicillium canescens木聚糖酶E 的自由能进行优化并指导设计了6个热稳定性突变体,经试验验证确认获得4个正突变体(A45V、S104M、E177P和A341P),它们的Tm值较野生型提高了1.1~3.1 ℃,在70 ℃下的半衰期较野生型提高了1.3~1.7 倍。Navone 等[22]通过在大肠杆菌植酸酶AppA中引入二硫键(L28C/W360C)后,在不影响酶活的前提下(野生型和突变体的比活分别为1150 U/mg±138 U/mg 和1273 U/mg±238 U/mg)使得其在85 ℃条件下处理20 min 后的剩余酶活由野生型的2%提高到47%。以上述研究结果为代表,一方面说明了以结构基础为指导的饲料用酶热稳定性设计准确率可观,但另一方面也提示表征饲料用酶热稳定性的参数很多,不同的研究者选用了不同的参数进行热稳定性研究,因此,有必要对热稳定性参数进行统一和细分。
事实上,酶热稳定性可以拆分为热力学稳定性和动力学稳定性两大类[23]。热力学稳定性与酶蛋白折叠和解折叠构象间的平衡相关[24],不同的热力学参数,如解折叠自由能(unfolding free energy,∆Gu)、解折叠平衡常数(unfolding equilibrium constant,Ku)、解链温度(melting temperature,Tm)、变性浓度(denaturing concentration,Cm)等都可以用来表征酶的热力学稳定性。而动力学稳定性与酶蛋白不可逆失活的速率有关,表征参数如最适温度(temperature of maximum enzymatic activity,Tmax)、半失活温度(temperature at which 50% of the maximal activity of an enzyme is retained,T50)、半衰期(half-life,t1/2)、表观失活速率常数(apparent inactivation rate constant,kobs)等[25]。尽管酶蛋 白的解折叠和失活存在一定关联度,但它们是两个完全不同的过程。从应用角度来讲,理想中的饲料用酶需要保持足够长时间的活性状态(即动力学稳定性),而不完全是在长时间内保持折叠状态(即热力学稳定性)[26]。而从计算设计角度来看,通过表1中列举的不同策略优化饲料用酶的刚性结构,能够直接改善的是饲料用酶热力学稳定性[27-29](图1)。这些饲料用酶的热力学稳定性提高后会导致其动力学稳定性有不同程度的提高,二者的关联机制还有待进一步的深入研究。Tu 等[30]以嗜热多聚半乳糖醛酸酶为研究材料,针对表面极性氨基酸进行丙氨酸扫描实验,获得了一个显著影响酶动力学稳定性的突变体T284A。突变体T284A的Tm值与野生型相当(仅低1.4 ℃),但是在60 ℃下的t1/2由野生型的1242.7 min 减少到41.6 min,晶体结构分析表明残基Thr284 的羟基通过与Gln255的Cα原子间形成一个碳氧氢键来稳定残基Gln255的侧链构象,从而促进酶动力学稳定性提升。这一研究理论有效指导了该酶的热稳定性进一步提升,在80 ℃下的半衰期提高了15倍[31],达到了饲料用酶在热稳定性方面的应用要求。
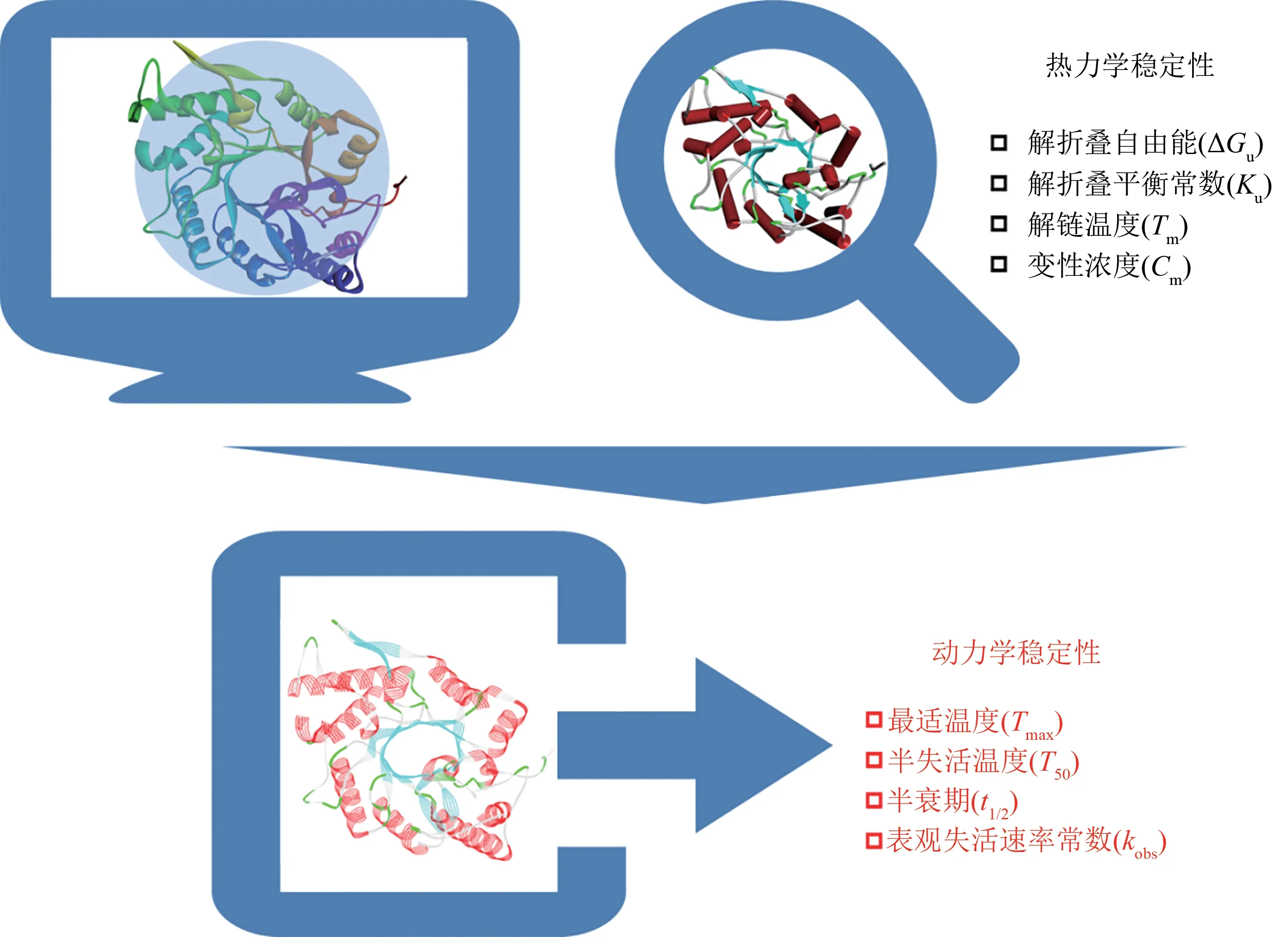
图1 计算机辅助的饲料用酶热稳定性分子设计Fig.1 Computer-aided molecular design for thermo-tolerant feeding enzymes

表1 用于酶热稳定性设计的软件总结Tab.1 Summary for the software used for designing thermo-toler enzymes
除了计算策略本身的设计思路,合成生物学中定量化、标准化和模块化的指导策略也在饲料用酶热稳定性分子改良中得到应用。Liu 等[32]以两个耐热性差异显著的β-甘露聚糖酶(最适温度分别为90 ℃和70 ℃,序列一致性为73%)为核心研究材料,确定了N末端和C末端两个模块为β-甘露聚糖酶热稳定性的重要影响区域。进一步针对N末端和C末端进行局部划分,分别找到两个关键的氨基酸位点:将N 末端中的His112 和Phe113 位点分别突变为Tyr 后,Tm值提高了7.6 ℃,75 ℃下的半衰期提高了7.5 倍;将C 末端中的Leu375 和Ala408 位点分别突变为His 和Pro 后,Tm值提高了5.6 ℃,75 ℃下的半衰期提高了1.5倍。将上述4个位点进行组合突变后,得到的四点突变体Tm值和75 ℃下的半衰期分别较野生型提高了13.8 ℃和89倍。类似的,Zheng等[33]基于糖苷水解酶第5家族纤维素酶的βα 八筒状结构进行拆分,将每个βα基序作为一个模块对两个热稳定性差异明显的纤维素酶(最适温度分别为90 ℃和60 ℃,序列一致性为51%)进行杂合组装,发现β1α1、β2α2 和β3α3三组基序对纤维素酶的热稳定性起重要作用。与野生型相比,杂合酶的最适温度提高了20 ℃,Tm值提高了22.9 ℃,55 ℃下的半衰期提高了650倍。
针对饲料用酶这样的生物大分子,想要通过简单地突变一个或两个氨基酸来获得耐热性能满足饲料工业应用需求的突变体是不太现实的,合成生物学中全局调控的思路给饲料用酶的热稳定性分子改良指明了方向。Bu 等[34]采用FRESCO(framework for rapid enzyme stabilization by computational libraries)策略对木聚糖酶的热稳定性进行了理性设计。基于FoldX、Rosetta_ddg 和ABACUS 3 种算法从酶蛋白全局的角度对Neocallimastix patriciarum木聚糖酶进行能量计算,选取所有能量值降低的突变体组成虚拟突变体库(库容量为293)。然后,借助分子动力学模拟的技术手段对虚拟突变库中的突变体进行监测和评估,发现其中的188个突变体对木聚糖酶的稳定性会造成不利的影响。因此,选择其余的105个突变体进行试验验证,获得了10 个热力学稳定性显著提高(∆Tm>1 ℃)的单点突变体,进一步组合突变后获得了一个四点突变体XynCDBFV-m,其Tm值和最适温度分别较野生型提高了14 ℃和10 ℃,提高幅度非常明显。葡萄糖氧化酶作为一种重要的抗生素替代用酶,可通过非药物性机制和途径杀菌抑菌,改善肠道微生态,是饲料用酶制剂中的明星酶种[35-36]。然而,自然环境中筛选得到的葡萄糖氧化酶均属于中温酶,不能满足饲料用酶的耐热性能要求[37]。因此,在没有嗜热酶作为参考模板的前提下,Tu 等[38-39]基于合成生物学中工程学的设计理念,综合了随机突变、酰胺基优化、疏水核心优化、蛋白表面电荷优化、N-糖基化修饰、辅基稳定、能量计算等多种策略对葡萄糖氧化酶的热稳定性进行定向进化研究,经过多角度的设计与改造,使得葡萄多糖氧化酶的80 ℃条件下处理2 min 后的剩余酶活由野生型的完全丧失提高到80%,解决了该酶耐热性能差无法满足饲料工业应用的行业性瓶颈问题,目前该嗜热突变体已实现了产业化生产。
2 pH依赖性
饲料用酶需要在动物胃肠道内发挥作用。以家禽动物为例,鸡嗉囊、腺胃和肌胃的pH 环境分别为4.5~5.5、3.7~3.9和2.0~2.2,而饲料在整个消化道食糜排空的时间为32 h[40]。因此,饲料用酶的最适作用pH 应该为酸性且在酸性胃液环境至肠道中性环境的范围内(pH 1.5~8.0)具有高活性。因此,最适pH 值和酸稳定性是衡量饲料用酶在pH 依赖性方面是否具有应用前景的重要依据[41]。目前,人们普遍认为酶的最适pH 值与其催化残基的pKa值(酸度系数)大小紧密相关[42]。于是,基于一些pKa值预测软件如H++[43]、CpHMD(continuous constant-pH molecular dynamics)[44]、pKD[45]、PROPKA[46]等可有效改变饲料用酶催化残基pKa值,进而实现饲料用酶pH 依赖性的分子设计。例如,Cockburn 等[47]针对不同最适pH 值的纤维素酶序列进行统计分析设计突变体,并利用H++和PROPKA 软件评估突变位点对催化残基pKa值变化的影响,获得了3个在pH5.0下活性显著提高的突变体。Wang 等[48]基于PROPKA 的预测结果,对Bacillus subtilis α-淀粉酶催化残基周围0.45 nm 以内的氨基酸进行设计,获得了3 个最适pH 值下降0.5~1.5 个单位的突变体。Ludwiczek等[49]针对Bacillus circulans木聚糖酶进行了更为大胆的尝试,直接将酸/碱亲核试剂残基Glu172 突变为His以调整其pKa值,成功将酶的最适pH 值由5.6 降低到4.7,但遗憾的是酶活力只剩余了8%。试验结果充分说明了催化残基的pKa值大小直接决定了酶最适pH值的高低。
通常来讲,调整酶催化残基pKa值的策略主要有3种(图2):①基于静电作用原理在催化残基周围引入带负电荷氨基酸或带正电荷氨酸从而提高或降低其pKa值。②基于氢键作用网络通过催化残基作为氢受体或供体从而提高或降低其pKa值。③基于疏水作用力通过催化残基的羧基基团去质子化从而提高其pKa值。以具有典型的β jelly-roll三维结构的糖苷水解酶第11 和12 家族木聚糖酶和葡聚糖酶为例[50-51]。它们催化口袋中起酸/碱亲核试剂作用的催化残基周围存在一个最适pH 依赖的关键氨基酸位点,在嗜酸饲料用酶中该位点为天冬氨酸,在嗜中性饲料用酶中该位点则为天冬酰胺。将嗜酸饲料用酶中的天冬氨酸突变为天冬酰胺之后,可导致最适pH 值升高(木聚糖酶突变体D37N最适pH值由2.8提高到5.5;葡聚糖酶突变体D98N 最适pH 值由4.0 提高到5.1),反之相反。结构分析表明,嗜酸木聚糖酶中氨基酸Asp37侧链与酸/碱亲核试剂催化残基间形成稳定的氢键网络,当该氨基酸被突变为天冬酰胺后通过破坏氢键作用力从而改变了催化残基pKa值,使得最适pH 值升高。Pokhrel 等[52]尝试在Bacillus circulans木聚糖酶催化残基Glu72 和Glu178 周围引入带正电荷氨基酸Arg 以降低催化残基的pKa值,获得了4 个最适pH 值向酸性方向偏移0.5~1.5 个单位的突变体。进一步,Li 等[53]利用高分辨率X 射线晶体衍射技术、中子晶体学技术和CpHMD 模拟技术对糖苷水解酶第11 家族木聚糖酶pH 依赖性的结构基础进行了研究,发现随着反应体系pH 值的升高,氨基酸残基Y88 与催化残基E177 之间的氢键键长缩短,有力阻止了氨基酸E177 的侧链向下旋转从而无法从水分子中获得质子高效反应。这一研究理论将会有效指导饲料用酶的pH依赖性分子设计。

图2 调整饲料用酶催化残基pKa值的3种策略[42](1)静电作用:在催化残基周围引入带负电荷氨基酸或带正电荷氨酸从而提高或降低其pKa值;(2)氢键作用:通过催化残基作为氢受体或供体从而提高或降低其pKa值;(3)疏水作用:通过催化残基的羧基基团去质子化从而提高其pKa值Fig.2 Strategies for adjusting the pKa value of catalytic residues in feeding enzymes[42](1)Electrostatic interactions:Introducing the negatively or positively charged amino acids around catalytic residues to increase or decrease the pKa value;(2)Hydrogen-bond interactions:Acting as the hydrogen acceptor or donor of catalytic residues to increase or decrease the pKa value;(3)Hydrophobic interactions:Deprotonation of the carboxyl group of catalytic residues to increase the pKa value.
值得注意的是,尽管在酶催化口袋中催化残基的周围进行理性设计可以有效调节其pKa值进而改变酶的最适pH 值,但与此同时也会大幅度影响酶的催化活性[54],这对于饲料用酶的实际应用非常不利。因此,在酸性条件下保持稳定和高催化活性的饲料用酶pH 依赖性分子设计策略仍旧是蛋白质工程研究领域的重点。Li 等[55]为了不影响酶催化活性,着眼于酶蛋白表面带负电荷的氨基酸进行理性设计,将5 个酸性氨基酸均突变为Arg 之后,最适pH 值变化了2 个单位,由4.5 提高到了6.5,且催化效率提高了10.7 倍。Xia 等[56]发现O-糖基化修饰严重影响了β-葡萄糖苷酶的pH 稳定性,将序列中O-糖基化特征基序突变后使得酶的耐受范围从pH 4.0~5.0拓展到pH 3.0~10.0,且底物转换数kcat由1664 s−1提高至1791~2136 s−1。此外,Zhou等[57]转换了研究思路,基于植酸酶的结构基础进行设计,以期将该酶的pH 反应曲线向上平移,获得了4 个在pH5.0 条件下活性提高的突变体。Ma 等[58]利用人工神经网络结合Lasso 线性回归方法对糖苷水解酶第11 家族木聚糖酶中影响最适pH 值的氨基酸位点进行统计分析,获取了8 个正突变体,它们的最适pH 值较野生型相比向酸性方向偏移了0.5~0.75 个单位,酶活维持在野生型的80%以上。尽管这些策略均有效实现了饲料用酶的活性和pH 依赖性双重设计,但与酶稳定性的设计效果相比,仍有较大提升空间。
3 蛋白酶抗性
在畜禽动物的消化胃肠道中,会存在一些内源性蛋白酶,如胃蛋白酶、胰蛋白酶、糜蛋白酶等。在饲料中添加饲料用酶制剂,被畜禽动物食用进入消化道后,抵抗内源性蛋白酶的降解特性成为了饲料用酶制剂的必要属性[59]。这些内源蛋白酶对蛋白质的水解位点是保守的,如胃蛋白酶倾向于剪切氨基端或羧基端为芳香族氨基酸(如苯丙氨酸、色氨酸和酪氨酸)或亮氨酸的肽键,胰蛋白酶专一性识别Arg/Lys 产生以Arg 和Lys 为碳末端残基的肽段。因此,基于这些专一性的蛋白酶识别位点进行理性设计成为了首选策略,试图通过消除蛋白酶的水解位点来增强饲料用酶抗内源性蛋白酶水解的能力(图3)。如Qiu等[60]针对黄曲霉素解毒酶中所有的Arg 和Lys 残基展开分析,选取位于酶蛋白表面的45 个残基为靶标位点,结合分子对接技术和分子动力学模拟技术设计出6个突变体并进行试验验证,结果表明其中两个突变体(K213C/K244Q/K270T、R356E/K357T/R623C)抗胰蛋白酶水解能力较野生型分别提高了1.93倍和2.73倍。

图3 饲料用酶对蛋白酶抗性的分子设计Fig.3 Design strategies for feed enzymes to resist the degradation of proteases
Niu等[61-64]针对植酸酶的蛋白酶抗性分子设计展开了系统研究。首先,以3个蛋白酶抗性差异显著的植酸酶(序列一致性为83%)为核心研究材料进行序列统计分析,选择位于蛋白表面的Leu99、Leu162 和Glu230 3 个残基为候选突变热点[61]。与胃蛋白敏感的野生型植酸酶YeAPPA 相比,突变体E230G 抗胃蛋白酶降解的能力提高幅度高达447倍,而且这一有益突变位点还显著提高了酶催化效率(2.1 倍)和在pH 1.0~1.5 条件下的稳定性(处理1 h 后剩余酶活由野生型的63.7%~77.0%提高到92%以上)。随后,该团队继续瞄准位于植酸酶表面的胃蛋白酶/胰蛋白酶切割位点进行分子设计[62]。与胃蛋白敏感的野生型植酸酶YeAPPA 相比,3 个突变体(F89S、K226H、F89S/K226H)抗胃蛋白酶降解的能力提高幅度高达228~447 倍。将这一策略引入到α-半乳糖苷酶的胃蛋白酶抗性分子设计中,效果也非常明显[63]。这一系列研究结果表明基于保护饲料用酶结构表面的内源性蛋白酶切割位点策略可有效增强饲料用酶抵抗蛋白酶水解的能力。基于这一结论,该团队进一步尝试在植酸酶结构表面引入N-糖基化修饰从而阻断蛋白酶与其切割位点的接触,以此达到抵抗蛋白酶水解的目的[64]。通过在植酸酶YeAPPA 蛋白表面引入N-糖基化修饰基序,使得酶经过胃蛋白酶处理2 h 后的剩余酶活由野生型的不到1.3%提高到了21.1%~32.1%以上。胃蛋白酶抗性能力显著增强的内在原因表现在两个方面:一是N-糖基化修饰增强了酶在pH 1.0~2.0 条件下的稳定性;二是N-糖基化修饰有效阻止了胃蛋白酶与其切割位点的接触,从而导致酶蛋白抵抗胃蛋白酶水解能力的提高。Hu 等[65]将该方法引入到β-甘露聚糖酶对蛋白酶抗性的分子改造中,获得的两个突变体g-347 和g-123 在经胃蛋白酶处理2 h 后的剩余酶活由野生型的约50%提高到75%~85%。说明该方法对饲料用酶抵抗蛋白酶能力的分子设计具有一定的普适性效果。
Wang等[66]基于酶束缚态形成的抑制过程建立了一套针对饲料用酶蛋白酶抗性的分子改造策略。选取β-葡萄糖苷酶BGL1 为研究材料,通过预测分析BGL1与胃蛋白酶互作的复合物结构信息,获取复合物构象中的关键氨基酸位点,最后基于分子动力学模拟技术优化并设计胃蛋白酶抗性突变体。实验结果表明:获得的两个突变体Q627C 和Q627C/R543H/R646W 的胃蛋白酶抗性半衰期较野生型分别提高了1.36 倍和1.51 倍,胰蛋白酶抗性半衰期较野生型分别提高了0.93 倍和1.53 倍。这一策略是前面蛋白酶抗性分子改造方法的有力补充,对饲料用酶蛋白酶抗性分子设计的通用性方法的建立提供了技术支撑。
4 催化活性
饲料用酶的催化活性是评价其效价的首要参考指标,决定了其应用成本。所以,酶的催化机理解析以及活性提升一直是酶学领域的热点研究问题[67]。活性口袋是酶蛋白发挥催化功能的直接部位,基于活性口袋的分子设计成为了提高酶催化效率的有效手段[68]。Tu 等[69-71]针对多聚半乳糖醛酸酶的活性口袋展开了系统的研究。首先,基于多聚半乳糖醛酸酶晶体结构的构象分析、酶-六聚半乳糖醛酸底物分子对接结果和分子动力学模拟轨迹分析,研究了位于活性T3 loop 区上的Asn117 位点对于锚定底物的催化构象起到的关键作用[69]。对该位点进行定点突变,导致底物转化数kcat值由野生型的60 000 s-1下降到3~15 000s-1,说明活性T3 loop区对该酶催化效率的影响非常大。于是,该团队进一步对活性T3 loop 区展开设计,试图提高该酶的催化活力[70]。利用CAVER3.0.2 软件对酶催化通道进行预测并结合活性T3 loop 区的序列统计分析,找到非活性位点Thr113,将该位点突变成Lys 或Arg 后可使得酶催化效率较野生型提高28%~50%,其提升的分子机理为非活性位点Thr113 的突变改变了活性T3 loop 区的柔性进而影响了酶与底物之间的结合。在对多聚半乳糖醛酸酶与底物的分子动力学模拟时发现,在催化口袋内部活性T3 loop 区上存在氨基酸残基Asp129,其侧链羧基与−2 位底物上的羧基通过一个Na+稳定[71]。对该位点进行虚拟饱和突变后并分别进行分子动力学模拟分析,发现将Asp129 突变为Lys后其侧链可直接与底物结合,进一步试验结果表明结合力ka值提高了50%,酶催化效率提高了4.7 倍。研究结果显示了活性loop 区对调控酶的催化效率发挥了重要作用。
与此同时,上述研究结果也说明针对催化口袋上的活性loop区进行分子设计,可有效改善酶的催化效率。Yang 等[72]研究了活性loop3 对糖苷水解酶第12家族催化效率的影响机理,较长的loop3可以加强酶-底物之间的氢键作用网络从而有利于酶解产物的释放。Zheng 等[73]将该研究方法引入纤维素酶的催化效率分子改良研究中,将loop6 上的残基Asn233突变成Ala或Gly后使得酶催化效率较野生型分别提高了45%和52%。Yu 等[74]等也借鉴此方法成功获得将内酯水解酶催化活力分别提高2.9倍和3.4倍的突变体。Singh等[75]利用该方法对糖苷水解酶第5 家族葡聚糖酶进行分子设计,将L11 loop区上的Asp256突变为Gly使得酶催化效率提高了22 倍。尽管基于活性loop 区对酶的分子设计已得到了较好的研究进展,但是其完整功能的结构基础还需进一步研究,这也是基于活性loop区设计提升酶催化效率的前提。
随着研究的不断深入,人们逐渐发现酶的催化活性不仅仅受限于其催化口袋的影响。例如,Wang 等[76]发现Bacillus subtilis木聚糖酶XynLC9的N 末端残基可影响其催化效率,将残基Trp6/Gln7 突变为Phe/His、Asn8 突变为Tyr 后可分别使得酶催化活性提高2.6倍和1.8倍。Dong等[77]在瘤胃木聚糖酶的C 末端引入一段富含Pro 的肽段之后使得嵌合酶的催化效率较野生型提高了2.48 倍。Rubio 等[78]发现了不同位点的N-糖基化修饰对Aspergillus nidulans木糖苷酶BxlB 催化活性的影响程度不同,其中N5 位置的N-糖基化修饰对提高酶催化活力起主要作用,而N1 和N7 位置的N-糖基化修饰对提高酶催化活力起辅助作用。Zhang等[79]发现了不同的linker 长度影响了α-淀粉酶的催化活性,在野生型的基础上延长了linker 长度使得酶催化效率提高了67%,但进一步延长linker 长度后,酶催化效率提升幅度变小,较野生型仅提高43%。这一系列的研究结果表明,针对绿色、高效的饲料用酶蛋白催化反应机理还有待进一步的深入研究,除了酶蛋白直接与底物发生相互作用的催化口袋外,其他区域对酶催化活性的影响同样不可忽视。如Kim 等[80]发现了在Cryptopygus antarcticus甘露聚糖酶的结构表面存在底物二级结合位点Trp147,可通过σ-π键作用力锚定甘露五糖底物。
也正是因为影响酶蛋白结构构象的因素呈现多样化的特点,其综合性能也会表现出相互平衡调节的现象,最直观的体现是当酶稳定性得到提升时其催化活性会对应的损失。如Wang 等[81]等对Streptomycessp.S9 木聚糖酶进行理性设计,获得了Tm值和在70 ℃下的t1/2提高7 ℃和9 倍的突变体,但该突变体的催化效率较野生型相比却下降了6.1 倍。因此,借助合成生物学中全局调控的思路对饲料用酶的综合性能进行分子设计成为了当前的首选策略。如Min 等[82]针对糖苷水解酶第11 家族木聚糖酶的结构柔性进行分析,重点围绕中温酶和嗜热酶的柔性区域差异进行设计,获得了催化效率提高7.51 倍、构象稳定性提高0.7 ℃的突变体。Ren 等[83]围绕碱性蛋白酶PROK 的催化三联体周围1 nm 范围的氨基酸残基,经过B 因子、溶剂可接触、保守性等角度的综合设计,获得了催化活性较野生型提高20%、60 ℃下稳定性明显提升的突变体。尽管这些有益探索取得了一定效果,但提升幅度仍有较大空间。
5 总结与展望
我国是畜禽养殖和饲料生产大国,2021 年产饲料达2.93 亿吨。饲料用酶制剂作为绿色、环保的饲料添加剂,在提高饲料利用率、降低饲料生产成本、减少环境污染物排放等多方面发挥了巨大作用。饲料用酶的催化性能是决定其应用功效的核心因素,直接关系到饲料用酶的效价。人们试图从环境中直接获取综合性能优良的饲料用酶基因,如Cheng 等[84]开发一个基于宏基因组测序结果快速获取目标基因的新策略。但限于绝大多数直接从自然环境中获得的饲料用酶综合性能都不能完全满足饲料用酶制剂在热稳定性、pH 依赖性、蛋白酶抗性和催化活性等4 方面的要求,因此,催化性能的提升是饲料用酶制剂研发过程中必不可少的一个研究环节。
随着结构生物学和生物信息学的快速发展,蛋白质工程技术在提升饲料用酶催化性能方面得到空前应用。如前所述,针对饲料用酶的催化活性和热稳定性的研究策略多样、提升效果相对明显,且实现了二者同时提升的重大突破,显著提升了饲料用酶制剂的效价。如武汉新华扬生物股份有限公司先后推出的亮点产品赛乐植酸酶、耐热植酸酶、超级GOD4000、超级GOD10000 等,既保证了饲料用酶的应用效果,保护了生态环境,也大大降低了饲料用酶制剂的生产成本,实现了经济效益、社会效益、生态效益“三赢”。尽管如此,在不影响酶活性的前提下对饲料用酶综合性能提升的分子设计依旧是未来的研究重点。如前所述,针对饲料用酶单一性能的分子改造技术已经有了非常好的研究进展,如何利用合成生物学的思想从酶蛋白全局角度出发以综合提升饲料用酶的催化性能,为蛋白质工程研究者们提出了巨大的挑战。
此外,饲料用酶作为一种应用导向极强的饲料添加剂,在蛋白质工程技术方面的发展方向主要有以下几点:一是秉承以应用效果为导向的饲料用酶分子设计。饲料原料中的组成成分是极其复杂的,除了主链多糖以外还存在大量的分支侧链多糖,因此基于单一组分标准底物设计的高催化活性饲料用酶突变体在实际应用场景中很难高效发挥作用。二是多功能酶的分子设计。除了多结构域多功能酶外,近年还发现了单结构域双功能酶以高效降解复杂底物的主链和侧链部分。如Cao 等[85]发现了一个单结构域双功能酶——乙酰酯酶/木糖苷酶,采用各自的催化口袋分别对木聚糖主链和侧链多糖进行水解,这为饲料原料的高效利用指明了新的方向。三是在重视饲料用酶的热稳定性研究的同时,需关注饲料用酶在生理体温下的活性。由于饲料制粒加工工艺的要求,热稳定性的提升一直是饲料用酶工程领域的持续研究热点,但最终饲料用酶是需要在动物体内的胃肠道里发挥作用的。大多数酶热稳定性的设计结果是将其最适温度曲线向右平移,导致低温下的活性降低,而You 等[86]针对耐热木聚糖酶的loop区段进行设计,获得的有益突变体M173E/N269G最适温度曲线向上平移,在保证热稳定性提高的同时实现了低温条件下活性的提升。四是新技术的开发。酶分子设计技术的持续创新是饲料用酶不断发展的核心动力。如大数据人工智能技术已被应用于提高酶的蛋白表达量上[87]。这些新技术的实施有望推动饲料用酶制剂的研发迈向新的台阶。
