耻垢分枝杆菌精氨酸代谢变化对细菌毒力及肺上皮细胞线粒体功能的影响
2022-07-15周紫薇李烨雨王玉臣
周紫薇,林 晨,李烨雨,王玉臣,张 鹭
(复旦大学生命科学学院遗传工程国家重点实验室,上海 200438)
20世纪90年代初,全球结核病疫情开始呈现出上升趋势,特别是结核分枝杆菌(Mycobacterium tuberculosis,MTB)和人类免疫缺陷病毒共感染、耐药、耐多药(multi-drug resistance,MDR)和广泛耐药(extensively-drug resistance,XDR)菌株的不断出现,使结核病成为世界范围内的公共卫生问题。2019年,全球约有1 000万人患上结核病,其中约有140万例结核病患者死亡,因MDR结核病死亡的患者约18.2万例[1]。作为胞内致病菌,MTB与宿主细胞的相互适应及调控机制,是值得关注的重要科学问题。
精氨酸不仅是细菌蛋白质合成中重要的氨基酸,还可以作为细菌生长的唯一氮源,甚至是碳源和能量来源[2],它是合成多胺的底物,对细菌的极端耐酸能力非常重要。此外,精氨酸胍基参与多种生命活动,涉及许多调节和组织特征的复杂相互作用,包括与蛋白质和核酸的相互作用,对细菌的生理和致病性有重要影响,了解精氨酸代谢对于病原和宿主的影响有重要意义。精氨酸从头合成通路受到破坏会使细胞内精氨酸供应不足,中间产物和活性氧积累,并发挥快速杀菌的作用[3],这个合成通路涉及多种酶的作用,相应编码基因构成ARG box,位于argC上游启动子区域;抑制性转录调控因子ArgR可在精氨酸存在的情况下与ARG box结合,抑制该通路的转录。
耻垢分枝杆菌(Mycolicibacterium smegmatis,M.smeg)与MTB的同源基因超过2 000个,具有较MTB更为广泛的天然耐药谱,迄今为止,唯一获批的抗结核新药苯达奎林就是以M.smeg作为模式菌株进行筛选而确证的[4]。MTB中的11个双组分系统和5个组蛋白激酶(共7个)均与M.smeg具有高度同源性,缺氧持留下的相关基因也在M.smeg中被找到[5]。因此,M.smeg不仅可以作为筛选抗菌药物的良好模型,还是研究MTB基因表达和病原宿主互作的良好模式菌株。本研究中的精氨酸代谢途径已被证明在细菌中相对保守[6],分析精氨酸在M.smeg中的代谢途径,有助于对致病性MTB中精氨酸代谢特征的解析。肺泡上皮细胞是分枝杆菌入侵宿主细胞的第一道防线,分枝杆菌感染人类Ⅱ型肺上皮细胞的能力已被证实[7],其在人非小细胞肺癌细胞系A549中的增殖率比其他细胞高15~20倍[8],且具有一定的胞间播散能力[9-10]。已有研究发现,巨噬细胞感染过程中,M.smeg可以通过感染A549细胞转化为致病表型[11]。因此,本研究选择A549细胞作为模式细胞株,初步探索分枝杆菌精氨酸代谢变化对细菌-宿主相互作用的影响。
1 材料和方法
1.1 菌株和载体
大肠埃希菌(Escherichia coli) Trans 5α感受态菌株(北京全式金生物技术有限公司);耻垢分枝杆菌(M.smeg MC2155)野生型菌株(本课题组保存);pCR-Hyg质粒、pJV53-Cpf1质粒(中国医学科学院北京协和医学院结核病研究中心惠赠);A549细胞(本实验室留存)。
1.2 实验试剂和培养基
细菌基因组小量抽提试剂盒、胶回收试剂盒、质粒小量抽提试剂盒、聚合酶链反应(polymerase chain reaction,PCR)清洁试剂盒(美国Axygen公司);逆转录试剂盒(日本TaKaRa公司);Talent荧光定量试剂盒[天根生化科技(北京)有限公司];7H9液体培养基、7H10固体培养基(美国BD公司)。
1.3 M.smeg argR的敲除及验证
参考文献[12],利用Crispr技术构建argR敲除的M.smeg。RNA抽提:从-80 ℃冰箱中取出保存的细菌,在7H10平板上进行划线,37 ℃培养48 h后,挑取生长良好的单个菌落,37 ℃摇床培养至对数中期[600 nm处吸光度(A)值为0.8~1.0],1∶1 000接种至3 mL无抗7H9(含0.2%甘油、0.05%Tween-80和10%OADC)中,待其生长至对数中期,1 800×g离心10 min收取菌体,采用Trizol法抽提RNA。采用分光光度计(德国Eppendorf公司)定量,并使用逆转录试剂盒进行逆转录。逆转录得到的cDNA采用逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)和实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)进行验证。精氨酸代谢相关基因引物序列见表1。

表1 精氨酸代谢相关基因引物序列
1.4 细菌体外生长
将野生型mc2155M.smeg(WT)以及argR敲除的M.smeg突变株(ΔargR)在7H9培养基(含有0.05%Tween-80和10%ADC)中37 ℃过夜培养后,分别稀释至不含0.2%甘油和含0.2%甘油的7H9培养基(含有0.05%Tween-80)中,使A600nm值为0.05,37 ℃摇床培养。经预实验测定细菌生长曲线后,选取对数前期、对数中期、对数后期、稳定期菌液测量A600nm值。
1.5 细菌脂类代谢相关基因
严格按试剂盒要求,采用RT-qPCR对脂肪酸代谢相关基因进行验证。M.smeg脂类代谢相关基因及引物见表2。

表2 M.smeg脂类代谢相关基因及引物
1.6 细胞侵染
复苏A549细胞,用含10%胎牛血清的DMEM培养基培养,传代2次后,稀释至1×105个/mL,按每孔1 mL加至24孔板内,37 ℃培养24 h,使其完全贴壁。WT和ΔargR在7H9培养基(含0.2%甘油、0.05%Tween-80和10% OADC)中37 ℃过夜培养至A600nm值为0.8~1.0,取适量菌液1 800×g离心10 min,用磷酸盐缓冲液洗涤3次,使用含10%胎牛血清的DMEM稀释至MOI为25进行侵染,2 h后弃去细胞培养液,贴壁缓缓加入等体积磷酸盐缓冲液,轻晃平皿后弃去,用磷酸盐缓冲液洗涤3次后加入1 mL 0.1%Triton-X100,37 ℃孵育15 min,用1 mL枪头充分吹洗平皿,吹打混匀使细胞充分裂解,转移至1.5 mL Eppendorf管,用磷酸盐缓冲液(含0.05% Tween-80)稀释涂板。
1.7 CCK8细胞活力检测
按照上述细胞侵染条件在96孔板侵染CCK8细胞,分别于浸染2、18、24、48 h后测定细胞活力。吸净原培养基,换用新的DMEM完全培养基100 μL,迅速用排枪加入10 μL CCK8试剂,避免产生气泡,用摇板轻轻混匀,37 ℃培养箱避光孵育40 min,检测A450nm值。细胞活力(%)=[A(实验组)-A(空白)]/[A(对照组)-A(空白)]×100%。
1.8 细胞线粒体功能相关基因检测
严格按逆转录试剂盒要求,采用RT-qPCR对细胞线粒体功能相关基因UCP1、DNM1L进行验证。引物序列见表3。

表3 细胞线粒体功能相关基因及引物
1.9 统计学方法
采用GraphPad prism 8.0.2软件进行统计分析。两两比较采用t检验,多组间比较采用双因素方差分析(Two-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 M.smeg argR的敲除及验证
利用Crispr技术成功将第34和第35个氨基酸突变为终止密码子UAA,获得argR敲除菌株。argR敲除菌株内部2个连续的密码子被突变为2个终止密码子,但仍能够转录,因在RNA水平无法检测,故根据文献[12]的标准,测序结果符合实验设计要求即可判定敲除成功。分枝杆菌中位于argC起始位点的ARG box受转录调控因子ArgR的抑制。野生型M.smeg中,因为argR的表达,相关效应基因argB、argC、argD和argF表达受到抑制。为了从调控功能角度进一步验证ΔargR菌株中的argR表达缺陷,我们针对ARG box的效应基因设计RT-qPCR引物,检测相关基因的表达水平,结果见图1(argD由于表达量较低,无法检测,图中未展示)。argR表达缺陷的ΔargR菌株中,ARG box中效应基因的表达抑制作用被解除,argB、argC、argJ和argF转录水平均明显上调表达,从遗传调控功能角度验证突变株构建成功。
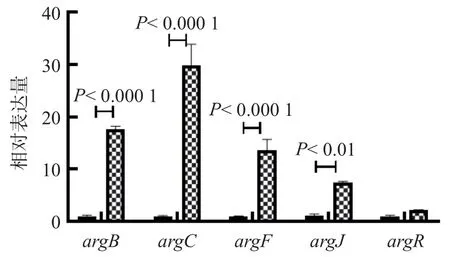
图1 Arg从头合成通路组成基因表达转录水平验证结果
2.2 细菌体外生长
细菌生长曲线见图2(a);在仅以葡萄糖为碳源的培养基中,ΔargR的生长情况优于野生型,见图2(b);在以甘油和葡萄糖为碳源的培养基中,ΔargR的生长优势被中和,与WT趋于一致,见图2(c)。
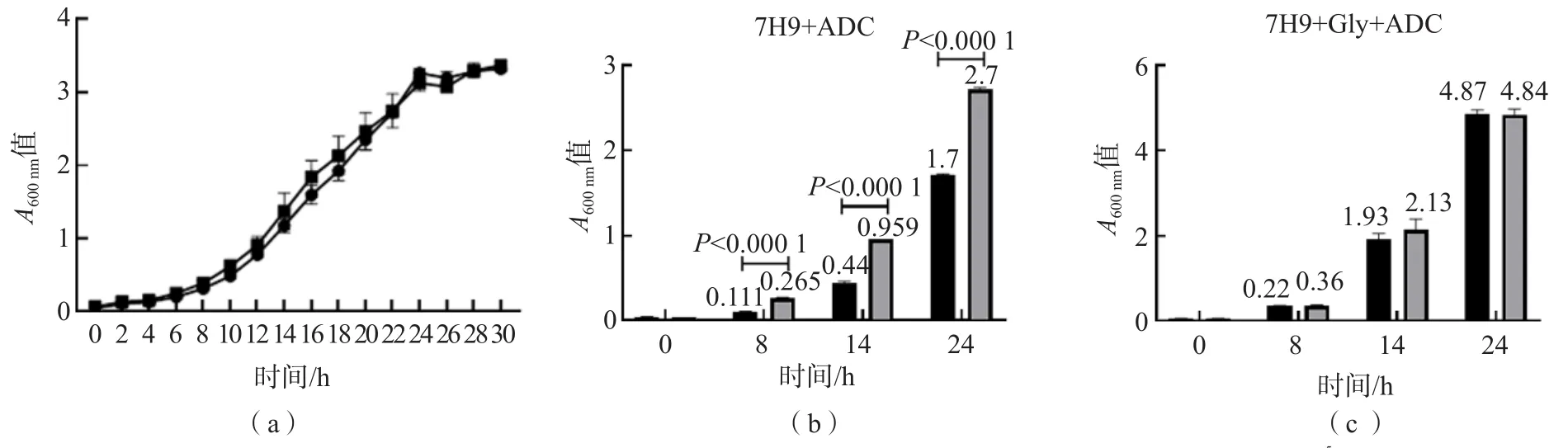
图2 含有不同营养成分的7H9中M.smeg生长情况
2.3 细菌脂类代谢相关基因检测
RT-qPCR结果显示,脂类分解代谢相关基因(fadD21、fadD2、fadD9和fadA5)均显著下调。脂滴形成相关基因MSMEG_2695(MTB编号为Rv2744c)显著下调,分枝菌酸合成上调。见图3。
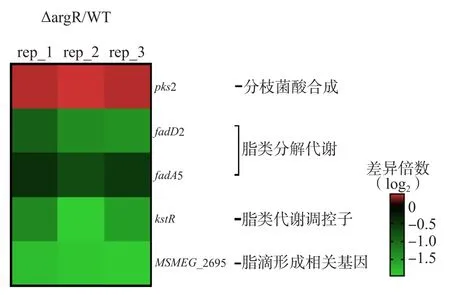
图3 细菌脂类代谢相关基因表达变化
2.4 细菌入胞率及细胞活力
ΔargR入胞率高于WT,ΔargR侵染使得细胞活力显著下降,在2 h时即有显著差异。见图4。
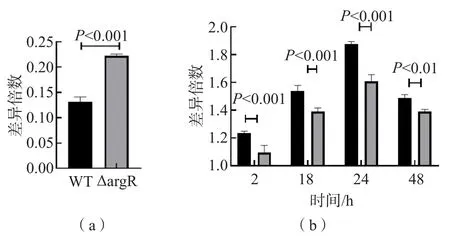
图4 ΔargR入胞率及细胞活力
2.5 细胞线粒体功能相关基因表达变化
RT-qPCR结果显示,细胞线粒体功能相关基因UCP1和DNM1L表达量均显著下调。见图5。
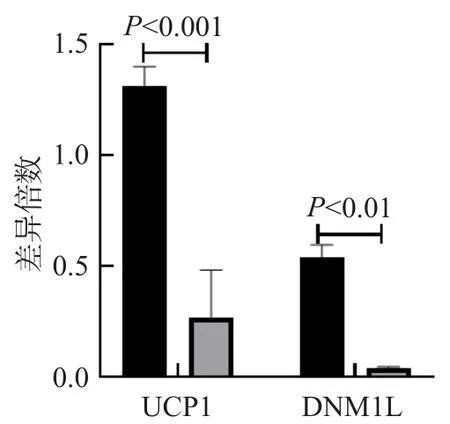
图5 细胞线粒体功能相关基因表达变化
3 讨论
结核病难诊断、难治疗、预后差,耐药结核更是给结核病的防治带来了巨大挑战。结核菌具有随宿主不断进化的独特免疫逃逸机制。精氨酸在病原与宿主生理及代谢中都发挥着关键作用,其对于分枝杆菌毒力及致病性的影响值得关注。
有研究结果显示,MTB的fadD2和fadA5对环境脂质含量的变化十分敏感,在以葡萄糖为主要碳源和以胆固醇与脂肪酸为主要碳源的培养基中生长表达情况变化显著,在富脂环境中因应激表达显著上调,并上调脂肪酸分解代谢[13]。当MTB在以丁酸为唯一碳源的培养基中生长时,fadD9表达上调,以增加对脂肪酸的分解和利用[14],突变株的脂类分解代谢相关基因均显著下调。此外,MSMEG_2695(MTB编号为Rv2744c)敲除可以使M.smeg中脂滴数量增加,且变得大而透亮,MSMEG_2695在突变株中的下调与细菌脂类分解代谢下调和文献[15]结果一致。
线粒体是真核细胞维持生命活动和代谢调控的重要细胞器,能够为绝大多数细胞信号通路提供能量[16]。同时,线粒体是高度动态变化的细胞器,可以不断地重塑其结构,特别是其形成分布在很大程度上是通过线粒体分裂、融合、运动和系结等保守活动来维持的[17],这一过程受到多个通路的调控,极易受到外在环境的影响。有研究发现,线粒体是控制多种疾病进程的关键因子,已经成为一些细菌和病毒病原体控制宿主代谢以达到在感染过程中生存、复制和播散的靶标[18]。因此,基于CCK8检测细胞活力的原理,本研究选择线粒体功能相关基因进行转录水平定量分析,定量结果显示,线粒体脂肪酸代谢下调,分裂受到抑制。提示线粒体功能受损是ΔargR导致的细胞活力下调的原因之一,但具体机制还有待进一步探索。
综上所述,分枝杆菌argR的敲除使得细菌精氨酸合成代谢上调,细菌脂质储存能力提高有利于细菌在营养相对不足的环境中长期生存,特别是作为胞内菌,这种能力可能有利于分枝杆菌应对宿主细胞内的营养限制压力;此外,细菌侵染上皮细胞A549的能力提高,分枝菌酸合成上调,而分枝菌酸是分枝杆菌细胞壁的一个重要毒力因子,提示其毒力可能增强,更有利于细菌对宿主细胞的侵染;本研究进一步分析了宿主细胞侵染后的生理现象,发现ΔargR菌株可以干扰宿主细胞线粒体功能,抑制其脂类代谢活性及线粒体分裂过程,是细胞活力下降的原因之一。
精氨酸代谢变化不仅对分枝杆菌的生理及代谢产生重要影响,还进一步影响宿主细胞的生命活动,尤其包含了对细胞线粒体功能的干扰,结合线粒体的关键作用,本研究从病原菌和宿主细胞角度揭示了分枝杆菌精氨酸代谢对细菌毒力的重要影响,对探究感染过程中宿主与病原相互作用关系、寻找药物靶点有积极意义。
