生殖细胞条件性敲除Usp16 基因小鼠的建立、鉴定及表型分析
2022-07-15李卫杰梁冬丽刘永忠王朝霞乔中东徐汪节
李卫杰,梁冬丽,刘永忠,王朝霞,乔中东,徐汪节*
(1. 上海交通大学生命科学技术学院,上海 200240;2. 上海交通大学实验动物中心,上海 200240;3. 上海交通大学医学院仁济医院上海肿瘤研究所癌基因与相关基因国家重点实验室,上海 200240)
精子发生是一个由一系列基因的精细调控完成的复杂过程,其间经历剧烈的形态与功能的变化。 我们前期发现,不育患者精子中的Usp16 表达下调[1],提示Usp16 可能与精子质量有关。
去泛素化酶Usp16 可特异性去除组蛋白H2A的泛素化修饰,调节Hox基因表达[2]、影响胚胎干细胞和造血干细胞分化[3-4]、对DNA 损伤修复起着负调控作用[5]。 Usp16 S552 的磷酸化是细胞正常增殖和细胞周期G2/M 期进程的基础[6-8]。 此外,Usp16 参与Wnt 途径的调节[9]、参与T 细胞介导的自身免疫病的发展[10]、还影响肿瘤的生长[11]。 但是Usp16 在精子发生中相关的功能研究较少。
由于Usp16 全身性敲除导致动物胚胎死亡[3],所以本研究拟通过Cre-loxP 系统[12]构建生殖细胞特异性(Vasa-cre)敲除Usp16 小鼠,并分析其生殖表型来初步探究Usp16 在小鼠生精过程中的功能。
1 材料与方法
1.1 材料
1.1.1 实验动物
3 只野生型雄鼠(WT)、3 只杂合敲除 Usp16 雄鼠(Usp16flox/wt/Vasa-cre+)和3 只纯合敲除Usp16 雄鼠(Usp16flox/flox/Vasa-cre+)为 4 月龄,体重约为28 g,用于表型分析。 5 只野生型雄鼠(WT)、27 只野生型雌鼠(WT) 和 2 只纯合敲除 Usp16 雌鼠(Usp16flox/flox/Vasa-cre+)用于生育实验,3 月龄,体重约为 26 g(雄鼠)和 22 g(雌鼠)。 1 只 Vasa-cre 转基因雄鼠(B6. FVB-Tg(Ddx4-cre)1Dcas/KnwJ)购自赛业模式生物研究中心(太仓)有限公司【SCXK(苏)2018-0003】,6 月龄,约 29 g。 1 只 Usp16flox/flox雌鼠由上海市肿瘤研究所刘永忠课题组【SYXK(沪)2018-0028】赠送,4 周龄,约 15 g。 以上小鼠均为SPF 级,遗传背景均为C57BL/6 N,饲养于上海交通大学实验动物中心【SYXK(沪)2018-0028】,温度为20 ~25℃,湿度为40% ~70%,昼夜各半循环照明,笼具、饲料、垫料和饮水经高压灭菌处理。 繁殖采用雌雄比 1 ∶1 或 2 ∶1 合笼,小鼠出生21 ~ 28 d 后分笼,至8 周龄性成熟。 所有操作均符合上海交通大学实验动物伦理与使用委员会要求(审批号:A2021025)。
1.1.2 主要试剂与仪器
引物合成(上海桑尼生物科技有限公司)、血液/细胞/组织基因组DNA 提取试剂盒(DP304,天根生化科技 (北京) 有限公司)、 2 × Es Taq MasterMix(Dye)(CW0690,北京康为世纪生物科技有 限 公 司 )、 RNAiso plus ( 9109, TaKaRa )、PrimeScriptTMRT Reagent Kit(RR037A,TaKaRa)、FastStart Universal SYBR Green Master ( Rox )(04913850001,Roche)、兔抗小鼠 Usp16 抗体(14055-1-AP,武汉菲恩生物科技有限公司)、β-actin 抗体(ab6276,Abcam)、Alexa Fluor 594 山羊抗兔荧光二抗(A-11012,赛默飞世尔科技公司)、山羊抗小鼠IgG(H+L)-HRP(CW0102S,北京康为世纪生物科技有限公司)、山羊抗兔IgG (H+L)-HRP(CW0103S,北京康为世纪生物科技有限公司)、抗荧光淬灭封片液(含Hoechst 33342)(P0133-5 mL,上海碧云天生物技术有限公司)、ECL 发光试剂(C510043,生工生物工程(上海)股份有限公司)、Diff-Qick 染色液(G1541,北京索莱宝科技有限公司)。
迈朗精子分析仪(南宁松景天伦生物科技有限公司,中国)、电泳仪、PCR 扩增仪、实时荧光定量PCR 仪和凝胶成像仪(Bio-Rad,美国)、荧光显微镜(Zeiss,德国)。
1.2 方法
1.2.1 小鼠的繁殖与筛选鉴定
应用Cre-loxP 基因编辑技术(图1A),将Vasacre 转基因雄鼠与雌鼠Usp16flox/flox杂交,得F1 代雄鼠Usp16flox/wt/Vasa-cre+为杂合敲除组,继续与雌鼠Usp16flox/flox回交得 F2 代雄鼠 Usp16flox/flox/Vasa-cre+为纯合敲除组(图1B)。
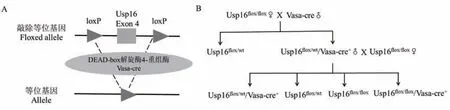
图1 条件性敲除Usp16 小鼠的构建与繁殖Note. A. Cre-loxP knockout principle. B. Reproductive strategy.Figure 1 Construction and reproduction of Usp16 conditional knockout mice
剪取7 日龄左右小鼠脚趾,按照TIANGEN 试剂盒提取DNA,通过PCR 扩增并进行2%琼脂糖凝胶电泳的方法确定小鼠基因型。 PCR 扩增10 μL 体系为 2 × Es Taq MasterMix(Dye)5 μL,ddH2O 4 μL,10 μmol/L 引物各 0.25 μL,模板 DNA 0.5 μL。Vasa-cre 基因扩增条件为 94℃ 30 s,62℃ 30 s,72℃45 s,33 个循环;Usp16-wt 基因扩增条件为 94℃ 30 s,59℃ 30 s,72℃ 45 s,38 个循环;Usp16-loxP 基因扩增条件为 94℃ 30 s,61℃ 30 s,72℃ 60 s,33 个循环。 所使用的引物信息见表1。
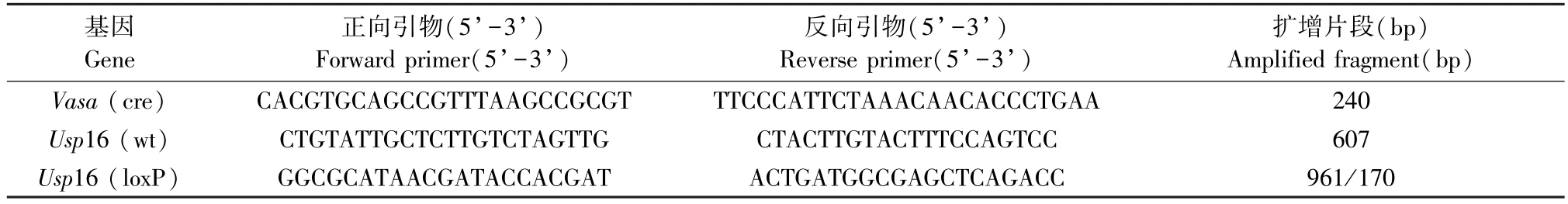
表1 小鼠基因型鉴定引物信息Table 1 Primers for mouse genotyping
1.2.2 小鼠组织总RNA 提取及qPCR
新鲜组织经液氮研磨后,用RNAiso plus 提取组织总RNA,取 1 μg 总 RNA 按反转录试剂盒合成cDNA。 cDNA 为模板,依照 Roche 荧光定量试剂盒说明书,用 Bio-Rad 荧光定量 PCR 仪进行 qPCR。目的基因 Usp16 上游引物:5’-CTGCCAAGACT GTAAGACTGAC-3’, 下 游 引 物: 5’-GGTGTCGTG TAGTGCTTCAAG-3’,内参基因 GAPDH 上游引物:5’-TGGCCTTCCGTGTTCCTAC-3’,下游引物:5’-GAGTTGCTGTTGAAGTCGCA-3 ’。 反 应 体 系:FastStart Universal SYBR Green Master (Rox) 10 μL,ddH2O 6.8 μL,上下游引物各 0.6 μL,cDNA 2 μL。反应条件:95℃ 10 min 预变性,95℃ 10 s,60℃30 s,40 个循环。 用 2-ΔΔCt法分析结果。
1.2.3 Western Blot
用RNAiso plus 提取组织总蛋白后,加入5×蛋白质凝胶电泳上样缓冲液后煮沸10 min,取30 μL上样,恒压60 V 浓缩蛋白,恒压120 V 分离蛋白(8%分离胶),恒流300 mA 湿转90 min,将蛋白转移至PVDF 膜上,5%脱脂奶粉室温封闭1 h,加入一抗(1 ∶2000 稀释)于 4℃ 过夜,TBST 洗膜后加入相应 HRP 偶联二抗(1 ∶20 000 稀释)室温孵育 1 h,TBST 洗膜后ECL 化学发光显色于成像仪成像,结果用软件Image J 进行灰度分析,β-actin 为内参。
1.2.4 HE 染色和免疫荧光
组织于4%多聚甲醛中固定,常规石蜡切片,HE染色,显微镜下拍照。 免疫荧光:切片脱蜡至水,放入预热的柠檬酸钠抗原修复液中微波加热30 min自然冷却后,0.5% Triton X-100 通透 20 min,PBS 洗后5%山羊血清37℃封闭90 min,PBS 洗后一抗(1∶200 稀释)4℃ 孵育过夜,PBS 洗后二抗(1 ∶200稀释)室温孵育1 h,PBS 洗后滴加抗荧光淬灭封片液封片,荧光显微镜下拍照。
1.2.5 精液分析及精子涂片
取小鼠一侧附睾,剪开小口使精液置于精子获能液HTF 中,放入二氧化碳培养箱10 min,稀释100倍后用迈朗精子分析仪分析。 其中取10 μL 精液涂片风干后,Diff-Qick 快速染色,显微镜下拍照。
1.3 统计学分析
独立重复实验3 次,结果用GraphPad Prism 8 软件统计分析,以平均值±标准差()表示,两组间平均值比较采用Student’st检验,多组间平均数比较采用单因素方差分析,P<0.05 为差异具有显著性。
2 结果
2.1 Usp16 在野生型成年雄鼠不同组织中表达情况
qPCR 和 Western Blot 结果显示 Usp16 在成年雄鼠睾丸组织表达量最高,在其他组织中(心、肝、脾、肺、肾和胃)表达量较低(图2)。

图2 Usp16 在野生型成年雄鼠不同组织中的表达情况Note. A. Usp16 mRNA expression level detected by qPCR. B. Usp16 protein expression level detected by Western Blot.Figure 2 Expression of Usp16 in different tissues of wild-type adult male mice
2.2 Usp16 条件性小鼠的建立及验证
Usp16 条件性小鼠是在Usp16 基因第4 个外显子两端插入loxP 位点,PCR 条带大小为961 bp,若被Vasa-cre 重组酶敲除则为170 bp,野生型和Vasacre 阳性条带大小分别为 607 bp 和 240 bp,Usp16flox/wt小鼠可见 607 bp 和 961 bp 条带,Usp16flox/flox小鼠只可见961 bp,杂合子 Usp16flox/wt/Vasa-cre+小鼠可见 961、607 和 240 bp 条带,纯合子Usp16flox/flox/Vasa-cre+小鼠可见 961、170 和 240 bp条带(图3)。

图3 小鼠脚趾DNA 经PCR 扩增后电泳条带Note. 1. Wild type. 2. Vasa-cre. 3. Usp16flox/wt. 4. Usp16flox/flox. 5.Usp16flox/wt/Vasa-cre+. 6. Usp16flox/flox/Vasa-cre+.Figure 3 Electrophoresis band of PCR amplification of mouse toe DNA
Usp16flox/wt/Vasa-cre+雄鼠与Usp16flox/flox雌鼠杂交共产仔 80 只(雄鼠 43 只,雌鼠 37 只)。 其中Usp16flox/wt基因型小鼠 26 只,Usp16flox/flox基因型小鼠21 只,Usp16flox/wt/Vasa-cre+基因型小鼠 27 只,Usp16flox/flox/Vasa-cre+基因型小鼠 6 只(雌鼠 3 只,雄鼠 3 只)。
qPCR 结果显示:相较于野生型,杂合敲除组和纯合敲除组雄鼠睾丸中Usp16 mRNA 表达显著降低,分别降低了约83%和99%(Mean 0.17 SD 0.01 vs Mean 1.03 SD 0.03,P< 0.0001;Mean 0.01 SD 0.01 vs Mean 1.03 SD 0.03,P< 0.0001)(图 4A)。Western Blot 结果显示相较于野生型,杂合敲除组和纯合敲除组雄鼠睾丸中Usp16 蛋白表达显著降低,分别降低了约22%和43%(Mean 0.58 SD 0.10 vs Mean 0.75 SD 0.03,P= 0.0445;Mean 0.43 SD 0.05 vs Mean 0.75 SD 0.03,P= 0.0007)(图 4B)。免疫荧光结果显示Usp16 高表达于圆形精子,在体细胞中弱表达,纯合敲除组雄鼠睾丸中Usp16 阳性圆形精子明显少于野生型(图4C)。 这些结果从基因和蛋白水平证明生殖细胞特异性敲除Usp16 小鼠建立成功。
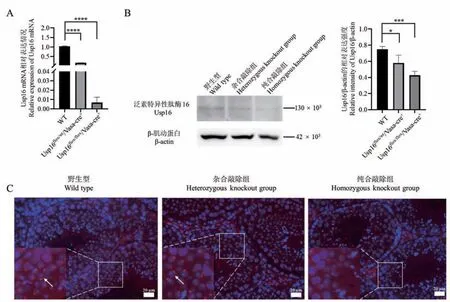
图4 条件性敲除Usp16 小鼠验证Note. A. The expression of Usp16 mRNA levels in the testis of the wild type, heterozygous knockout and homozygous knockout group detected by qPCR. Compared with the wild type,****P < 0.0001. B. The expression of Usp16 protein levels in the testis of the wild type, heterozygous knockout and homozygous knockout group detected by Western Blot. Compared with the wild type,*P < 0.05,***P < 0.001. C. Immunofluorescence detection of Usp16 in the testis. Red fluorescence represents Usp16 and blue fluorescence represents cell nucleus. Arrow. Positive germ cells.Figure 4 Verification of Usp16 conditional knockout mice
2.3 Usp16 条件性敲除小鼠表型分析
2.3.1 Usp16 敲除对睾丸组织形态的影响
野生型、杂合敲除组和纯合敲除组的睾丸中曲细精管排列紧密,结构完整,直径大小没有明显变化,管腔空腔化明显,管壁至管腔的各类生精细胞层次分明,但纯合敲除组睾丸中部分管腔中含有少量圆形精子相融形成的多核细胞(见图5)。

图5 睾丸HE 染色Note. Arrow. Multinucleated cell.Figure 5 HE staining of the testis
2.3.2 Usp16 敲除对附睾组织形态的影响
相较于野生型,纯合敲除组附睾中精子密度减小,且附睾中早熟精子数显著增加了约3 倍(Mean 5.77 SD 1.68 vs Mean 1.40 SD 0.36,P= 0.0117),而杂合敲除组无明显差异(图6)。
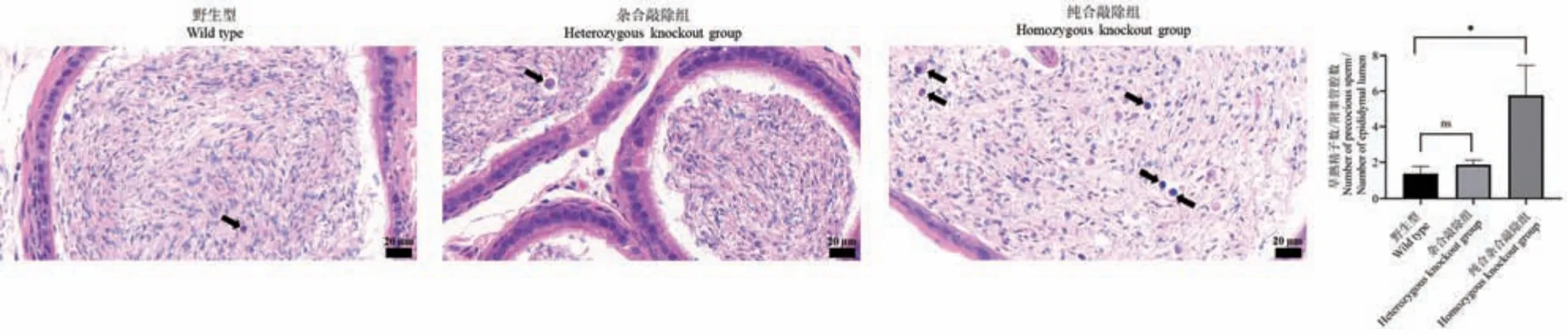
图6 附睾HE 染色Note. Solid arrow. Precocious sperm. Compared with the wild type,nsP > 0.05,*P < 0.05.Figure 6 HE staining of the epididymis
2.3.3 Usp16 敲除对精子质量及出生率的影响
野生型和杂合敲除组雄鼠生育能力正常,纯合敲除雌鼠也能正常生育产仔。 而纯合敲除组雄鼠仅与其交配的15 只雌鼠中的1 只成功生育鼠仔,受孕率约7%(表2)。

表2 生育能力测试Table 2 Fertility test
纯合敲除组雄鼠的精子数量、活率和活力相较于野生型显著下降,分别下降了约79%、81%和87%,精子运动速度(VSL、VCL、VAP)与精子空间位移程度(ALH、BCF、MAD)也显著降低,分别降低了约80%、80%、80%、80%、78%和 78%,而杂合敲除组精子各参数没有显著差异(表3)。
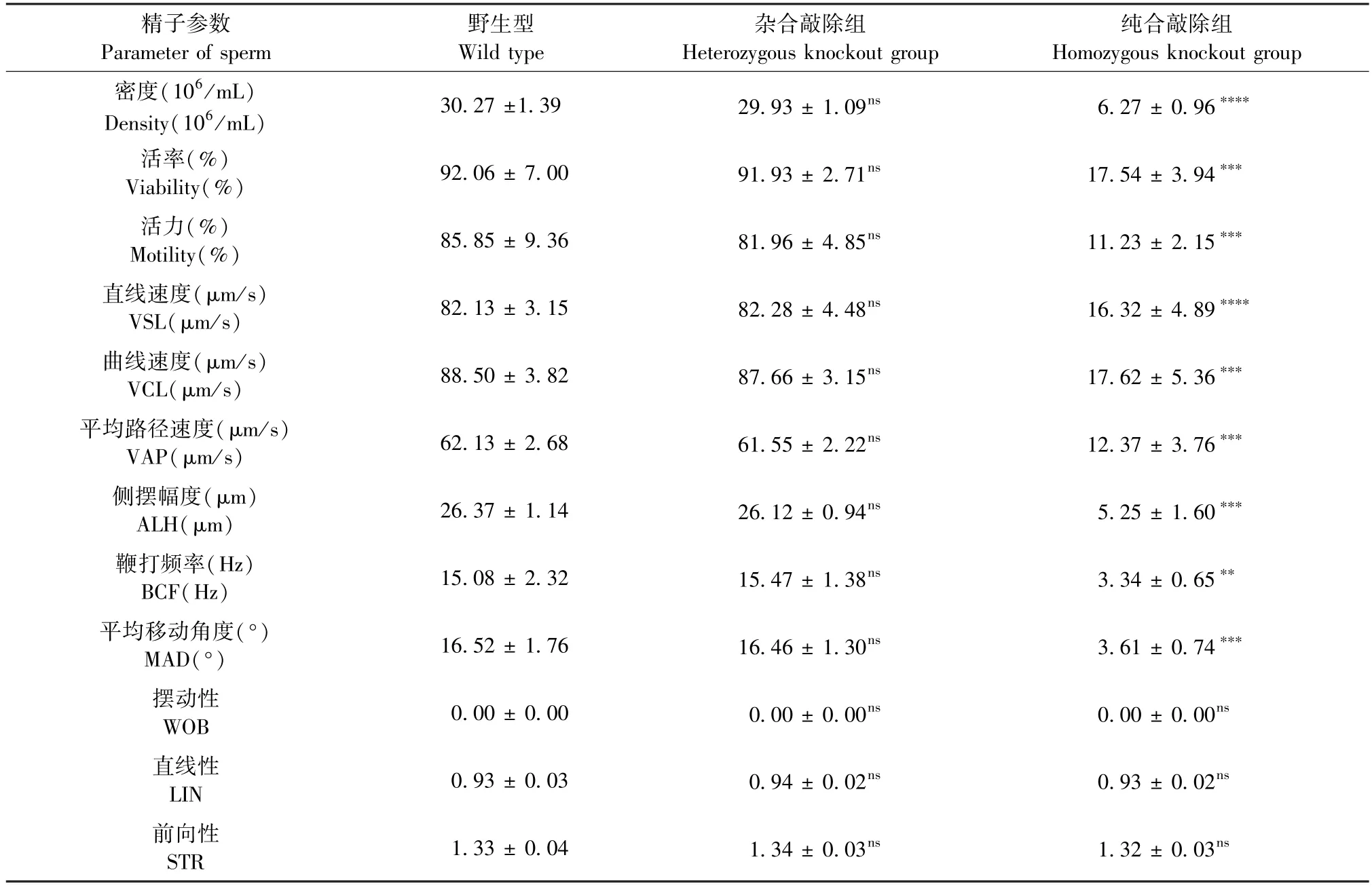
表3 计算机辅助精子分析Table 3 Computer-aided sperm analysis
野生型和杂合敲除组中有一些精子的头部、颈部和尾部会发生畸形,而纯合敲除组相较于野生型精子畸形率显著增加了约4 倍,高达约83%(Mean 83.33 SD 6.11 vs Mean 18.33 SD 5.51,P=0.0002)。 畸形类型有精子头部无钩状不定型畸形,尾部和颈部出现卷曲或弯曲(图7)。

图7 精子涂片染色Note. Solid arrow. Curved neck and tail. Hollow arrow. Abnormal head. Compared with the wild type,nsP > 0.05,****P < 0.0001.Figure 7 Staining of sperm smear
3 讨论
本研究通过Vasa-cre 转基因小鼠与Usp16 条件性小鼠(Usp16flox/flox)杂交成功获得生殖细胞特异性敲除Usp16 小鼠,并从基因和蛋白水平得到证实。Vasa 蛋白从12.5 dpc 开始表达持续至减数分裂后的精子细胞,通过与Vasa-cre 小鼠杂交,雄鼠睾丸中生殖细胞中的Usp16 被定向敲除,而除了睾丸中生殖细胞外,Usp16 在支持细胞和间质细胞中也有表达,故敲除后Western Blot 中仍能看到条带,在免疫荧光中也有荧光表达。
精子发生是一个复杂而有序的过程,从精原细胞分化、精母细胞减数分裂至精子成熟,任何一个环节出现问题都有可能造成生殖缺陷。 杂合敲除组相对于野生型,Usp16 表达量也显著降低,但生殖细胞中还存在Usp16,可能降低的Usp16 表达量不足以影响精子发生,故其精子质量和数量与野生型相比没有明显差异。 纯合敲除雄鼠(Usp16flox/flox/Vasa-cre+)附睾中精子浓度明显减少,曲细精管管腔中出现更多的早熟精子被释放入附睾中,可能是由于精子释放过程异常[13],使得精细胞未能完成重塑形成成熟精子而被释放入附睾中。 而纯合敲除雄鼠睾丸中出现的少量多核细胞可能是由于圆形精子相融来抵抗细胞凋亡[14]。 此外,精子变态形成过程包含顶体发生、鞭毛形成和多余胞质脱落,其中生殖细胞染色质重塑[15]和组蛋白与鱼精蛋白的交换[16]对精子形成至关重要,此过程的异常往往导致精子畸形,精子质量下降。 例如,E3 泛素连接酶RNF8 的缺失[17]或是Miwi 的杂合突变[18]都导致组蛋白上泛素化修饰的缺失,使得组蛋白和鱼精蛋白无法完全交换造成精子少弱畸形症,而纯合敲除Usp16 雄鼠的生殖表型与其类似。 去泛素化酶Usp16 可特异性去除组蛋白H2A 泛素化修饰,且它在圆形精子细胞中表达上调[19],推测其可能参与圆形精子至精子成熟的变态过程,其是否在此过程中调节组蛋白的泛素化修饰使得组蛋白和鱼精蛋白交换异常,从而造成精子畸形、精子活力低和精子数量少等,还需进一步研究。 此外,纯合敲除雌鼠能正常生育产仔,推测Usp16 对其卵子形成没有明显影响。
综上所述,本文从基因和蛋白层面证实了成功构建了生殖细胞特异性敲除Usp16 小鼠。 通过对其生殖表型进行分析,发现纯合敲除雄鼠精子数量和活力严重下降,大量精子形态出现异常,这些表型提示,去泛素化酶Usp16 可调节精子生成过程来影响精子质量和数量,最终对雄性生殖能力产生作用,具体作用机制还需进一步研究。
