中华眼镜蛇毒对大鼠凝血功能的影响
2022-07-15许林魏颖徐书静张启云郭静周舒婷孙黔云
许林,魏颖,徐书静,张启云,郭静,3,周舒婷,孙黔云*
(1. 贵州医科大学药学院,贵阳 550025;2. 贵州省中国科学院天然产物化学重点实验室,贵阳 550014;3. 山西大学中医药现代研究中心,太原 030006)
蛇伤是危害劳动者生命健康的全球公共卫生问题,根据世界卫生组织报道,每年毒蛇咬伤多达270 万人,其中眼镜蛇伤较为普遍[1]。 在我国,眼镜蛇伤的发病率居蛇伤的第二位(16.68%),病死率为1.6%,其临床表现主要有局部水肿,坏死,麻痹,运动障碍等[2-3]。 临床眼镜蛇伤患者中有的表现出凝血功能的异常[4],而有的患者没有表现出凝血功能的异常[5],由于临床蛇伤的复杂性,对于凝血功能的异常是否是眼镜蛇伤的必然结果并没有明确的结论,迄今关于眼镜蛇毒对凝血功能的影响研究较少,且早期研究大多采用血浆测定凝血4 项[6-7],测定过程无血细胞参与,无法完全反映凝血变化过程,因此有必要进一步开展眼镜蛇毒对凝血功能的影响研究。 本研究基于全血凝血功能测定的方法,进行眼镜蛇毒对大鼠凝血功能的影响,以期为临床救治及相关新药研究提供科学参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
80 只 6 周龄 SPF 级雄性 SD 大鼠,体重 180 ~200 g,购于北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。 SPF 级饲料购于北京华阜康生物科技股份有限公司【京饲证(2019)06076】,饲养环境:相对湿度40% ~70%,温度控制在22 ~25℃,饲养期间各组大鼠自由饮水,饲养于贵州医科大学天然产物化学重点实验室【SYXK(黔)2018-0001】。 实验动物方案经贵州医科大学实验动物伦理委员会审查通过(审批号:No.2101082),动物福利均符合相关实验动物管理条例。
1.1.2 主要试剂与仪器
中华眼镜蛇毒(Naja atravenom)冻干粉(贵州省中国科学院天然产物化学重点实验室),蛋白分离介质 SP Sephadex C-25(GE Heathcare 公司,美国),血栓弹力图试剂盒普通杯(北京乐普生物科技有限公司,中国),乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所有限公司,中国),vWF 以及P-selectin 试剂盒(武汉基因美科技有限公司,中国);纤维蛋白原( fibrinogen,FIB)试剂盒(上海太阳生物技术有限公司,中国),纤溶酶底物S2251、凝血因子Ⅹa 底物S2765、凝血酶底物S2238、组织型纤溶酶原激活剂底物S2288、血浆激肽酶底物底物S2302(上海船夫生物技术有限公司,中国),其他所用试剂均为国产分析纯,符合实验要求。
CFMS LEPU-8800 血栓弹力图仪(北京乐普生物科技有限公司,中国),Spectra MAX-190 连续波长酶标仪(Molecular Devices 公司,美国),Milli Q 超纯水系统(Millipore 公司,美国),5810R 冷冻离心机(Eppendorf 公司,德国)。
1.2 方法
1.2.1 眼镜蛇毒及其分离峰制备
称取0.1 g 眼镜蛇蛇毒冻干粉溶于1 mL PBS缓冲液,3000 rpm 离心10 min,取上清分装冻存。
经SP Sephadex C-25 柱分离眼镜蛇毒,参照文献[8]收集样品,编号为FⅠ~ FⅦ。 测定OD 值后换算成蛋白含量,再使用含0.15 mol/L NaCl 的醋酸钠缓冲液稀释成所需要的浓度后分装冻存。
1.2.2 动物样本采集
(1)体外实验:10 只SPF 级雄性SD 大鼠适应性喂养3 d 后禁食12 h,腹腔注射10 mg/mL 戊巴比妥钠麻醉,经腹主动脉取血,枸橼酸钠抗凝管中混匀,每两只混合后共制备60 mL 全血,一共5 批全血供实验使用。 取眼镜蛇蛇毒、FⅠ~FⅦ分离峰不同浓度50 μL 加入至1 mL 大鼠全血中,以 PBS 为对照,混匀,37℃孵育 30 min,取 340 μL 血样测定血栓弹力图,其余血样3000 rpm 离心10 min,取上清分装冻存。
实验设置眼镜蛇蛇毒高、中、低剂量组为125、12.5、1.25 μg/mL;FⅠ ~ FⅦ为 25 μg/mL;FI 高、中、低剂量组为 25、2.5、0.8 μg/mL;FⅥ高、中、低剂量组为 50、25、12.5 μg/mL。 上述浓度均为终浓度。
(2)体内实验:70 只SD 大鼠适应性喂养3 d,随机分为肌肉注射组、尾静脉注射组和PBS 对照组,每组6 ~9 只不等,分别将眼镜蛇毒0.5 mg/kg一次性尾静脉注射和1 mg/kg 一次性肌肉注射至大鼠体内,于注射后 0.5、1、2、6 h 取血,将血样混匀后取340 μL 血样进行血栓弹力图测定,其余血样3000 rpm 离心10 min,取上清分装冻存。
1.2.3 血栓弹力图(TEG)测定
血栓弹力图普通杯测试试剂盒恢复至室温,血栓弹力图仪升温至37℃,取全血血样1 mL 与试剂1混合,颠倒 4 ~ 5 次后静置 4 min,取 340 μL 血样加入普通杯杯槽中,加入20 μL 试剂2,测定血栓弹力图。
1.2.4 LDH 活性测定
取体内或体外制备的大鼠血浆按照酶活测定方法测定LDH 活性。
按式(1)计算LDH 活性(U/L):

1.2.5 血浆血红蛋白含量测定
取体内或体外制备的血浆用PBS 稀释10 倍后取200 μL 加入96 孔板,于412 nm 处测定吸光度,以A412nm值表示血红蛋白含量。
1.2.6 酶切发色底物活性测定
参照文献[9],取体内或体外制备的血浆采用单一时间点法和酶动力学方法测定酶切纤溶酶底物S2251、凝血因子Ⅹa 底物S2765、凝血酶底物S2238、组织型纤溶酶原激活剂底物S2288、血浆激肽酶底物 S2302 活 性, 以 1 mg/mL 原 矛 头 蝮 蛇 毒(Protobothrops mucrosquamatusvenom,PMV)为阳性对照,PBS 为阴性对照,取血浆 20 μL 或 40 μL、相关底物 40 μL 或 20 μL、PBS 40 μL,总体系为 100 μL,混匀后37℃恒温避光孵育,设置孵育时间4 或6 h、间隔检测时间15 或30 min 测定A405nm。
1.2.7 FIB、P-selectin、vWF 含量
取制备的血浆采用 ELISA 法测定 P-selectin、vWF 含量,采用凝固法测定FIB 含量。
1.3 统计学分析
2 结果
2.1 眼镜蛇毒分离峰的制备
眼镜蛇毒经SP Sephadex C-25 分离后获得7 个主要分离峰(图1)。 命名为FⅠ~FⅦ。

图1 眼镜蛇毒SP-Sephadex C-25 层析图Figure 1 Ion-exchange chromatography of Naja atra venom on a SP-Sephadex C-25 column
2.2 体外实验结果
2.2.1 血栓弹力图结果
表1 显示,与空白组相比,FⅠ、FⅥ、FⅦ分离峰能显著延长R 值(P<0.05),提示凝血因子性低凝。 FⅣ、FⅤ、FⅥ分离峰显著减小 Angle 值(P<0.05),表明纤维蛋白原功能性低凝。 FⅢ、FⅣ、FⅤ、FⅥ、FⅦ分离峰 CI 值显著减小(P< 0.05),提示血液处于低凝状态。
表1 FⅠ~FⅦ血栓弹力图测定结果(, n = 3)Table 1 Results of TEG of FⅠ~FⅦ(, n = 3)
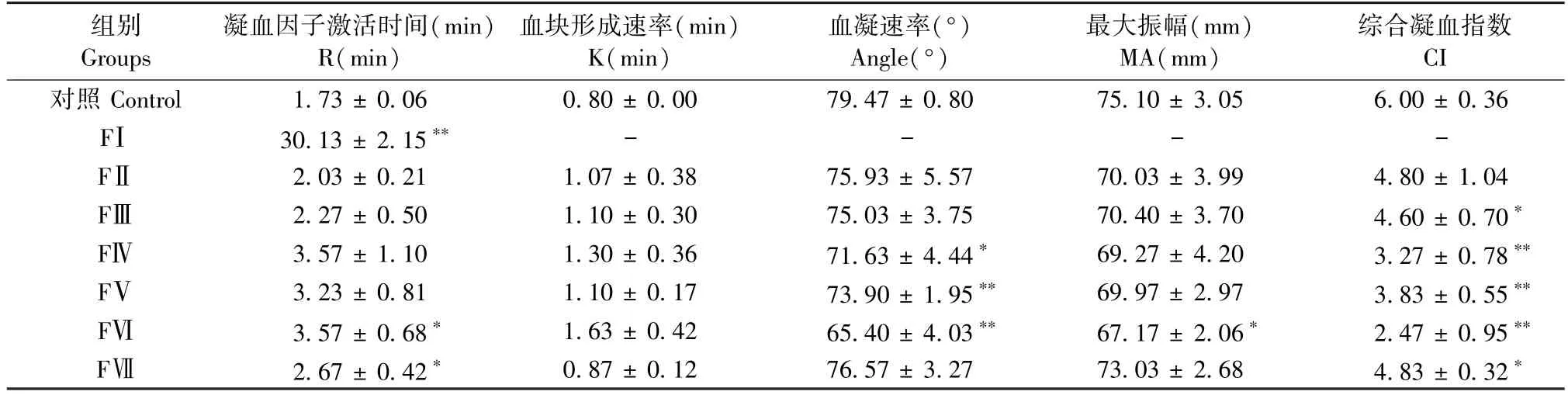
表1 FⅠ~FⅦ血栓弹力图测定结果(, n = 3)Table 1 Results of TEG of FⅠ~FⅦ(, n = 3)
注:与空白组相比,*P < 0.05,**P < 0.01。 (下表同)Note. Compared with control group,*P < 0.05,**P < 0.01. (The same in the following tables)
组别Groups凝血因子激活时间(min)R(min)血块形成速率(min)K(min)血凝速率(°)Angle(°)最大振幅(mm)MA(mm)综合凝血指数CI对照 Control 1.73 ± 0.06 0.80 ± 0.00 79.47 ± 0.80 75.10 ± 3.05 6.00 ± 0.36 FⅠ 30.13 ± 2.15** - - - -FⅡ 2.03 ± 0.21 1.07 ± 0.38 75.93 ± 5.57 70.03 ± 3.99 4.80 ± 1.04 FⅢ 2.27 ± 0.50 1.10 ± 0.30 75.03 ± 3.75 70.40 ± 3.70 4.60 ± 0.70*FⅣ 3.57 ± 1.10 1.30 ± 0.36 71.63 ± 4.44* 69.27 ± 4.20 3.27 ± 0.78**FⅤ 3.23 ± 0.81 1.10 ± 0.17 73.90 ± 1.95** 69.97 ± 2.97 3.83 ± 0.55**FⅥ 3.57 ± 0.68* 1.63 ± 0.42 65.40 ± 4.03** 67.17 ± 2.06* 2.47 ± 0.95**FⅦ 2.67 ± 0.42* 0.87 ± 0.12 76.57 ± 3.27 73.03 ± 2.68 4.83 ± 0.32*
表2 可知,与空白组相比 FⅠ(25、2.5 μg/mL)及 FⅥ(50 μg/mL)均延长 R 值(P< 0.01)。 除 FⅠ(25 μg/mL),FⅠ、FⅥ其余各浓度均增大 K 值(P<0.05),减小 Angle 值(P< 0.05),提示纤维蛋白原功能性低凝。 FⅥ(50、25 μg/mL)减小 MA(P<0.05),提示血小板性低凝。 FⅠ、FⅥ各浓度均降低CI 值(P< 0.05)。
表2 FⅠ和FⅥ血栓弹力图测定结果(, n = 3)Table 2 Results of TEG of FⅠand FⅥ(, n = 3)

表2 FⅠ和FⅥ血栓弹力图测定结果(, n = 3)Table 2 Results of TEG of FⅠand FⅥ(, n = 3)
组别Groups凝血因子激活时间(min)R(min)血块形成速率(min)K(min)血凝速率(°)Angle(°)最大振幅(mm)MA(mm)综合凝血指数CI对照 Control 1.73 ± 0.06 0.80 ± 0.00 79.47 ± 0.8 75.10 ± 3.05 6.00 ± 0.36 FⅠ25.0 30.13 ± 2.15** - - - -2.5 2.80 ± 0.26** 1.73 ± 0.21* 66.67 ± 2.74** 64.77 ± 6.38 2.70 ± 0.95**0.8 3.20 ± 0.95 1.43 ± 0.21* 70.43 ± 2.19** 68.77 ± 2.11* 3.33 ± 0.50**FⅥ50.0 3.07 ± 0.15** 1.70 ± 0.10** 66.67 ± 2.20** 60.43 ± 6.16* 2.03 ± 0.91**25.0 3.07 ± 0.64 1.37 ± 0.12* 68.60 ± 3.39** 67.10 ± 2.17* 3.10 ± 0.26**12.5 2.27 ± 0.32 1.37 ± 0.15* 70.90 ± 1.08** 67.53 ± 8.51 3.83 ± 0.92*
表3 显示,眼镜蛇毒(125、12.5 μg /mL)延长 R值(P< 0.01)。 3 个浓度均降低 Angle 值(P<0.01),降低 CI 值(P< 0.01),且浓度越大,CI 值越小。
表3 眼镜蛇毒不同浓度血栓弹力图测定结果(, n = 3)Table 3 Results of TEG with different concentrations of Naja atra venom(, n = 3)
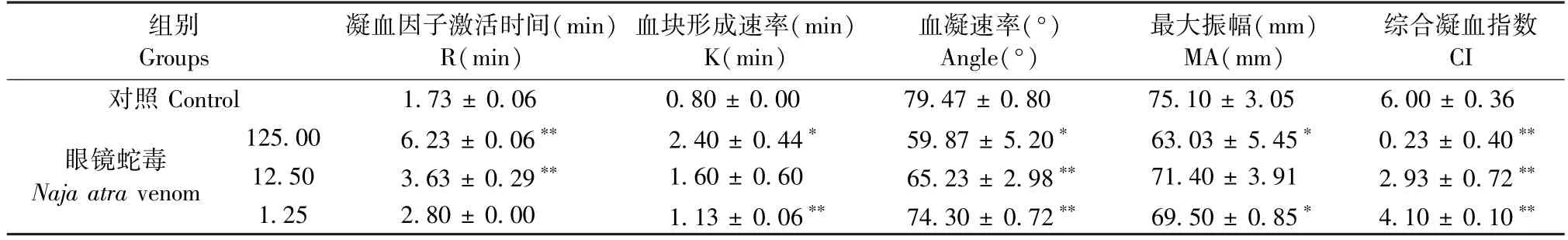
表3 眼镜蛇毒不同浓度血栓弹力图测定结果(, n = 3)Table 3 Results of TEG with different concentrations of Naja atra venom(, n = 3)
组别Groups凝血因子激活时间(min)R(min)血块形成速率(min)K(min)血凝速率(°)Angle(°)最大振幅(mm)MA(mm)综合凝血指数CI对照 Control 1.73 ± 0.06 0.80 ± 0.00 79.47 ± 0.80 75.10 ± 3.05 6.00 ± 0.36眼镜蛇毒Naja atra venom 125.00 6.23 ± 0.06** 2.40 ± 0.44* 59.87 ± 5.20* 63.03 ± 5.45* 0.23 ± 0.40**12.50 3.63 ± 0.29** 1.60 ± 0.60 65.23 ± 2.98** 71.40 ± 3.91 2.93 ± 0.72**1.25 2.80 ± 0.00 1.13 ± 0.06** 74.30 ± 0.72** 69.50 ± 0.85* 4.10 ± 0.10**
图2 可知眼镜蛇毒 12.5 μg/mL、FⅠ 2.5 μg/mL、FⅥ25 μg/mL 浓度下血栓弹力图与对照组相比均产生明显变化。
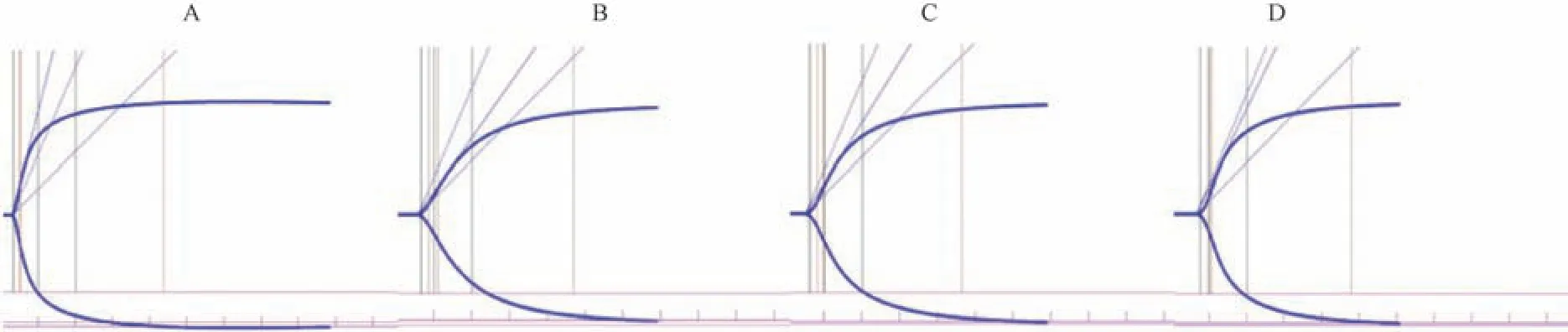
图2 体外孵育后大鼠全血血栓弹力图变化Note. A. Control. B. Naja atra venom 12.5 μg/mL. C. FⅠ 2.5 μg/mL. D. FⅥ 25 μg/mL.Figure 2 Changes of whole blood TEG in rats after in vitro incubation
2.2.2 LDH 结果
图3 显示,与空白组相比,眼镜蛇蛇毒(125、12.5 μg/mL)、FⅠ (25、2.5 μg/mL)、FⅣ及 FⅦ分离峰孵育后血浆显著增高LDH 活力(P<0.05)。
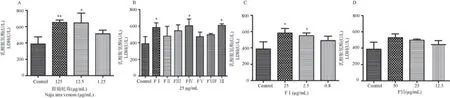
图3 体外孵育后大鼠血液中LDH 变化(, n = 3)Note. A. Naja atra venom in different concentrations. B. FⅠ~FⅦ. C. FⅠ in different concentrations. D. FⅥ in different concentrations.Compared with control,*P < 0.05,**P < 0.01. (The same in the following figures).Figure 3 Changes of LDH in the blood of rats after in vitro incubation(, n = 3)
2.2.3 血红蛋白含量
图4 可知眼镜蛇蛇毒(125、12.5、1.25 μg/mL)、FⅠ(25、2.5、0.8 μg/mL)、FⅡ、FⅣ、FⅥ(50、25、12.5 μg/mL)及FⅦ分离峰血红蛋白含量显著升高(P< 0.05)。

图4 体外孵育后大鼠血液中血红蛋白含量变化Note. A. Naja atra venom in different concentrations. B. FⅠ~FⅦ. C. FⅠ in different concentrations. F. FⅥ in different concentrations.Figure 4 Changes of hemoglobin content in rat blood after in vitro incubation
2.2.4 酶切发色底物活性测定结果
由图 5A、5B、5C、5D 可知与空白组相比眼镜蛇毒(125、12.5、1.25 μg/mL)及 FⅥ分离峰(50、25 μg/mL)均下调酶切凝血酶 S2238 底物活力(P<0.05)。
由图5E、5F 可知空白组相比眼镜蛇毒(125、12.5、1.25 μg/mL)酶切纤溶酶 S2251 底物活性随浓度增加而减小(P< 0.05)。 图 5G、5H、5I、5J、5K、5L 可知 FⅠ、FⅡ、FⅢ、FⅥ(50、25 μg/mL)、FⅦ分离峰酶切纤溶酶底物 S2251 活性均显著上调(P<0.05)。
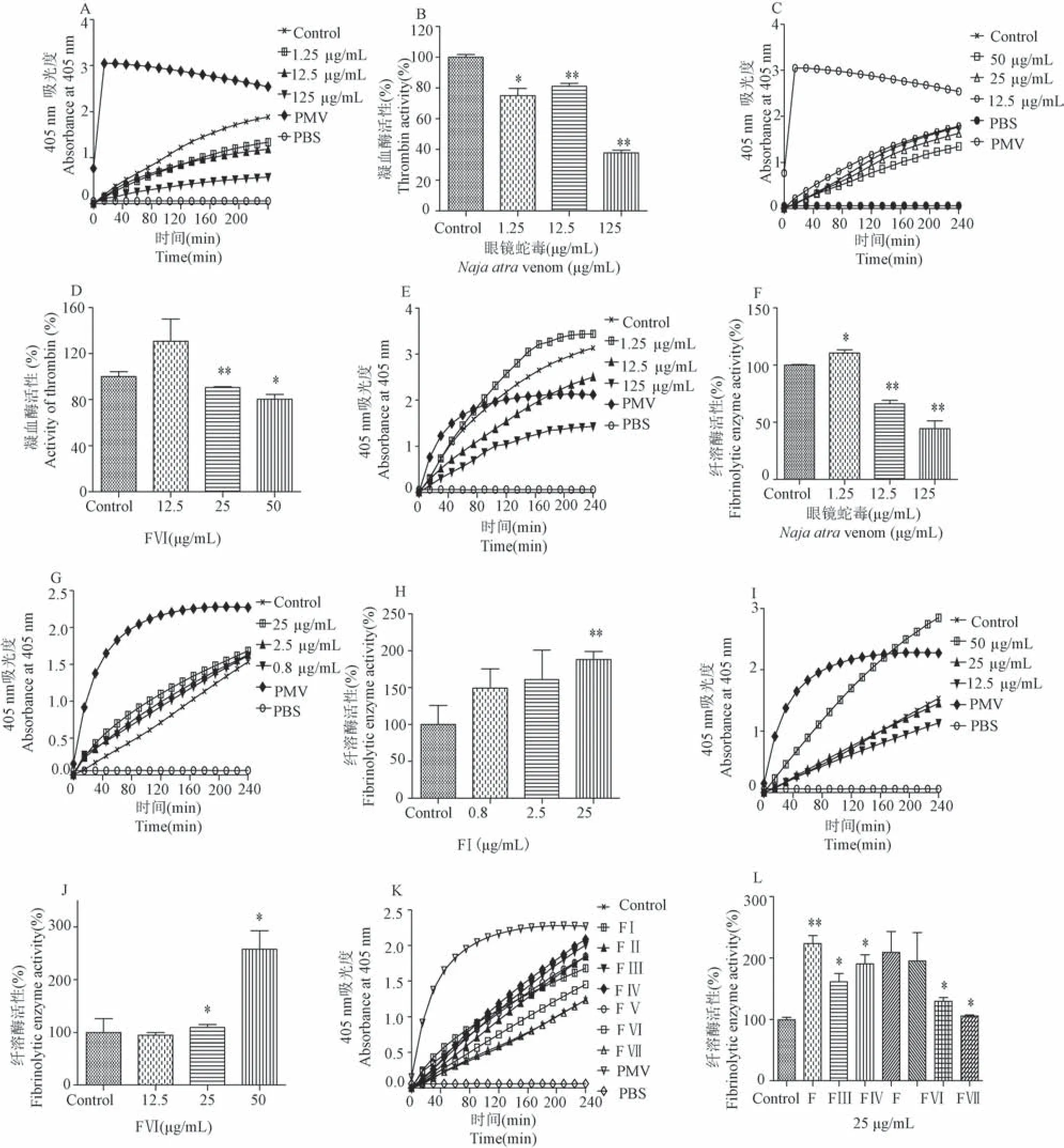
图5 体外孵育后血浆酶切S2238 和S2251 底物酶动力学曲线及酶活力变化(, n = 3)Note. A, B. Changes of enzyme kinetic curves and enzymatic activities of cleaving S2238 of Naja atra venom in different concentrations. C, D.Changes of enzyme kinetic curves and enzymatic activities of cleaving S2238 of FⅥ in different concentrations. E, F. Changes of enzyme kinetic curves and enzymatic activities of cleaving S2251 of Naja atra venom in different concentrations. G, H. Changes of enzyme kinetic curves and enzymatic activities of cleaving S2251 of FⅠ in different concentrations. I, J. Changes of enzyme kinetic curves and enzymatic activities of cleaving S2251 of FⅥ in different concentrations. K, L. Changes of enzyme kinetic curves and enzymatic activities of cleaving S2251 of FⅠ~ FⅦ.Figure 5 Changes of enzyme kinetic curves and enzymatic activities of cleaving S2238 and S2251 in plasma after incubation in vitro(, n = 3)
2.3 体内实验结果
2.3.1 血栓弹力图结果
表4 可知,肌肉注射组 0.5、2、6 h 内 K 值显著增大(P< 0.05),Angle 及 CI 值 6 h 内显著减小(P< 0.01),1 ~ 6 h MA 值显著减小(P< 0.01),且该注射方式6 h 出现一定程度的纤溶亢进,与空白组相比具有显著性差异(P<0.01),提示低凝出血风险增大。 由表5 可知,静脉注射眼镜蛇毒1 h 内K值显著增大(P< 0.05),Angle、MA、CI 显著减小(P<0.01),1 h 达最小值,提示低凝出血风险增大。由图6 可知肌肉注射和尾静脉注射组血栓弹力图与空白组相比均有明显变化。

图6 注射眼镜蛇毒后大鼠血栓弹力图变化Note. A. Intramuscular injection control. B. Intravenous injection 2 h. C. Intramuscular injection control. D. Intravenous injection 1 h.Figure 6 Changes of TEG after injection of Naja atra venom in rats
表4 肌肉注射组不同时间点血栓弹力图测定结果()Table 4 Results of TEG at different time points in intramuscular injection group()
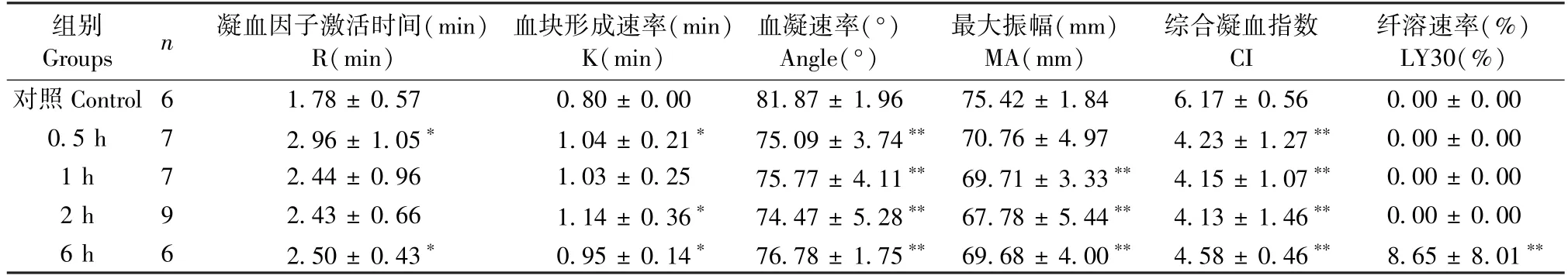
表4 肌肉注射组不同时间点血栓弹力图测定结果()Table 4 Results of TEG at different time points in intramuscular injection group()
Groups n 凝血因子激活时间(min)R(min)组别 血块形成速率(min)K(min)血凝速率(°)Angle(°)最大振幅(mm)MA(mm)综合凝血指数CI纤溶速率(%)LY30(%)对照 Control 6 1.78 ± 0.57 0.80 ± 0.00 81.87 ± 1.96 75.42 ± 1.84 6.17 ± 0.56 0.00 ± 0.00 0.5 h 7 2.96 ± 1.05* 1.04 ± 0.21* 75.09 ± 3.74** 70.76 ± 4.97 4.23 ± 1.27** 0.00 ± 0.00 1 h 7 2.44 ± 0.96 1.03 ± 0.25 75.77 ± 4.11** 69.71 ± 3.33** 4.15 ± 1.07** 0.00 ± 0.00 2 h 9 2.43 ± 0.66 1.14 ± 0.36* 74.47 ± 5.28** 67.78 ± 5.44** 4.13 ± 1.46** 0.00 ± 0.00 6 h 6 2.50 ± 0.43* 0.95 ± 0.14* 76.78 ± 1.75** 69.68 ± 4.00** 4.58 ± 0.46** 8.65 ± 8.01**
表5 尾静脉注射组不同时间点血栓弹力图测定结果()Table 5 Results of TEG at different time points in intravenous injection group()
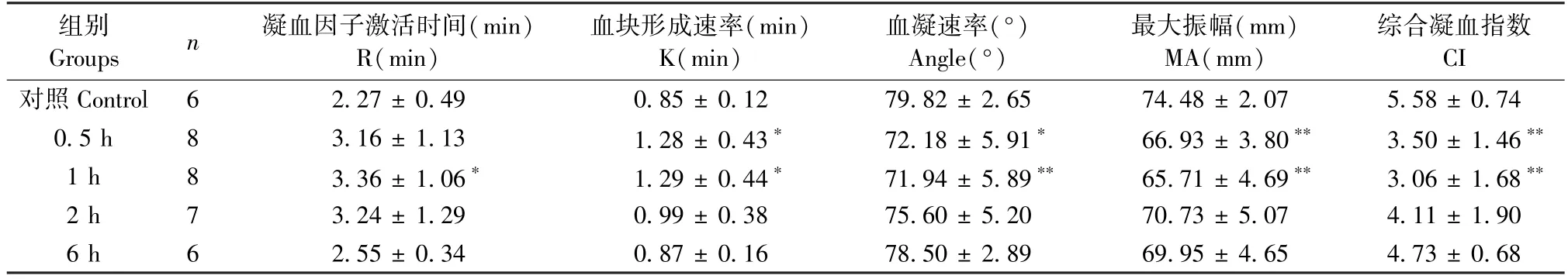
表5 尾静脉注射组不同时间点血栓弹力图测定结果()Table 5 Results of TEG at different time points in intravenous injection group()
Groups n 凝血因子激活时间(min)R(min)组别 血块形成速率(min)K(min)血凝速率(°)Angle(°)最大振幅(mm)MA(mm)综合凝血指数CI对照 Control 6 2.27 ± 0.49 0.85 ± 0.12 79.82 ± 2.65 74.48 ± 2.07 5.58 ± 0.74 0.5 h 8 3.16 ± 1.13 1.28 ± 0.43* 72.18 ± 5.91* 66.93 ± 3.80** 3.50 ± 1.46**1 h 8 3.36 ± 1.06* 1.29 ± 0.44* 71.94 ± 5.89** 65.71 ± 4.69** 3.06 ± 1.68**2 h 7 3.24 ± 1.29 0.99 ± 0.38 75.60 ± 5.20 70.73 ± 5.07 4.11 ± 1.90 6 h 6 2.55 ± 0.34 0.87 ± 0.16 78.50 ± 2.89 69.95 ± 4.65 4.73 ± 0.68
2.3.2 LDH 结果
由图7 可知与空白组对比,两种注射方式6 h内LDH 活力显著增高(P<0.05)。
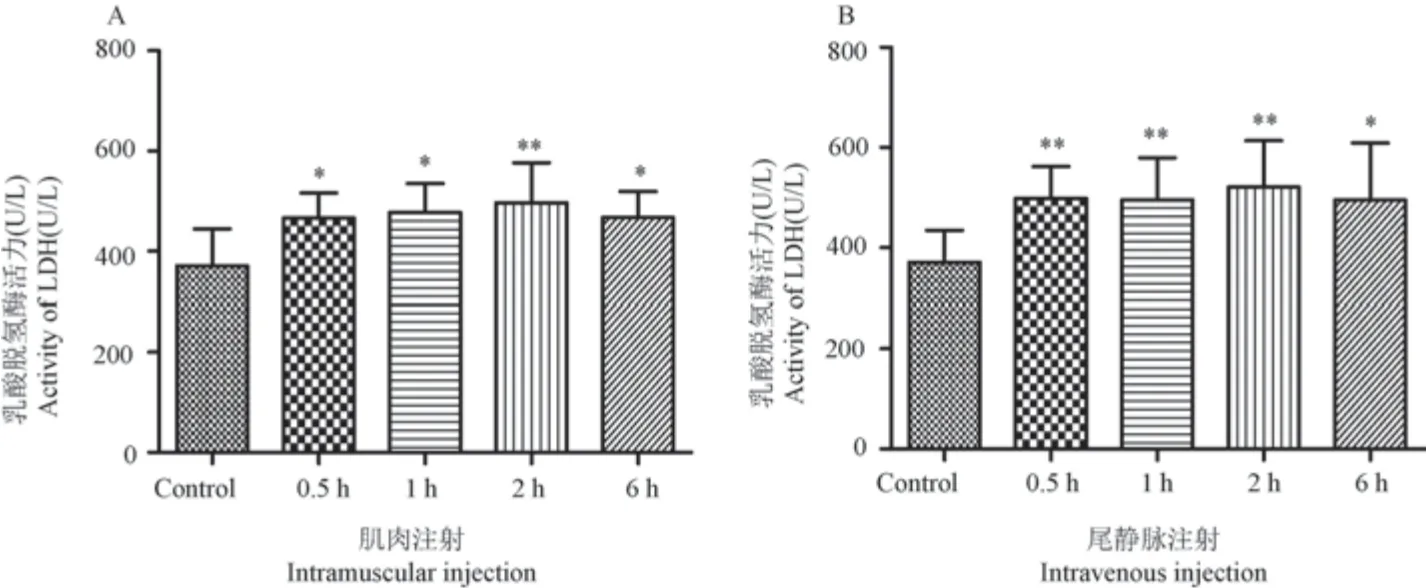
图7 大鼠注射眼镜蛇毒后不同时间点LDH 变化Figure 7 Changes of LDH at different time points after injection of Naja atra venom in rats
2.3.3 血浆血红蛋白含量
由图8 可知,与空白组相比,肌肉注射组1、6 h 时血红蛋白含量显著增高(P<0. 05),静脉注射组2 h 内血红蛋白含量显著增高(P<0. 01)。

图8 大鼠注射眼镜蛇毒后不同时间点血红蛋白含量变化Figure 8 Changes of hemoglobin content at different time points after injection of Naja atra venom in rats
2.3.4 FIB 测定结果
由图9 知尾静脉注射组 FIB 含量在1 h 和6 h时与空白组相比存在显著性差异(P<0.05),肌肉注射组各时间点FIB 含量均有一定降低,但无统计学意义(数据未列出)。
2.3.5 酶切发色底物活性实验结果
由图10A,10B 可知尾静脉注射组在2 h 内酶切凝血酶底物S2238 活性与空白组相比产生显著性差异(P< 0.05)。 由图 10C,10D 可知肌肉注射组 6 h内酶切凝血因子Ⅹa 底物S2765 活性与空白组比较具有显著性差异(P<0.01)。 酶切纤溶酶底物S2251、血浆激肽酶底物S2302 及组织型纤溶酶原激活剂底物S2288 活性与空白组相比无显著性差异(数据未列出)。
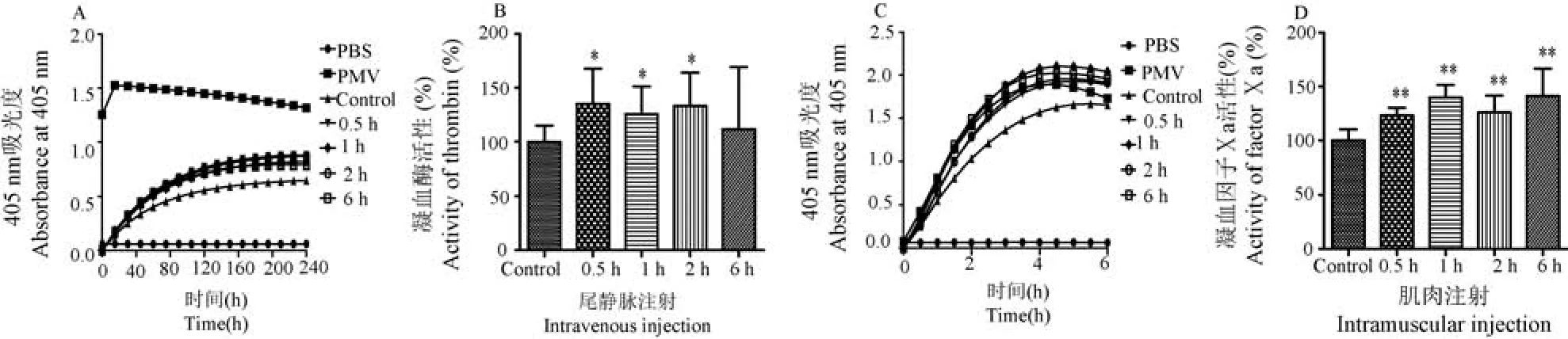
图10 注射眼镜蛇毒后大鼠血浆酶切S2238 和S2765 底物动力学曲线及酶活力变化Note. A,C. Changes of the enzyme kinetics curves of cleaving S2238 and S2765. B,D. Changes of enzymatic activities of cleaving S2238 and S2765.Figure 10 Changes of enzyme kinetics curves and enzymatic activities of cleaving S2238 and S2765 after injection of Naja atra venom in plasma of rats
2.3.6 P-selectin 测定结果
由图11 可知,肌肉注射眼镜蛇毒 0.5 h 时P-selectin 含量显著增高(P< 0.01)。 静脉注射0.5 h时P-selectin 有上调但无统计学意义(数据未列出)。
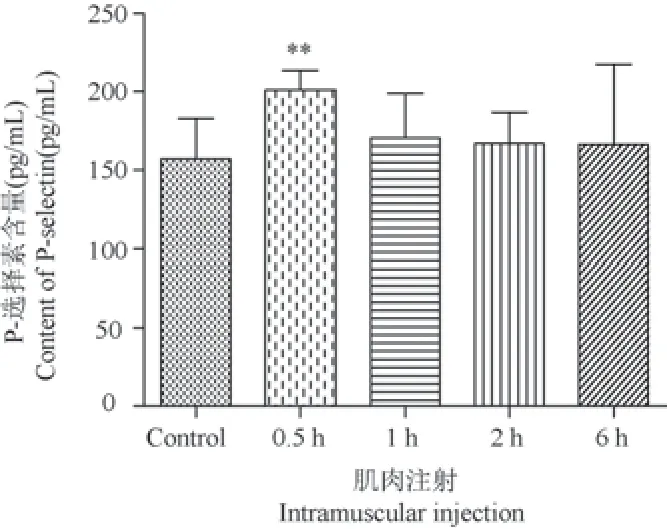
图11 肌肉注射眼镜蛇毒后大鼠血液中P-selectin 变化Figure 11 Changes of P-selectin in rats blood after injection of Naja atra venom
2.3.7 vWF 测定结果
由图12 可见,尾静脉注射眼镜蛇毒后6 h 内vWF 含量显著增高(P< 0.05),1 h 时变化最为明显。 肌肉注射组有一定升高但无统计学意义(数据未列出)。
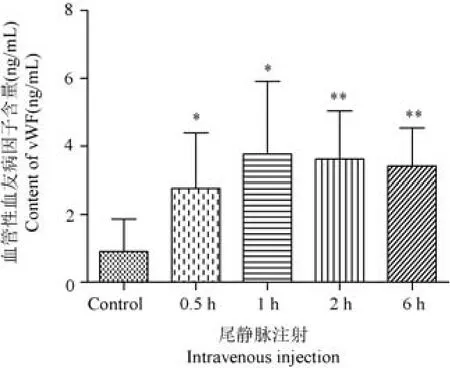
图12 注射眼镜蛇毒后大鼠血液中vWF 变化Figure 12 Changes of vWF in rats blood after injecting Naja atra venom
3 讨论
临床上眼镜蛇伤病人情况复杂,部分眼镜蛇伤病例中凝血功能障碍不明显[10],但少部分急危重症眼镜蛇伤病人伴有凝血功能的异常,主要表现为活化部分凝血活酶时间(APTT)延长、凝血酶原时间(PT)延长、凝血酶时间(TT)延长、纤维蛋白原(FIB)下降[11-12],眼镜蛇伤是否与凝血功能障碍有必然联系,尚未能完全确定。 目前眼镜蛇伤相关研究多聚焦在其神经毒、细胞毒等毒素方面的影响[13-14]。 关于眼镜蛇毒对凝血功能影响的基础研究不多,从 1973 年到 2021 年,在 CNKI、维普网、万方数据、PubMed 数据库上可查询到文献较少,且早期研究多采用血浆测定凝血四项,常规凝血四项主要采用抗凝血浆检测 APTT、PT、TT、FIB,血浆中不含血细胞,只检测血浆本身凝血功能,故不能完全反应凝血变化的病理生理过程。 因此有必要从基础研究的角度进一步认识和阐明眼镜蛇毒对凝血功能的影响情况。 针对凝血四项的不足,血栓弹力图可用全血监测血液凝固动态全过程,能比较好地弥补传统凝血检测中无血细胞参与的不足,更接近临床实际凝血变化。 基于此,本研究利用血栓弹力图研究和评价眼镜蛇毒对大鼠凝血功能的影响,以便进一步认识眼镜蛇伤中凝血功能的影响,为临床救治和新药研究提供科学参考。
研究表明眼镜蛇毒属于混合型毒素,既有血液毒,又有神经毒,其主要功能组分有神经毒素、细胞毒素、金属蛋白酶、眼镜蛇毒因子、氧化酶类、水解酶类等成分[15]。 为进一步认识眼镜蛇毒不同组分对凝血功能的影响,本研究体外实验中采用能较好地将眼镜蛇毒组分分开的SP-Sephadex C-25 凝胶进行分离,得到7 个分离峰,其中FⅠ峰含有磷脂酶A2、L-氨基酸氧化酶、眼镜蛇毒因子、蛇毒金属蛋白酶[16-17],FⅡ中主要含有乙酰胆碱酯酶,FⅢ中主要含有磷酸二酯酶[17],FⅣ、FⅤ峰中富含半胱氨酸蛋白、蛇毒金属蛋白酶及神经生长因子[16],FⅥ中主要含有神经毒素[17],FⅦ中主要含有细胞毒素[17]。 血栓弹力图实验及相关活性结果表明FⅠ峰孵育后全血R 值显著延长,血液未凝固,说明血液凝血功能异常,这可能由于FⅠ峰中磷脂酶A2、L-氨基酸氧化酶、蛇毒金属蛋白酶抑制血小板聚集所引起[18-19],同时血浆中血红蛋白含量显著上升,LDH 活力升高,表明细胞膜完整性遭到破坏,这可能由眼镜蛇毒因子激活补体生成攻膜复合物、磷脂酶A2 酶切卵磷脂产生溶血卵磷脂等引起[20-21]。 FⅣ峰综合凝血指数CI 显著降低,血红蛋白含量升高,提示该峰中的金属蛋白酶可通过抑制血小板等表现出抗凝作用,除此之外可能存在细胞毒素,造成血红蛋白的升高。 FⅤ、FⅥ峰血栓弹力图结果显示凝血因子减少,纤维蛋白原减少,血小板功能减弱,可能是FⅤ峰中某些金属蛋白酶切割直接凝血因子,水解纤维蛋白原,抑制血小板聚集所导致[22]。 此外FⅥ、FⅦ峰孵育后血浆血红蛋白含量升高,说明FⅥ、FⅦ组分含有细胞毒素可破坏细胞,溶解红细胞造成血红蛋白含量升高[17]。 酶切发色底物结果表明,随眼镜蛇毒浓度增大,孵育处理后血浆切割凝血酶底物、纤溶酶底物活性显著下调,这与血栓弹力图中表现出凝血因子减少这一变化保持一致。
体内血栓弹力图实验表明眼镜蛇毒具有显著的抗凝作用,0.5 mg/kg 浓度下尾静脉注射组大鼠及1 mg/kg 浓度下肌肉注射组大鼠均表现出凝血因子、纤维蛋白原减少,血小板功能的减弱,1 h 内尾静脉注射组大鼠抗凝效果略优于肌肉注射组。 大鼠注射眼镜蛇毒后凝血因子的减少可能是凝血系统激活导致凝血因子的消耗。 文献报导大鼠注射眼镜蛇毒后能够延长APTT、PT,该结果也提示凝血因子存在减少或缺乏[6]。 通过测定纤维蛋白原的含量发现,尾静脉注射后大鼠血浆各时间点纤维蛋白原均有一定的下降,这可能是体内凝血系统被激活导致纤维蛋白原消耗也可能是纤维蛋白原被酶切水解所致。 同时体内注射眼镜蛇毒后P-selectin、vWF 含量、血红蛋白含量及LDH 活力均有不同程度的增加。 P-selectin 是内皮细胞和血小板含有的黏附分子,vWF 是内皮细胞含有的分子,二者均可作为血小板活化和内皮细胞损伤的标志物[23-25]。P-selectin、vWF 含量上调提示眼镜蛇毒在体内引起内皮细胞、血小板激活与消耗,从而在血栓弹力图中表现为MA 值降低,血小板功能的减弱。 同时血浆血红蛋白含量及LDH 活力增高提示细胞损伤,其原因为眼镜蛇毒中细胞毒素,磷脂酶A2 等造成细胞膜的破坏,进一步造成继发性凝血功能紊乱。 酶切发色底物活性测定结果表明两种注射方式酶切凝血酶、凝血因子Ⅹa 底物活性均有一定上调,提示眼镜蛇毒注射到大鼠体内后激活了凝血系统,导致凝血因子被消耗,从而表现出凝血因子的减少。
本研究基于大鼠全血凝血功能评价,结合血管内皮损伤等指标,通过体内体外实验展示了眼镜蛇毒对大鼠凝血功能的影响,其作用与激活凝血系统导致凝血因子消耗、纤维蛋白原减少、血小板消耗等有关。 上述结果能够进一步认识眼镜蛇毒对凝血功能毒性机理,本研究有助于为临床蛇伤防治策略及新药研究提供参考。
