siRNA抑制GPX1表达对新霉素诱导HEI-OC1细胞凋亡的影响
2022-07-15陈放王雪峰
陈放 王雪峰
因氨基糖苷类抗生素成本低和良好的治疗革兰氏阴性菌感染的疗效而被广泛使用[1],然而,其耳毒性可导致内耳毛细胞损伤[2]。这类抗生素可导致内耳毛细胞发生氧化应激[3]和凋亡[4],因此减轻氨基糖苷类抗生素的耳毒性具有重要的临床意义[5]。谷胱甘肽过氧化物酶1(GPX1)是一种对抗氧化应激的酶,有清除氧自由基、抗氧化[6]、抗凋亡[7]等作用。根据报道,GPX1在耳蜗中的含量相对较高,且在GPX1敲除的小鼠中,噪声造成的毛细胞和神经纤维损伤会加重[8],因此,推测其可能具有抗毛细胞凋亡的生物作用。目前未见GPX1对药物性聋影响的报道;耳蜗毛细胞系(HEI-OC1)广泛用于研究涉及耳毒性药物作用和分子机制或筛选潜在的耳毒性药物,鉴于此本研究观察了GPX1在HEI-OC1细胞中的表达,并通过抑制GPX1的表达探讨GPX1对新霉素诱导毛细胞凋亡的影响,为氨基糖苷类药物性聋的防治提供新的靶点。
1 材料与方法
1.1细胞株 耳蜗毛细胞系HEI-OC1由山东省耳鼻喉研究所提供。此细胞系美国House耳研究所(House Ear Institute, HEI)从永生化小鼠耳蜗Cotri器分离培养,并能在体外稳定传代培养。
1.2主要试剂与仪器 DMEM培养基、进口胎牛血清购自美国Gibco公司;Western blot试剂盒购自碧云天生物公司;GPX1抗体购自英国Abcam公司;Trizol试剂、TUNEL染色试剂盒、逆转录试剂盒和SYBR green Master Mix试剂盒购自美国赛默飞公司;Bax、BCL-2、Caspase-3抗体购自美国Cell Signaling Technology公司;Myosin-7a抗体购自美国Proteus Biosciences公司;β-Actin抗体购自中国中杉金桥公司;siRNA转染试剂购自上海吉码公司;新霉素、CCK8试剂盒、DAPI购自美国默克公司;酶标仪为上海必优生物科技有限公司产品;PCR分析仪产于德国Eppendorf公司;激光扫描共聚焦显微镜源自徕卡公司。
1.3研究方法
1.3.1细胞培养及分组 将HEI-OC1细胞置于DMEM中,胎牛血清的体积为10%,并在二氧化碳体积分数为10%,温度为33℃培养箱中培养。该细胞系的所有实验均在对数生长期进行。首先将HEI-OC1细胞进行细胞培养后采用免疫荧光法观察GPX1表达;然后给予0、1、3、5、10、15 mM新霉素处理24 h,采用CCK8法计算细胞活力和新霉素半抑制浓度;再将细胞分为两组,对照组为不给予任何处理的细胞,新霉素组给予细胞10 mM新霉素处理24 h,采用免疫荧光染色、qRT-PCR和Western blot法观察GPX1的表达;第四步将细胞分为空白对照组、阴性对照组、实验组,空白对照组不进行任何处理,阴性对照组细胞转染无意义的siRNA,实验组细胞转染siRNA-GPX1;转染成功后,空白对照组不进行任何处理,阴性对照组细胞和实验组分别给予10 mM新霉素处理24 h,采用CCK8法检测三组细胞活力,免疫荧光染色、TUNEL染色和Western blot法检测法三组细胞凋亡状况。
1.3.2siRNA转染HEI-OC1细胞 将HEI-OC1细胞以100 000个/mL的密度接种在6孔或96孔板中过夜,并按照siRNA-mate转染试剂的说明进行转染;最后,收集细胞用于蛋白质印迹、免疫荧光染色和qRT-PCR检测。使用的所有siRNA序列如下:siRNA-Control 序列正义链:5’-UUCUCCGAACGUGUCACGUTT-3’,反义链5’-ACGUGACACGUUCGGAGAATT-3’,siRNA-GPX1序列正义链:5’-CCAGGAGAAUGGCAAGAAUTT-3’,反义链: 5’-AUUCUUGCCAUUCUCCUGGTT-3’。
1.3.3细胞活力检测及新霉素半抑制浓度测定 将HEI-OC1细胞(5 000个/孔)分三批接种到96孔板中,孵育过夜;第二天,给予新霉素,并在24小时后添加10 μL CCK-8试剂;孵育2小时后,使用酶标仪测量450 nm处的光密度(OD),计算细胞活力值及半抑制浓度(50% inhibitory concentration, IC50),比较细胞存活率,细胞存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%,运用Graphpad Prism5.0软件计算IC50值。
1.3.4蛋白质提取和Western blot检测 通过Western blot检测GPX1、抗凋亡因子BCL-2和促凋亡因子BAX的表达水平。使用RIPA裂解缓冲液提取HEI-OC1细胞的总蛋白,并根据说明使用BCA蛋白定量试剂盒测量蛋白质浓度,总共30 μg的蛋白质在95°C下变性10分钟,然后通过十二烷基硫酸钠盐-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离;将分离的蛋白质转移到聚偏二氟乙烯膜上,在含有5%脱脂奶粉的TBST中封闭1小时,并与一抗在4℃下孵育过夜;第二天用TBST洗涤后,将膜与二抗孵育1小时,并使用ECL试剂盒中的化学发光溶液在暗室曝光显影。实验结果显示各样品的灰度值,使用Image J软件以β-Actin为对照蛋白来测量和分析GPX1、BCL-2和BAX的相对灰度值,分别表示各组蛋白的表达水平;蛋白相对灰度值=实验蛋白灰度值/β-Actin蛋白灰度值。
1.3.5RNA提取和qRT-PCR检测 按照说明检测GPX1的mRNA表达,使用Trizol试剂从HEI-OC1细胞中提取总RNA,再用逆转录试剂盒将RNA反转录为cDNA。SYBR green Master Mix试剂盒和PCR分析仪用于通过qRT-PCR检测各种基因表达。PCR条件如下:进行40个循环,在96℃下预变形2分钟,在95℃下变性30秒,并在60℃下退火30秒。将每个样品的基因表达水平标准化为相应的表达水平,并通过解链曲线确认每个PCR的特异性。GAPDH引物序列,正义链:5’-GTATGACTCCACTCACGG-3’,反义链5’- GGTCTGGCTCCTGGAAGA-3’。GPX1引物序列,正义链:5’- GTATGACTCCACTCACGG-3’,反义链5’-GGTCTGGCTCCTGGAAGA-3’。应用2-△△ct法对GPX1和GAPDH表达进行定量检测,每组细胞至少重复3次。
1.3.6免疫荧光染色 HEI-OC1细胞用4%多聚甲醛固定1个小时,0.1%Triton X-100打孔10分钟,然后用含1%牛血清白蛋白、5%灭活驴血清、0.02%叠氮化钠和0.1%Triton X-100的PBS(PBT-1)封闭1小时;将样品在含一抗的PBT-1中4℃孵育过夜。第二天将样品在含有二抗、DAPI、1%牛血清白蛋白、0.1%Triton X-100和0.02%叠氮化钠的PBS(PBT-2)中孵育1小时,在激光扫描共聚焦显微镜下观察样品,根据TUNEL染色试剂盒说明检测细胞凋亡,利用Image J软件计算各组细胞阳性染色率;实验组细胞阳性率=细胞阳性数/实验组细胞总数。利用Image J软件进行细胞计数以计算相对细胞活力,细胞活力=实验组细胞数/对照组细胞数。
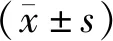
2 结果
2.1GPX1的表达及新霉素半抑制浓度 免疫荧光染色结果显示,HEI-OC1细胞中表达Myosin-7a和GPX1(图1a)。新霉素处理24小时后,新霉素的浓度越高细胞活力越低,HEI-OC1细胞中新霉素的半抑制浓度为10 mM(表1)。采用10 mM新霉素处理HEI-OC1细胞24小时后,新霉素组的GPX1荧光表达较对照组降低(图1b);且GPX1蛋白和mRNA表达水平均降低(图1c、表2),差异均有统计学意义(P<0.05)。
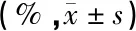
表1 不同浓度新霉素作用下HEI-OC1细胞的抑制率

表2 新霉素组和对照组GPX1表达水平比较
2.2siRNA转染HEI-OC1细胞并活力检测 免疫荧染色光结果显示,siRNA成功转染HEI-OC1细胞(图2a);实验组中GPX1的mRNA和蛋白表达水平分别低于阴性对照组(图2b、表3),差异均有统计学意义(P<0.001)。CCK8结果显示,未经新霉素处理的HEI-OC1细胞GPX1被敲低后,会稍稍降低细胞活力,但这种降低没有统计学意义(P>0.05,表4)。

表3 转染后各组GPX1表达水平比较

表4 敲低HEI-OC1细胞中GPX1表达后各组细胞存活率和敲低HEI-OC1细胞中GPX1后新霉素给药DAPI染色细胞计数
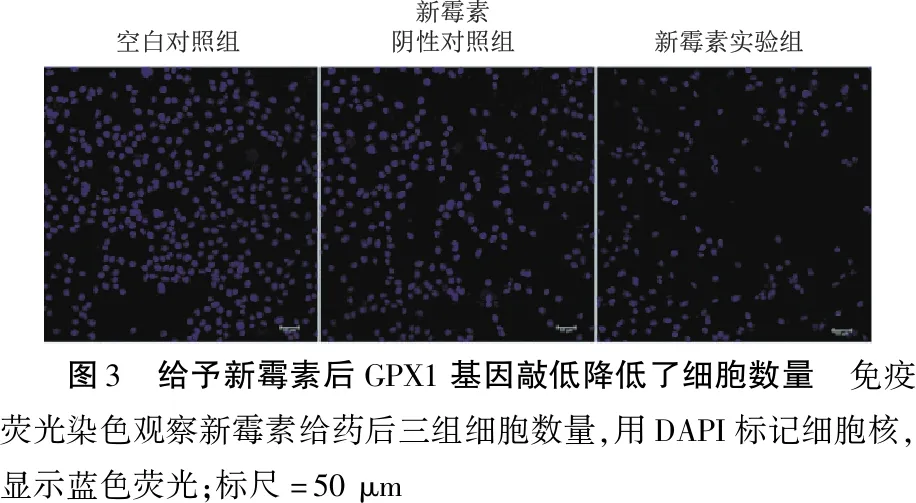
2.3抑制GPX1表达增加了新霉素损伤后HEI-OC1细胞的凋亡 转染成功后给予10 mM新霉素处理细胞24 h,实验组的细胞计数相较阴性对照组明显降低(图3、表4);实验组TUNEL染色阳性率高于阴性对照组(图4a、表5);实验组中CleavedCaspase-3染色阳性率高于阴性对照组(图4b、表5);实验组BAX的相对蛋白水平相对于阴性对照组增加,BCL-2的相对蛋白水平相对于阴性对照组降低(图5、表6),差异有统计学意义(P<0.05)。
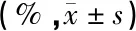
表5 各组细胞的凋亡情况
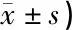
表6 给予新霉素后各组细胞BAX、BCL-2蛋白水平比较(相对灰度值,
3 讨论
谷胱甘肽过氧化物酶(glutathioe peroxidas, GSH-PX)是清除H2O2和脂质氢过氧化物的重要抗氧化酶,是抗氧化酶家族最重要的成员之一,其中GPX1被认为是其主要的酶,广泛存在于所有组织中,被认为在机体的抗氧化防御中起着一定的作用。过氧化氢物会刺激细胞的增值,但过量的过氧化氢物会导致细胞凋亡。GPX1可以通过调节细胞过氧化物水平,有效减少了氧自由基的产生,从而保护细胞免受氧化应激造成的凋亡;其中的机制涉及抗凋亡基因Bcl-2的正调控和促进凋亡基因Bax的负调控。GPX1也是耳蜗内的主要同工型,其在螺旋器、螺旋神经节、血管纹和螺旋韧带的细胞中高度表达[9],因此,推测GPX1可能在耳蜗毛细胞的凋亡过程中起着作用。细胞凋亡是一种程序性细胞死亡的类型,可以诱发听觉细胞的凋亡因素有很多,主要因素有噪声暴露、老年退行性病变和药物毒性等。
有文献报道,氨基糖苷类耳毒性的发生概率约为2%~5%,为药物性耳聋的原因之首,其耳毒性主要表现为耳鸣、听力下降和前庭功能障碍[2,10]。不同的药物耳毒性作用部位也不同,庆大霉素主要作用于前庭毛细胞,可导致眩晕等临床表现;而卡那霉素和新霉素等主要作用于耳蜗毛细胞,可导致严重的双侧感音神经性聋。在这些抗生素中,新霉素具有广谱的抗菌活性,并且随着细菌对其他抗生素和化学药剂的细菌耐药性增加,新霉素的使用正在增加。已有研究显示,新霉素通过氧化应激诱导斑马鱼中耳蜗毛细胞凋亡。鉴于此,本研究观察GPX1在新霉素引起HEI-OC1细胞凋亡中的作用。


HEI-OC1细胞可以被耳蜗毛细胞的特征标记表达,例如:Myosin-7a、math1、prestin和calbindin,这些标记经常用于耳毒性药物的研究。本研究结果显示在HEI-OC1细胞中,新霉素损伤后GPX1表达降低,表明GPX1可能在新霉素引起的耳聋中起了一定的作用。为了进一步观察GPX1对新霉素损伤的耳聋的影响,本研究采用合成siRNA-GPX1并将其转染到HEI-OC1细胞中,使GPX1的表达成功下调;然后观察GPX1是否影响HEI-OC1细胞对新霉素诱导损伤的敏感性,通过免疫荧光染色结果观察到,GPX1的敲低显著降低了HEI-OC1细胞的活力,表明GPX1在新霉素损伤后维持HEI-OC1细胞的活力中具有重要作用。
GPX1具有保护肝脏细胞[11]和成纤维细胞[12]等细胞抗凋亡的生物学效应。在听觉领域的研究中,也发现敲低小鼠的GPX1基因后,噪声暴露导致耳蜗毛细胞和耳蜗神经纤维死亡增加。有研究表明,进行Cleaved Caspase-3和TUNEL染色可以检测新霉素损伤后耳蜗毛细胞凋亡情况[13,14];Caspase-3是细胞凋亡的效应因子,在一定程度上代表细胞的凋亡程度,可作为细胞凋亡标志物。在本研究中,敲低GPX1后给予HEI-OC1细胞新霉素损伤,发现细胞中TUNEL染色和Caspase-3的表达阳性细胞增加;BCL-2家族通常在抑制或促进细胞凋亡中起关键作用,内在的凋亡途径由促凋亡因子BAX和抗凋亡因子BCL-2调控,后者诱导Caspase-3依赖性凋亡[15,16]。这项研究表明,给予新霉素损伤后,GPX1敲低的HEI-OC1细胞中BAX显著增加,而BCL-2降低,进一步验证了上述研究。


总之,本研究通过体外细胞实验证明给予新霉素损伤后,GPX1敲低可增加HEI-OC1细胞凋亡;GPX1可能是预防氨基糖苷类抗生素引起的毛细胞死亡的治疗新靶点。
