基于CEUS的BI-RADS评分系统在乳腺肿块风险评估中的诊断效能研究
2022-07-15关静文王小龙曹秀菁
杨 波,关静文,王小龙,苏 英,曹秀菁
(1.皖北卫生职业学院病理教研室;2.安徽医科大学附属宿州医院病理科;3.安徽医科大学附属宿州医院超声科;4.安徽医科大学流行病与卫生统计学系,安徽 宿州 234000)
乳腺肿块作为女性常见病及多发病,其发病率逐年攀升,其中乳腺癌已成为女性死亡率第2位的恶性肿瘤,严重威胁女性生命安全[1],但由于发病早期临床症状和体征不典型,因此乳腺肿块的良恶性诊断及鉴别是提高乳腺疾病治愈率的关键。近年来,超声影像学检查以其无创性、简便性、经济性、直观性、可重复性等优点被广泛应用于乳腺肿块的诊断中[2]。其中乳腺超声影像报告及数据系统(breastimaging reporting and data system,BI-RADS)是在常规二维彩色多普勒超声基础上对乳腺肿块病变特征进行评分分级诊断评估,使乳腺肿块诊断实现了标准化和规范化[3]。超声造影(contrast-enhanced ul-trasound,CEUS)作为一种新兴的诊断手段,可实时显示肿块血流灌注、增强效果等,进一步提高了病灶血管的显示率[4]。然而乳腺良性肿块和早期恶性肿块在形态学上差异性较小,使其在超声声像图上具有一定的重叠性,单纯应用常规超声或CEUS检查诊断极易造成漏诊或误诊[5]。因此如何更加有效、精准地鉴别诊断乳腺肿块的良恶性,降低良性肿块的穿刺率及恶性肿块的漏诊或误诊率,仍是目前临床研究的热点及难点。本文旨在对乳腺肿块行常规超声和CEUS检查,并分别对其进行BI-RADS评分分级,比较两种检查方案单独及联合应用时对乳腺肿块良恶性评估的诊断效能价值。现将本方案研究结果报道如下。
1 资料与方法
1.1 一般资料采用单纯随机抽样,选取2019年9月至2021年6月间安徽省某三甲医院诊治的90例女性乳腺肿块患者作为研究对象,行常规超声和CEUS检查以及两者联合检查,并分别对其进行BI-RADS评分分级诊断,以乳腺粗针穿刺或外科手术病理学诊断结果为金标准。年龄19~66岁,平均(39.52±6.95)岁。经查乳腺肿块102例,左侧60例,右侧42例,内外上象限者分别为24例和30例,内外下象限者分别为22例和26例,直径0.65~3.33 cm,平均(2.50±0.32)cm。本研究经医院伦理委员会批准,且患者签署知情同意书。
1.2 纳入及排除标准纳入标准:(1)因乳腺肿块初次就诊的女性患者;(2)临床资料无缺失,知情同意本研究内容;(3)无造影禁忌症;(4)行乳腺粗针穿刺或手术切除,取得病理诊断结果[6]。排除标准:(1)妊娠或哺乳期;(2)病变乳腺有穿刺或外科手术既往史;(3)有恶性肿瘤病史;(4)肝肾功能异常;(5)患有全身性疾病;(6)乳腺多灶性肿块患者;(7)临床资料不完整。
1.3 研究方法
1.3.1 病理诊断 患者均行乳腺粗针穿刺或外科手术切除送检,获得病理活检诊断结果。
1.3.2 常规超声检查及BI-RADS评分分级 患者取仰卧位,双臂抬高暴露两侧乳房,行常规彩色多普勒超声检查,频率设为6~13MHz。以乳头为中心顺时针行放射扫查,避免过分施压,以免压闭小血管,调整最佳病灶取样框,观察乳房病灶所在位置、形态大小、肿块回声、血流信号等情况。经常规超声发现病灶102例,进行BI-RADS 评分分级。据文献总结判定[7],本研究仅将BI-RADS 2~5级纳入研究范围:2级为良性发现,无恶变风险;3级恶性风险≤2%,无恶变特征;4级影像检查为恶性可能[3]:其中4a级恶性风险3%~8%,影像检查有1个疑似恶变特征,为低度恶性可能;4b级恶性风险9%~49%,影像检查有2个疑似恶变特征,为中度恶性可能;4c级恶性风险50%~94%,影像检查有3个疑似恶变特征;5级恶性风险≥95%,影像检查有3个以上疑似恶变特征,为高度恶性可能。判定标准:2~3级纳入良性病变,4~5级归为恶性病变。
1.3.3 CEUS检查及BI-RADS评分分级 经常规超声显示乳腺病灶,避开多发性钙化灶,取血流最丰富的切面,行CEUS检查。经肘浅静脉2s内注入造影剂六氟化硫微泡混悬液2.4 mL,即刻冲注5 mL 0.9% NaCl溶液。借助超声仪和工作站把常规二维彩色多普勒和造影图像同步储存,实时观察乳腺病灶动态灌注过程,观察时间≥3 min[8]。依据病灶增强水平、肿块范围及边缘变化、病灶血管分布等情况对肿块进行BI-RADS评分分级:如病灶呈均匀增强且增强后界清、径线无增大、边缘规则无放射状或蟹足状增强,则常规超声BI-RADS 2~3级保持不变,而4~5级降为3级[9];若病灶呈高增强、不均性增强、出现灌注缺损区、径线增大、边缘不规则呈蟹足样或放射状、迂曲血管插入病灶等,满足2项及以上者,则常规超声BI-RADS 4~5级保持不变,2~3级增至4a级[10]。
1.3.4 联合诊断 两项诊断中如有1项为恶性病变则判定为恶性。
1.4 评价指标(1)统计乳腺粗针穿刺或外科手术病理活检诊断结果(金标准);(2)比较CEUS检查增强开始时间、达峰时间和峰值强度;(3)比较常规超声BI-RADS评分、CEUS检查BI-RADS评分及两者联合应用的诊断结果[11];(4)比较三种诊断方案的灵敏度、特异度、准确度、假阴性率、假阳性率及Kappa值和Youden指数;(5)准确度=(真阳性+真阴性)/总例数×100 %,灵敏度=真阳性/(真阳性+假阴性)×100 %,特异度=真阴性/(真阴性+假阳性)×100 %,假阳性率(误诊率)=假阳性/(假阳性+真阴性),假阴性率(漏诊率)=假阴性/(假阴性+真阳性);Youden指数=(灵敏度+特异度)-1,指数越大,则真实性越高;Kappa值为-1.00~1.00,其中0.81~1.00为几乎完全一致,0.61~0.80为高度一致性,0.41~0.60为一致性中等,0.21~0.40为一致性一般,0.00~0.20 为一致性极低。
1.5 统计学分析数据采用SPSS 22.0软件进行统计分析,计量资料用“均数±标准差”表示,采用t检验;计数资料用例数和百分率或构成比描述,采用卡方检验;评估三种诊断方案与病理诊断结果的一致性采用Kappa检验;绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)比较三种诊断方案的灵敏度、特异度、准确度、假阴性率、假阳性率及Youden指数。检验水准α=0.05,P<α有统计学意义。
2 结果
2.1 临床病理诊断结果102例乳腺肿块病理诊断结果中,良性61例(59.80%),恶性41例(40.20%),其余情况见表1。
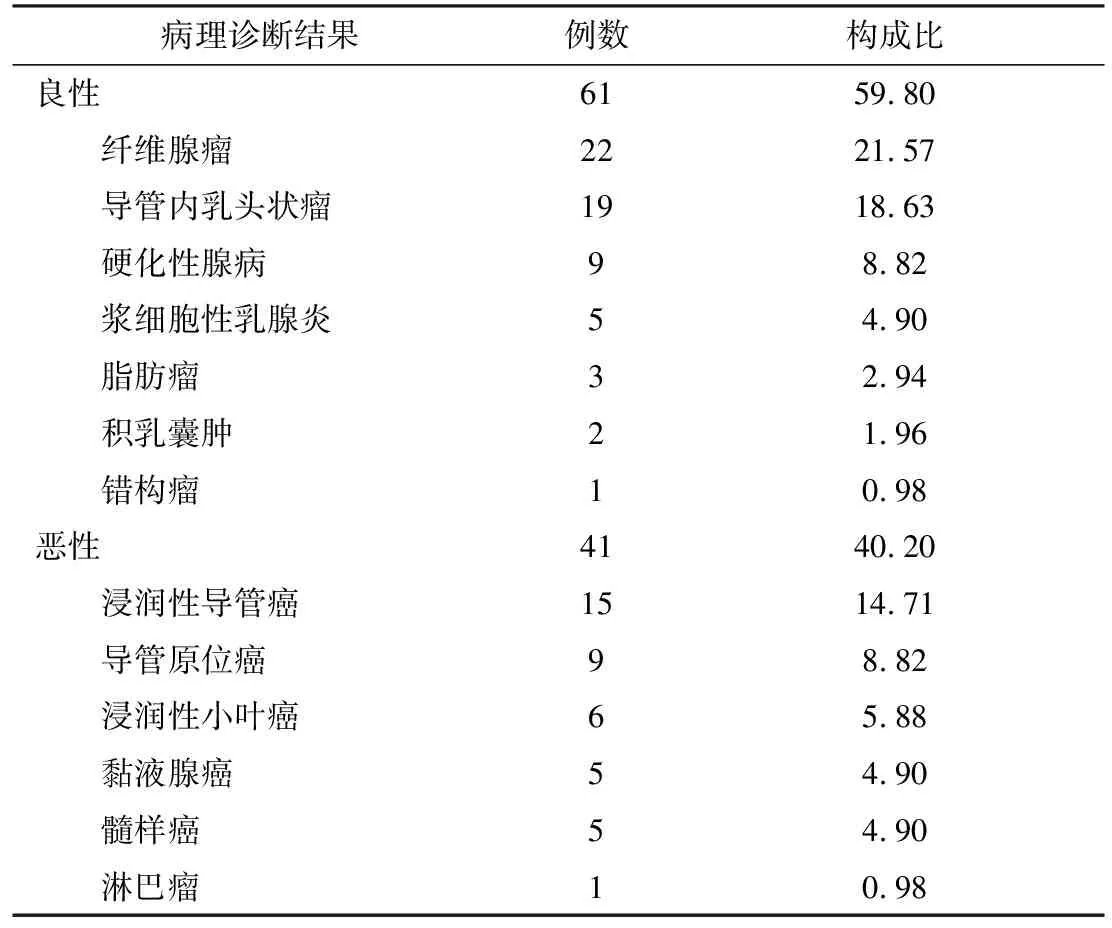
表1 102例乳腺肿块病理诊断结果[n(%)]
2.2 CEUS检查参数比较表2结果显示,恶性肿块峰值强度显著高于良性肿块,而增强开始时间和达峰时间则明显低于良性,差异均有统计学意义(P<0.05)。
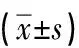
表2 102例乳腺良恶性肿块CEUS检查参数对比
2.3 三种诊断方案对乳腺肿块的诊断效能三种诊断方案对乳腺肿块的诊断结果显示:常规超声诊断乳腺肿块阳性35例,阴性67例;CEUS检查为阳性40例,阴性62例;联合诊断为阳性52例,阴性50例。见表3。
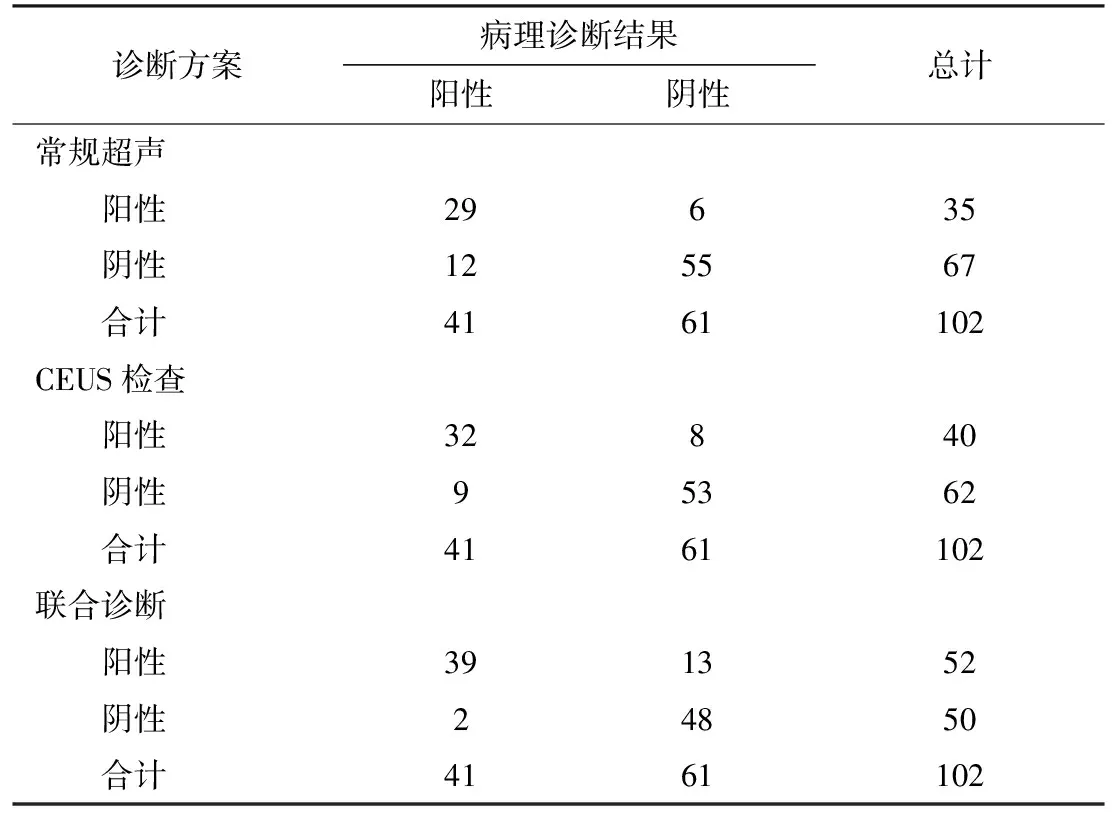
表3 三种诊断方案诊断结果对比(n)
表4结果表明,三种诊断方案中,常规超声联合CEUS检查对乳腺肿块诊断的灵敏度、准确度、Youden指数均高于常规超声和CEUS检查,假阴性率则显著低于常规超声和CEUS检查。但是联合诊断的特异度要低于常规超声和CEUS检查,假阳性率则明显高于常规超声和CEUS检查。常规超声、CEUS检查以及两者联合与病理诊断结果的分别为0.624、0.652和0.707,差异均有统计学意义(P<0.05),其中联合诊断的一致性最好。

表4 三种诊断方案对乳腺肿块的诊断效能比较(%)
2.4 三种诊断方案对乳腺肿块的ROC曲线特征三种诊断方案对乳腺肿块的ROC曲线结果显示,常规超声联合CEUS检查的ROC曲线下面积(area under the curve,AUC)均高于常规超声和CEUS检查。见表5和图1。

表5 三种诊断方案对乳腺肿块的ROC曲线特征比较

图1 三种诊断方案的的ROC曲线
3 讨论
乳腺癌早期发病隐匿,几乎无临床特异症状,较易被忽视。临床实践表明,乳腺癌早期治愈率可达90%以上,因此对乳腺肿块性质及时诊断,采取合理治疗方案,可显著降低早期乳腺癌患者死亡率,这已成为临床共识[12]。病理活检虽是乳腺肿块诊断的“金标准”,但因良性病灶比例相对较高,穿刺或外科手术对乳腺血管、神经等组织具有破坏风险,因此患者接受度较低[13]。超声影像学检查因其无创伤性、简便快捷、准确度高等特点,可有效降低乳腺肿块病理活检风险,是目前应用最广的乳腺肿块辅助诊断方法。研究表明,常规超声可有效提高乳腺肿块良恶性诊断的符合率[14],但对于微小肿块及病灶滋养血管无法准确判定;且对于声像图存在部分重叠的良恶性病灶的分级存在一定的诊断错误或困难。CEUS技术则利用对比剂增强病灶血管信号,可更清晰的分辨和显示病灶微小血管形态分布和微循环灌注等信息[15]。本研究表明,造影后恶性乳腺肿块在增强开始时间和达峰时间显著低于良性,峰值强度则显著高于良性乳腺肿块,差异显著(P<0.05),表明CEUS检查对乳腺肿块的诊断具有较高的价值[16]。但多项研究发现,乳腺良恶性肿块间的增强模式存在一定程度的交叉[17],且受年龄、肿块特征、基础代谢率等因素的影响,CEUS诊断会出现假阴性可能[18],说明CEUS作为单一技术用于诊断乳腺疾病亦具有一定的局限性。
基于此,本方案将常规超声和CEUS检查有机结合,并对结果进行BI-RADS评分分级。本研究的61例乳腺良性病灶中,联合诊断正确评估出48例,其中13例未做出正确诊断的病灶分别是纤维腺瘤5例,导管内乳头状瘤6例,硬化性腺病2例,可能由于这些病灶合并纤维化或钙化,血管走形不规则,分布不均匀,在声像图上易与恶性病变产生混淆。41例恶性病灶中,联合诊断正确评估出39例,其中2例恶性病灶均因体积较小、血供较少、边界不规则而被误诊为良性病变。进一步研究显示,联合诊断的灵敏度、准确度、Youden指数均高于常规超声和CEUS检查,假阴性率则显著低于常规超声和CEUS检查。联合诊断的曲线下面积(AUC)均高于常规超声和CEUS检查单独应用,说明联合诊断可以提高乳腺肿块诊断的真实性,与有关报道[19]基本一致。常规超声对于观察肿块的病变范围、形态结构、边缘特征、内部及后方回声等形态学特征具有较高的显示率,亦对肿块内部的主干、较大分支血管的血流分布特点、血流动力学变化等特异度较高,但对于<100 μm新生微小血管无法显示。由于乳腺恶性肿块微小血管病变往往早于形态结构改变,CEUS技术可实时动态显示肿块内部新生滋养微小血管的形态分布、连续性、走行,以及微小循环血流灌注,时空分辨率较高,提高了乳腺腺体定性及定量评估的准确度,弥补了常规超声对于低速血流、新生微小血管不敏感的缺点,但其在乳腺肿块的风险评估中尚无统一诊断标准[19]。两者联合不仅能避免部分恶性病变可能出现的间质增生、粘液性变、纤维化及钙化等情况而引起的误判,又能提高对较为复杂的病理结节的鉴别[11]。可见,联合诊断克服了单一显像的不足,将常规超声和CEUS检查的优势互补,进而实现更高的诊断价值。Kappa值作为衡量超声诊断一致性的重要指标,可真实反映超声诊断的价值[20]。本研究亦显示,联合诊断与病理诊断结果的Kappa值最高,说明联合诊断的一致性更高,这与王维娜等[21]的研究结果一致,进一步肯定了联合诊断的具有更高的临床价值。
综上所述,常规超声联合CEUS的BI-RADS评分分级诊断对乳腺肿块良恶性的诊断与病理诊断的一致性较高,且真实性也较高,显著降低了假阴性率,提高了诊断的灵敏度、准确度,具有较高的诊断效能,减少了不必要的活检,对乳腺肿块风险评估具有较高的价值。
尽管如此,本研究仍有不足,尽管在常规超声及CEUS检查上都采用了BI-RADS评分分级,这在一定程度上避免了超声医师的主观性,但在乳腺肿块超声声像图不够典型时,仍可能影响评估的一致性。同时在超声检查时仅选取血流最丰富、形状不规则区域,避开了多发性钙化灶,未获取特殊病灶的影像学信息,且样本量较少,故研究结果可能存在一定低估比例。后期将增加弹性成像、彩色多普勒血流显像评分等新技术来完善评分方法,尚需前瞻性大样本量的临床研究以进一步佐证。
