PHF19对肺癌细胞增殖、迁移和侵袭的影响
2022-07-15张志迪刘瑞芳金在顺
张志迪,刘瑞芳,金在顺
(1.牡丹江医学院病理学教研室,黑龙江 牡丹江 157011;2.邢台市人民医院病理科,河北 邢台 054000)
肺癌是发病率和死亡率增长最快的恶性肿瘤之一[1]。尽管许多治疗策略在早期非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗中显示出疗效,但NSCLC患者的5年生存率并不令人满意[2]。锌指蛋白19 (PHD finger protein19,PHF19)是一种多梳蛋白,控制H3K36me3和H3K27me3,PHF19通过激活多梳抑制复合体2(Polycomb repressive complex2,PRC2)和广泛的H3K27me3结构域的形成促进了肿瘤的发生[3-4]。此外,PHF19还通过H3K27me3沉积[5]调控前列腺癌细胞的增殖和侵袭性。然而,PHF19在肺癌中的作用尚不清楚。本文主要研究PHF19对肺癌细胞增殖、迁移和侵袭的影响,希望能为治疗肺癌提供一种新的靶点。
1 材料与方法
1.1 材料与试剂人肺癌A549细胞株、293T人胚肾细胞株(无锡欣润生物科技有限公司);胎牛血清(以色列BI生物科技公司);转染试剂(上海生工生物工程有限公司),引物(上海生工生物工程有限公司合成);RNA提取试剂盒(美国OMEGA公司);逆转录试剂盒(Roche公司);SYBR Green Tap Ready Mix(Roche公司);PCR仪(美国BIO-RAD公司);荧光倒置显微镜(德国徕卡公司);酶标仪(美国Molecular Devices公司)。
1.2 方法
1.2.1 细胞培养 复苏293T人胚肾细胞、肺癌A549细胞,将其放入含10% FBS的F12K培养基中,置于37 ℃、5% CO2培养箱中培养,待密度达到80%左右进行传代、冻存等其它实验。
1.2.2 RT-qPCR检测细胞中PHF19的mRNA表达 培养293T人胚肾细胞和肺癌A549细胞,将其分为293T组、A549组;按照E.Z.N.A.TM HP Total RNA Kit说明书提取以上两组细胞总RNA;将A549细胞均匀铺于六孔板中(每孔3×105个细胞),待细胞均匀贴壁且密度达到70%左右进行转染,未做任何处理组为Control组、转染pcDNA3.1质粒为pcDNA3.1组、转染pcDNA3.1-PHF19质粒组为pcDNA3.1-PHF19组,吸除每孔旧培养基,加入Opti-MEM培养基后置于培养箱,按照LipoHigh脂质体高效转染试剂说明书准备转染工作液(pcDNA3.1组:a:将pcDNA3.1质粒溶于Opti-MEM培养基轻轻混匀,室温静置5 min;b:将LipoHigh溶于Opti-MEM培养基轻轻混匀,室温静置5 min;c:将上步含有LipoHigh的培养基加入含有pcDNA3.1质粒的培养基中,轻轻混匀,室温静置20 min后加入对应孔中;pcDNA3.1-PHF19组:a:将pcDNA3.1-PHF19质粒溶于Opti-MEM培养基轻轻混匀,室温静置5 min;b:将LipoHigh溶于Opti-MEM培养基轻轻混匀,室温静置5 min;c:将上步含有LipoHigh的培养基加入含有pcDNA3.1-PHF19质粒的培养基中,轻轻混匀,室温静置20 min后加入对应孔中),转染6 h后更换常规培养液,24 h后提取以上三组细胞总RNA,采用NANODROP测定RNA浓度及纯度,将每组细胞逆转录为cDNA。用FastStart Universal SYBR Green Master(ROX)完成扩增。反应条件如下:95 ℃ 5 min;95 ℃ 30 s;60 ℃ 30 s;72 ℃ 50 s;进行40个循环;72 ℃ 5 min,收集数据。以2-△△CT法来对PHF19 mRNA的表达情况进行计算。引物序列见表1、反应体系见表2。
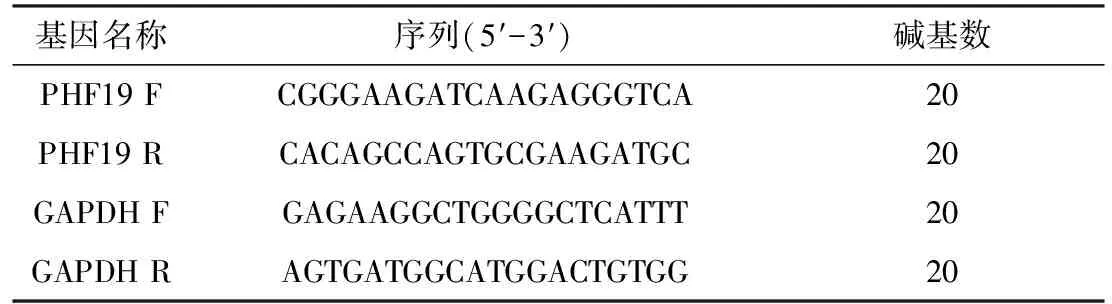
表1 RT-qPCR引物扩增序列

表2 RT-qPCR反应体系
1.2.3 CCK8检测细胞增殖能力 实验前选用2个96孔板接种细胞,每孔1.3×104个细胞,待细胞均匀贴壁且密度达到70%左右进行转染,未做任何处理组为Control组、转染pcDNA3.1质粒为pcDNA3.1组、转染pcDNA3.1-PHF19质粒为pcDNA3.1-PHF19组(转染方法同1.2.2),将细胞分别置于37 ℃、5%CO2的孵箱中孵育24 h、48 h。然后在每孔中加入CCK-8(10 μl),1 h后用酶标仪检测450 nm处吸光度值。
1.2.4 EdU实验检测细胞增殖能力 实验前将多聚赖氨酸细胞爬片用镊子夹住放入24孔板中,每孔接种1×105个细胞,待细胞均匀贴壁且密度达到70%左右进行转染,未做任何处理组为Control组、转染pcDNA3.1质粒为pcDNA3.1组、转染pcDNA3.1-PHF19质粒为pcDNA3.1-PHF19组(转染方法同1.2.2);24 h后弃掉每孔培养液,加入250 μL常规培养液,再加入250 μL EdU工作液(提前将2 μL EdU与1 mL培养基混匀并于37 ℃水浴锅中预热),将24孔板放入培养箱2 h;2 h后取出去除孔中液体加入500 μL 4%多聚甲醛固定细胞15 min,弃去固定液每孔加入500 μL PBS冲洗2次;每孔加入200 μL通透液(含0.3% TritonX-100的PBS),室温孵育15 min;弃去通透液,每孔加入500 μL PBS冲洗2次;再加入Click反应液(430 μL Click Reaction Buffer、20 μL CuSO4、1 μL Azide594和50 μL Click Additive Solution吹打混匀)室温避光染色30 min;弃去Click反应液每孔加入500 μL PBS冲洗2次;每孔加入100 μL 1×Hoechst染色,弃去Hoechst,每孔加入500 μL PBS冲洗2次;载玻片上滴6 μL封片液后取出爬片将其倒扣于载玻片上,荧光显微镜下观察2 h增殖细胞数。EdU阳性显示率=EdU阳性细胞数(红色细胞)/Hoechst显色细胞(蓝色细胞)总数。
1.2.5 Transwell实验检测细胞迁移、侵袭能力 实验前选用六孔板接种细胞,每孔3×105个细胞,待贴壁细胞密度达到70%进行转染(转染方法同1.2.2),将其分为Control组、pcDNA3.1组、pcDNA3.1-PHF19组。Transwell小室置于24孔板中并滴入Matrigel胶(迁移实验不铺胶)置于培养箱中4 h后取出;将每组细胞用胰酶消化、离心弃上清,用无血清培养基重悬细胞并计数,将1×105个细胞加入200 μL无血清培养液于EP管中混匀后滴入上室,将含血清的培养基加入下室。24 h后用PBS清洗,4%多聚甲醛固定穿过的细胞后再用PBS清洗,1%结晶紫染色拍照。
1.3 统计学处理采用GraphpadPrism 8软件对实验所得数据进行统计学分析与比较,计量资料以“均数±标准差”表示,两组间数据的比较采用单因素方差分析t检验,当P值小于0.05时,差异具有统计学意义。
2 结果
2.1 PHF19在肺癌A549细胞中低表达RT-qPCR结果表明,与对照组293T人胚肾细胞相比,PHF19 mRNA在肺癌A549细胞中低表达。差异有统计学意义(P<0.01),见表3。

表3 RT-qPCR验证PHF19 mRNA在肺癌细胞和293T细胞中的相对表达量
2.2 过表达PHF19后肺癌A549细胞中PHF19 mRNA表达增多RT-qPCR结果表明,与pcDNA3.1组相比,pcDNA3.1-PHF19组PHF19 mRNA的水平显著增高,差异有统计学意义(P<0.01),而Control组与pcDNA3.1组相比,差异无统计学意义(P>0.05),见表4。

表4 RT-qPCR验证过表达PHF19后肺癌A549各组细胞PHF19 mRNA相对表达量
2.3 过表达PHF19后肺癌A549细胞增殖活性降低CCK-8检测结果表明,pcDNA3.1-PHF19作用24 h、48 h后,与pcDNA3.1组相比,pcDNA3.1-PHF19组细胞增殖活性显著降低,差异有统计学意义(P<0.01),而Control组与pcDNA3.1组相比,差异无统计学意义(P>0.05),见表5。

表5 过表达PHF19基因后肺癌A549各组细胞存活率
2.4 过表达PHF19使肺癌A549细胞增殖能力降低EdU结果显示,pcDNA3.1-PHF19作用24 h,与pcDNA3.1相比,显著抑制了pcDNA3.1-PHF19组细胞的增殖能力,差异有统计学意义(P<0.01),而Control组与pcDNA3.1组相比,差异无统计学意义(P>0.05)(图1、表6)。

图1 过表达PHF19基因后细胞增殖能力(×200)

表6 过表达PHF19基因后肺癌A549各组细胞增殖能力
2.5 过表达PHF19基因后肺癌A549细胞侵袭和迁移能力降低Transwell结果表明,pcDNA3.1-PHF19组与pcDNA3.1组相比侵袭能力(2A)、迁移能力(2B)显著下降,差异具有统计学意义(P<0.01),而Control组与pcDNA3.1组相比,差异无统计学意义(P>0.05)(图2、表7)。

表7 过表达PHF19基因后肺癌A549各组细胞侵袭、迁移能力
3 讨论
人类PHF19位点位于染色体9q33.2,最初在一个永生化的人类成纤维细胞系[6]的一个逆转录病毒整合位点附近被识别。多梳蛋白是一类与染色体相关的基因抑制因子,参与胚胎发育、干细胞分化、细胞生长和分化等多种生物学过程[7]。它们通常形成两个众所周知的复合体PRC1和PRC2(多梳抑制复合体1和2)来修饰表观基因沉默[8]。多梳蛋白的异常表达会导致包括癌症在内的疾病的发生[9-10]。
PHF19在许多人类癌症中过度表达,Zhang等[11]研究证明LINC00355通过海绵吸附miR-15a-5p来提高PHF19的表达,促进胃癌细胞的生存能力、迁移能力和侵袭能力,降低了胃癌细胞G1期的积累和凋亡,从而促进胃癌进展。Wang等[12]研究证明了PHF19高表达与胃癌患者预后不良有关,PHF19的下调可能通过降低AKT和ERK信号通路的活性来强烈抑制胃癌细胞的增殖和迁移。此外,PHF19基因的稳定敲除抑制了裸鼠胃癌细胞的致瘤性,提示PHF19可能是胃癌潜在的生物标志物和药物靶点。因此,我们猜测PHF19可能作为癌基因在肺癌的发生发展中起到促癌作用。
为了探究PHF19基因在肺癌中是否发挥促癌作用,首先利用RT-qPCR实验检测了PHF19基因在293T人胚肾细胞与肺癌A549细胞中的表达情况,发现与293T人胚肾细胞相比,PHF19基因在肺癌细胞中低表达。然后我们构建了PHF19过表达质粒,通过体外实验进行了瞬时转染实验,选用RT-qPCR验证转染效率,结果显示pcDNA3.1-PHF19组PHF19 mRNA的表达量显著高于pcDNA3.1组,说明转染成功;随后通过CCK8实验检测了过表达PHF19基因对肺癌细胞增殖活力的影响,转染24h、48h后发现,过表达PHF19基因显著抑制了肺癌细胞的增殖能力;随后又进行了EdU细胞增殖检测实验,利用荧光显微镜拍照,发现pcDNA3.1-PHF19组的阳性细胞数明显低于pcDNA3.1组,说明过表达PHF19基因显著抑制了肺癌细胞的增殖能力,接下来进行了Transwell实验,与pcDNA3.1组相比,发现pcDNA3.1-PHF19组侵袭、迁移能力明显降低;以上实验结果与我们之前预测结果相反,实验结果表明过表达PHF19基因在肺癌A549细胞中可以起到抑制癌细胞生长的作用。
综上所述,过表达PHF19基因抑制了肺癌细胞增殖、迁移和侵袭能力,但PHF19与肺癌的发生发展机制尚不明确。有研究表明,PI3K/AKT和Ras/Raf/MEK/ERK信号通路的失调对肿瘤的发生有重要影响[13-15]。在此背景下,我们将会引入PI3K/AKT和Ras/Raf/MEK/ERK信号通路继续研究、以及增加体内实验进一步来研究过表达PHF19基因对肺癌发生发展机制,为治疗肺癌提供新的靶点。
