黄芪多糖对放射性肠炎大鼠肠黏膜损伤的修复作用研究
2022-07-14侯继院单国用龚哲张春礼
侯继院, 单国用, 龚哲, 张春礼
(1.郑州人民医院放疗科,河南郑州 450000;2.郑州人民医院普外科,河南郑州 450000)
腹部、盆腔放射疗法诱发肠壁急性或慢性病变,称为放射性肠炎(radiation enteritis),是恶性肿瘤放疗后的常见并发症[1]。放射性肠炎可累及小肠、结肠和直肠等部位,其中,小肠黏膜损伤预后较其他部位差。目前,临床治疗以手术、对症治疗及营养支持疗法为主,但远期效果并不理想[2-3];而中医药以可喜疗效,毒副作用小,显示了良好的临床应用前景。中药黄芪为豆科植物黄芪Astragalus membranaceus(Fisch.)Bge.或内蒙古黄芪Astragalus membranaceus(Fisch.)Bge var.mongholicusBge.Hsiao等的根,味甘,性微温,入脾、肺经,具有补中益气、固表、利水、托脓、生肌功效,善治痈疽久不溃破、溃久不敛。黄芪多糖(astragalus polysaccharide)是黄芪的主要有效活性成分之一,可缓解溃疡性结肠炎,降低炎症反应,改善肠道黏膜屏障功能[4-5]。本病与慢性溃疡性结肠炎的临床表现有相似之处,均属于中医“泄泻”范畴,但黄芪多糖对放射性肠炎大鼠肠黏膜损伤的治疗作用尚不明确。基于此,本研究建立放射性肠炎大鼠模型,采用黄芪多糖进行干预,探讨黄芪多糖的修复作用及可能机制,以期为黄芪多糖相关药物的研发和放射性肠炎的临床治疗提供实验依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF级8周龄雄性SD 大鼠60只,体质量(280 ± 20)g,购自北京维通利华实验动物技术有限公司,动物质量合格证号:SCXK(京)2016-0011。饲养条件:温度20 ~25 ℃,相对湿度45%~55%,明暗循环时间比1∶1,根据国家实验动物管理条例进行喂养。本研究经郑州人民医院伦理委员会审核批准。
1.2 药品、试剂与仪器黄芪多糖(纯度≥95%,批号:A1427),购自成都曼斯特生物科技有限公司;腺苷酸活化蛋白激酶(AMPK)特异性抑制剂——复合物C 购自美国Sigma 公司(批号:171261);硫氰酸荧光素标记的葡聚糖4(FITC-dextran4,FD4)购自美国Sigma Aldrich 公司;白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)酶联免疫吸附分析(ELISA)检测试剂盒购自晶美(深圳)生物工程公司;兔抗鼠AMPK抗体、磷酸化AMPK(p-AMPK)抗体、哺乳动物雷帕霉素靶蛋白(mTOR)和磷酸化mTOR(p-mTOR)、β-actin抗体购自美国Upstate公司;山羊抗兔辣根过氧化物酶(HRP)标记的IgG购自英国Abcam 公司。高能X 射线直线加速器购自美国Varian 公司;Shimadzu RF-540 荧光分光光度计购自日本岛津仪器公司;酶标仪购自芬兰雷勃公司。
1.3 建立大鼠放射性肠炎模型参照文献研究[6]方法,随机选取48只SD 大鼠,腹腔注射40 mg/kg戊巴比妥钠麻醉后固定于手术板上,用高能X 射线直线加速器进行全腹照射(从剑突至耻骨联合),照射面积8.5 cm × 7.5 cm,其余部位使用5 cm 厚铅板遮挡,源皮距100 cm,照射剂量9 Gy,射线能量6 MV,放射剂量率300 cGy/min,照射时间约3 min,照射1 次。若大鼠出现脱毛、便血、腹泻和体质量减轻等症状则提示建模成功。剩余12只大鼠作为正常组,置于相似环境中但不给予放射线照射。
1.4 分组与药物干预将造模成功的48只SD 大鼠按随机数字表分为模型组、黄芪多糖组、复合物C组、黄芪多糖+复合物C组,每组12只。造模成功后次日,参照文献研究[7]用量,黄芪多糖组给予400 mg·kg-1·d-1黄芪多糖灌胃,复合物C组给予2 mL 复合物C 10 μmol/L 灌胃,黄芪多糖+复合物C组先给予400 mg/kg 黄芪多糖灌胃,4 h 后再灌胃2 mL 复合物C 10 μmol/L,每日1 次,连续7 d;正常组、模型组实验期间给予等量无菌生理盐水灌胃。
1.5 观察指标与方法
1.5.1 大鼠一般情况和疾病活动指数(DAI) 药物开始干预第1天起,每2 d 称量大鼠体质量至第7天给药结束,期间同步观察大鼠摄食饮水、精神状态、排便等生活情况,根据体质量变化、腹泻、便血及大便性状进行DAI 评分。评分标准[8]:①腹泻程度(正常,计0 分;稀便,计2分;水样腹泻,计4分);②便血程度(无出血,计0分;轻度出血,计2分;大出血,计4分)。
1.5.2 荧光素示踪法检测小肠黏膜通透性 末次药物干预24 h后,FD4示踪法向距离回盲部2.5 cm末段回肠肠腔注入0.1 mL FD4溶液(用生理盐水稀释至125 mg/L),0.5 h后取眼球血,分离血浆,应用荧光分光光度计检测其荧光强度,根据荧光强度计算血浆FD4含量。
1.5.3 ELISA法检测小肠黏膜组织IL-1β、TNF-α水平 眼球采血完毕,脊椎脱臼法处死大鼠,解剖分离小肠黏膜组织,取部分组织于匀浆器中匀浆,以3000 r/min(离心半径8 cm)离心15 min,收集上清。酶标板上设置空白孔、标准品孔和样品孔,空白孔不加样品和酶标试剂,标准品孔加不同浓度的标准品50 μL,样品孔先加40 μL 样品稀释液,再加10 μL 待测样品(最终稀释度为5 倍),晃动混匀,除空白孔外其余每孔加100 μL 酶标试剂,封板后37 ℃温育1 h。洗涤液清洗5 次,先加50 μL 显色剂A,再加50 μL 显色剂B,晃动混匀,37 ℃避光显色15 min。加50 μL 终止液终止反应,15 min 内以空白孔调零,应用酶标仪于450 nm 波长处测量吸光度(OD)值。根据标准曲线计算样品IL-1β、TNF-α水平。
1.5.4 苏木素-伊红(HE)染色法观察小肠黏膜组织病理学变化 大鼠处死后以肛门到盲肠为标志点,切取距回盲部5 cm的小肠组织,4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,组织切片(厚度约为4 μm),酒精、二甲苯脱蜡,苏木素、伊红染色,脱水、透明后中性树胶封片,显微镜下观察大鼠小肠黏膜组织病理变化。
1.5.5 透射电镜观察小肠组织结构和绒毛超微结构变化 选取小肠组织典型病灶处,预冷的4%戊二醛-1.5%多聚甲醛固定,梯度酒精脱水,丙酮浸透,环氧树脂包埋剂包埋,超薄切片机切片(厚度约80 nm),3%醋酸铀、柠檬酸铅分别染色5 min,透射电镜下观察小肠组织结构和绒毛超微结构变化。
1.5.6 Western Blot 法检测小肠黏膜组织AMPK通路相关蛋白表达水平 取80 mg 小肠黏膜组织,加入液氮后研磨,提取总蛋白,二喹啉甲酸(BCA)试剂盒检测蛋白浓度,蛋白变性。10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离目的蛋白,80 V恒压电泳30 min,100 V恒压电泳约1 h,湿式转膜仪转至PVDF 膜,300 mA 恒流转膜1 h。5%脱脂牛奶室温封闭1 h。分别加入AMPK 一抗(1∶500 稀释)、p-AMPK 一抗(1∶200 稀释)、mTOR 一抗(1∶500 稀释)、p-mTOR 一抗(1∶200 稀释)、β-actin 一抗(1∶1000 稀释)4 ℃孵育过夜。TBST 洗膜3 次,每次10 min,再加入HRP 标记二抗(1∶2000 稀释),室温孵育1 h。TBST 洗膜3 次,每次10 min,浸入电化学发光(ECL)液,于暗室中曝光显影。实验重复3次。应用ImageJ软件分析蛋白条带灰度值,以目的蛋白条带灰度值/内参β-actin蛋白条带灰度值表示目的蛋白相对表达量。
1.6 统计方法采用SPSS 24.0统计软件对实验数据进行分析,计量资料以均数± 标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况和DAI变化比较正常组大鼠实验期间摄食、饮水、精神状态及排便情况无明显异常;模型组大鼠出现脱毛、弓背、精神萎靡、摄食饮水减少、腹泻、便血、体质量减轻,DAI升高。与模型组比较,黄芪多糖组大鼠肠炎症状明显减轻,从给药第3天开始,DAI 降低(P<0.05);复合物C组肠炎症状明显加重,从给药第3天开始,DAI升高(P<0.05)。与黄芪多糖组比较,复合物C组、黄芪多糖+复合物C组肠炎症状明显加重,从给药第3天开始,DAI 升高(P<0.05)。与复合物C组比较,黄芪多糖+复合物C组肠炎症状明显减轻,从给药第3天开始,DAI降低(P<0.05)。DAI 变化见图1。结果表明,复合物C可加重放射性肠炎大鼠症状,而黄芪多糖可缓解放射性肠炎大鼠腹泻、便血等相关症状。
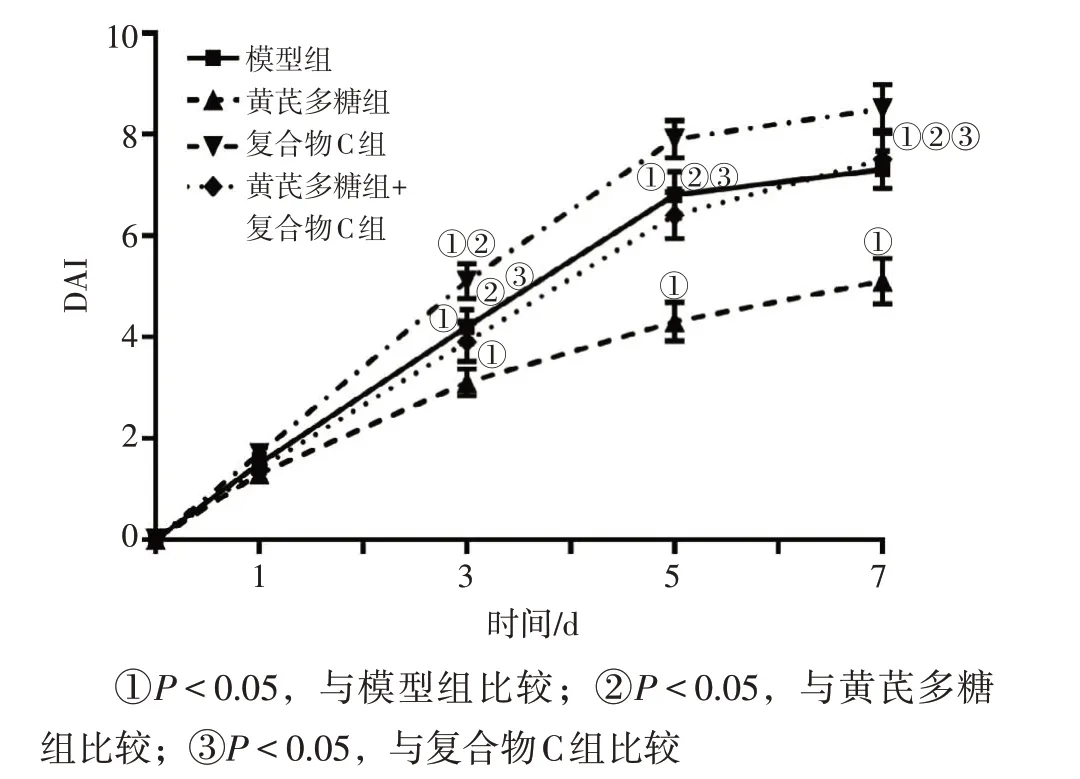
图1 各组大鼠一般情况和疾病活动指数(DAI)变化比较Figure 1 Comparison of changes in general condition and DAI between various groups of rats
2.2 各组大鼠肠道黏膜通透性比较与正常组比较,模型组血浆FD4 含量升高(P<0.05);与模型组比较,黄芪多糖组血浆FD4含量降低,复合物C组血浆FD4 含量升高(P<0.05);与黄芪多糖组比较,复合物C组、黄芪多糖+复合物C组血浆FD4含量升高(P<0.05);与复合物C组比较,黄芪多糖+复合物C组血浆FD4含量降低(P<0.05)。具体结果见表1。结果表明,黄芪多糖可改善放射性肠炎大鼠肠道黏膜通透性。
表1 各组大鼠血浆FD4含量比较Table 1 Comparison of plasma FD4 content among various groups of rats (±s,mg·L-1)
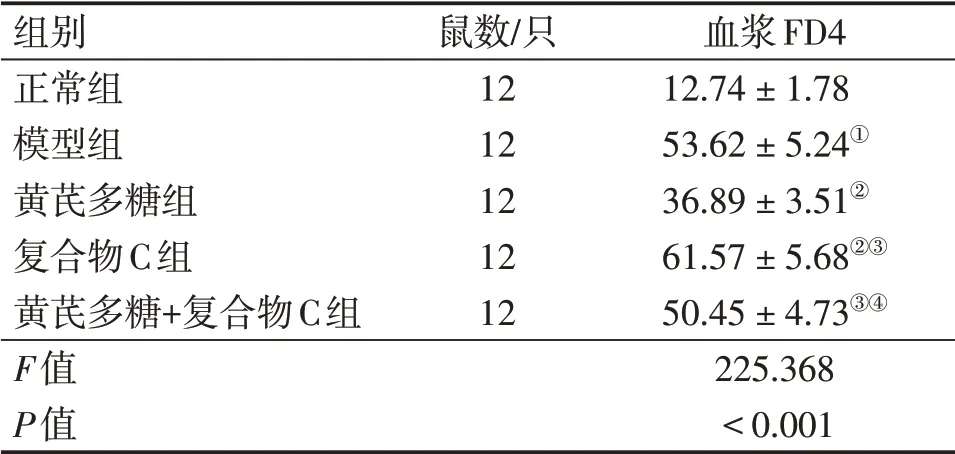
表1 各组大鼠血浆FD4含量比较Table 1 Comparison of plasma FD4 content among various groups of rats (±s,mg·L-1)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与黄芪多糖组比较;④P<0.05,与复合物C组比较
组别正常组模型组黄芪多糖组复合物C组黄芪多糖+复合物C组F值P值鼠数/只1212121212血浆FD412.74±1.7853.62±5.24①36.89±3.51②61.57±5.68②③50.45±4.73③④225.368<0.001
2.3 各组大鼠小肠黏膜组织IL-1β、TNF-α 水平比较与正常组比较,模型组小肠黏膜组织IL-1β、TNF-α 水平升高(P<0.05);与模型组比较,黄芪多糖组小肠黏膜组织IL-1β、TNF-α水平降低(P<0.05),复合物C组小肠黏膜组织IL-1β、TNF-α水平升高(P<0.05);与黄芪多糖组比较,复合物C组、黄芪多糖+复合物C组小肠黏膜组织IL-1β、TNF-α 水平升高(P<0.05);与复合物C组比较,黄芪多糖+复合物C组小肠黏膜组织IL-1β、TNF-α 水平降低(P<0.05)。具体结果见表2。结果表明,黄芪多糖可减轻放射性肠炎大鼠小肠黏膜组织的炎症反应。
表2 各组大鼠小肠黏膜组织IL-1β、TNF-α水平比较Table 2 Comparison of the levels of IL-1β and TNF-α in the small intestinal mucosa among various groups of rats (±s,ng·mL-1)
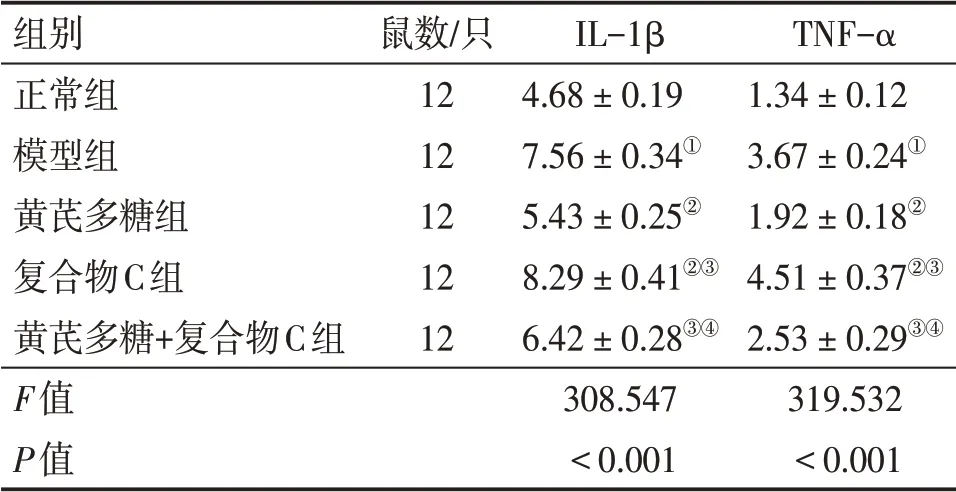
表2 各组大鼠小肠黏膜组织IL-1β、TNF-α水平比较Table 2 Comparison of the levels of IL-1β and TNF-α in the small intestinal mucosa among various groups of rats (±s,ng·mL-1)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与黄芪多糖组比较;④P<0.05,与复合物C组比较
组别正常组模型组黄芪多糖组复合物C组黄芪多糖+复合物C组F值P值鼠数/只1212121212 IL-1β 4.68±0.197.56±0.34①5.43±0.25②8.29±0.41②③6.42±0.28③④308.547<0.001 TNF-α 1.34±0.123.67±0.24①1.92±0.18②4.51±0.37②③2.53±0.29③④319.532<0.001
2.4 各组大鼠小肠黏膜组织病理表现比较正常组大鼠小肠黏膜单层柱状上皮、黏膜肌层和固有层结构完整,腺体结构清晰,肌层、固有层及浆膜无炎性细胞浸润;模型组小肠黏膜结构不完整,隐窝和腺体正常结构消失,小肠上皮结构破坏,黏膜及黏膜下层大量炎性细胞浸润;与模型组比较,黄芪多糖组小肠部分上皮细胞及腺体细胞再生,黏膜结构较完整,炎性细胞浸润减少,病变程度显著减轻,复合物C组小肠黏膜结构严重破坏,炎性细胞浸润增多,病变程度显著加重;黄芪多糖+复合物C组小肠黏膜病变程度较黄芪多糖组加重。具体结果见图2。结果表明,黄芪多糖可改善放射性肠炎大鼠小肠黏膜组织病理损伤。

图2 各组大鼠小肠黏膜组织病理表现比较(HE染色,×200)Figure 2 Comparison of pathological features of small intestinal mucosal tissue among various groups of rats(by HE staining,×200)
2.5 各组大鼠小肠组织结构和绒毛超微结构变化比较正常组大鼠小肠上皮细胞微绒毛完整,细胞结构清晰,排列整齐,紧密连接结构无显著变化;模型组肠上皮细胞空泡变性,大部分杯状细胞排空,线粒体轻度肿胀,粗面内质网扩张,细胞间质水肿伴炎性细胞浸润,肠黏膜紧密连接结构减少,细胞间隙增宽;与模型组比较,黄芪多糖组肠黏膜组织损伤显著减轻,紧密连接结构较完整,间隙扩大程度降低,复合物C组肠黏膜组织损伤显著加重,紧密连接结构显著减少;相较于黄芪多糖组,黄芪多糖+复合物C组小肠黏膜组织损伤加重,紧密连接结构减少,细胞间隙增宽。具体结果见图3。结果表明,黄芪多糖可改善放射性肠炎大鼠小肠超微结构的损伤。
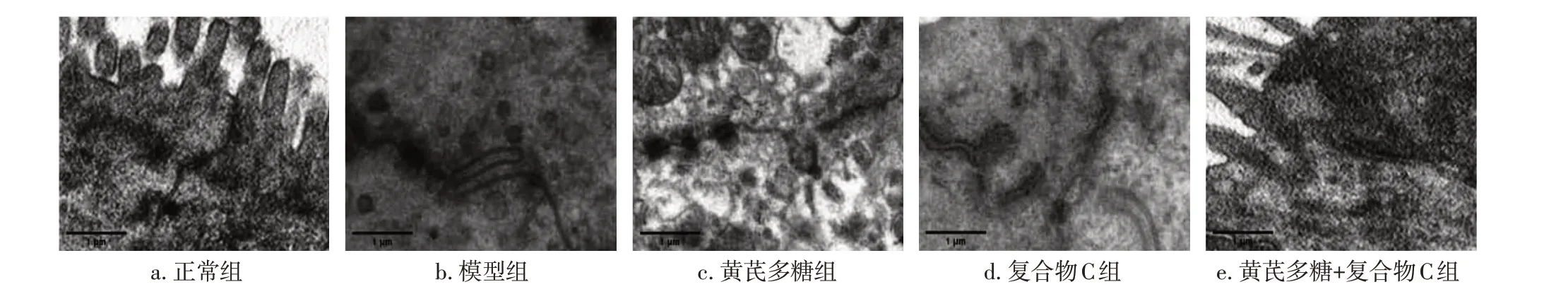
图3 各组大鼠小肠组织结构和绒毛超微结构变化比较(透射电镜,×4000)Figure 3 Comparison of changes in Histological structure of small intestine and ultrastructure of villi among various groups of rats(by transmission electron microscopy,×4000)
2.6 各组大鼠小肠黏膜组织AMPK通路相关蛋白表达水平比较与正常组比较,模型组小肠黏膜组织p-AMPK蛋白相对表达量降低,p-mTOR蛋白相对表达量升高(P<0.05);与模型组比较,黄芪多糖组小肠黏膜组织p-AMPK 蛋白相对表达量升高,p-mTOR 蛋白相对表达量降低(P<0.05),复合物C组小肠黏膜组织p-AMPK蛋白相对表达量降低,p-mTOR 蛋白相对表达量升高(P<0.05);与黄芪多糖组比较,复合物C组、黄芪多糖+复合物C组小肠黏膜组织p-AMPK 蛋白相对表达量降低,p-mTOR 蛋白相对表达量升高(P<0.05);与复合物C组比较,黄芪多糖+复合物C组小肠黏膜组织p-AMPK蛋白相对表达量升高,p-mTOR蛋白相对表达量降低(P<0.05)。具体结果见表3、图4。结果表明,黄芪多糖可调控放射性肠炎大鼠小肠黏膜组织AMPK通路关键蛋白的表达。
表3 各组大鼠小肠黏膜组织AMPK通路相关蛋白表达水平比较Table 3 Comparison of the relative expression levels of AMPK pathway-related proteins in the small intestinal mucosa among various groups of rats (±s,n=3)
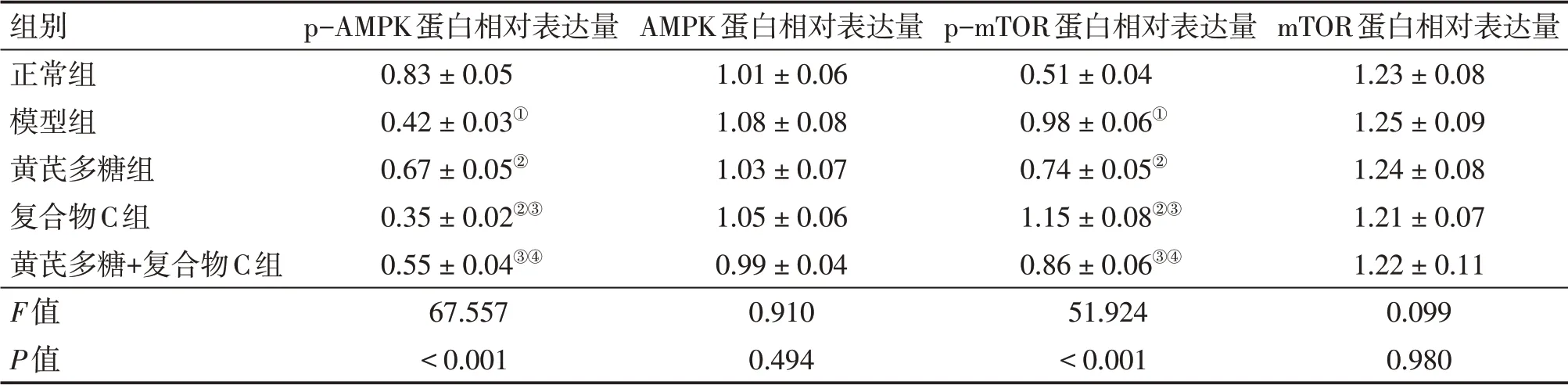
表3 各组大鼠小肠黏膜组织AMPK通路相关蛋白表达水平比较Table 3 Comparison of the relative expression levels of AMPK pathway-related proteins in the small intestinal mucosa among various groups of rats (±s,n=3)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与黄芪多糖组比较;④P<0.05,与复合物C组比较
组别正常组模型组黄芪多糖组复合物C组黄芪多糖+复合物C组F值P值p-AMPK蛋白相对表达量0.83±0.050.42±0.03①0.67±0.05②0.35±0.02②③0.55±0.04③④67.557<0.001 AMPK蛋白相对表达量1.01±0.061.08±0.081.03±0.071.05±0.060.99±0.040.9100.494 p-mTOR蛋白相对表达量0.51±0.040.98±0.06①0.74±0.05②1.15±0.08②③0.86±0.06③④51.924<0.001 mTOR蛋白相对表达量1.23±0.081.25±0.091.24±0.081.21±0.071.22±0.110.0990.980
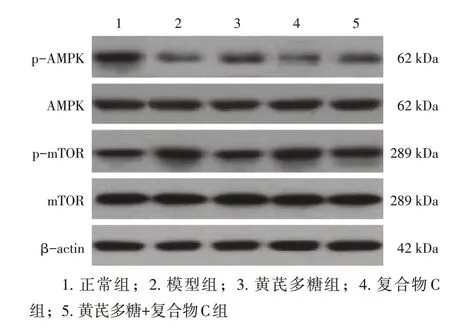
图4 各组p-AMPK、AMPK、p-mTOR、mTOR的Western Blot电泳图Figure 4 Western Blot electropherograms of p-AMPK,AMPK,p-mTOR,mTOR in various groups of rats
3 讨论
放射性肠炎是由于盆腔、腹膜、腹腔恶性肿瘤放疗暴露引发的肠道炎症反应,约15%接受放疗的患者出现慢性肠道疾病[9-10]。放射性肠炎的病理变化主要包括肠道上皮细胞、腺体细胞、血管内皮细胞等受损,引起肠道黏膜炎性浸润水肿、坏死及纤维化。临床上常见腹痛、腹泻、便血、肠梗阻等症状,严重者可出现肠穿孔、肠瘘、毒血症。放射性肠炎的发病机制主要是肠屏障损伤,包括机械屏障、免疫屏障、微生物屏障和化学屏障等,其中,肠道菌群在电离辐射引起的肠损伤的发展中起着关键作用[11]。腹盆腔放疗后未分化细胞过度增生、变性及坏死,使肠绒毛表面的细胞供应中断,肠道微生物失调引起炎症反应,导致肠上皮层缺失、肠道通透性增加和肠黏膜屏障功能受损[12]。因此,寻找低毒、温和、高效可修复肠黏膜损伤的药物对治疗放射性肠炎具有重要意义。
黄芪为常见的“托毒排脓、敛疮生肌”中药,主要成分包括多糖、类黄酮和皂苷等,具有免疫调节、抗炎、抗氧化及抗癌等药理活性[13]。Dong 等[14]研究表明,黄芪多糖可以通过抑制脂多糖(LPS)刺激诱导的有丝分裂原激活蛋白激酶(MAPK)/核因子(NK)-κB 炎症通路的激活而抑制炎性因子和趋化因子产生,减轻小鼠肠道炎症反应。Zhao等[15]研究显示,黄芪多糖可抑制炎症、加速细胞周期、促进修复因子的分泌从而促进伤口愈合。以上研究均证实黄芪多糖具有抗炎作用。本研究结果显示,放射性肠炎大鼠经黄芪多糖干预后,肠炎症状减轻、DAI降低、肠道黏膜通透性减小、小肠黏膜组织炎性因子IL-1β、TNF-α水平降低,且肠黏膜组织病理损伤程度显著减轻,提示黄芪多糖可减轻炎症反应,对放射性肠炎大鼠肠黏膜损伤具有修复作用。
AMPK 是由催化性α 亚基和调节性β、γ 亚基组成的异源三聚体蛋白,发生缺血、低糖、缺氧等损伤时,AMPK信号通路迅速被激活,补充细胞的ATP供应,是细胞的能量感受器,AMPK通路激活进一步正向调控参与细胞ATP 供应的其他信号通路,在维持肠道上皮细胞屏障功能中起重要作用[16-17]。mTOR 是AMPK 的下游信号分子,AMPK激活后可通过调控mTOR 的磷酸化水平抑制NFκB 炎性信号通路[18]。Yu 等[19]研究显示,臭氧可通过激活AMPK 通路抑制组织因子触发的肠缺血,修复小鼠肠黏膜损伤并有效改善化疗性肠炎。Ma等[20]研究显示,褪黑素通过激活AMPK 通路防止Th17/Treg 失衡而改善坏死性小肠结肠炎。本研究对放射性肠炎大鼠模型应用黄芪多糖、AMPK通路抑制剂复合物C干预后检测小肠黏膜组织AMPK通路相关蛋白表达水平,结果显示,复合物C 下调p-AMPK 表达,上调p-mTOR 表达,抑制了AMPK信号通路的激活,黄芪多糖则呈现相反的作用效果,黄芪多糖、复合物C同时干预后,复合物C对AMPK通路的抑制作用被逆转,提示黄芪多糖可通过调控AMPK 通路修复放射性肠炎大鼠的肠黏膜损伤。
综上所述,黄芪多糖对放射性肠炎大鼠肠黏膜损伤有明显的修复作用,可能与调控AMPK 信号通路相关蛋白的表达有关。本研究结果可为黄芪多糖相关药物的研发及应用于放射性肠炎的临床治疗提供基础数据。
