福建大头蛙抗癌多肽FJ-2945抗肿瘤活性研究
2022-07-13林婷婷廖伟坚林平发潘雪丰
林婷婷,廖伟坚,林平发,潘雪丰
(福建卫生职业技术学院药学院,福建 福州 350101)
0 引言
恶性肿瘤是威胁人类健康的疾病之一,在全球范围内的发生率和死亡率呈逐年上升的趋势[1]. 其中,肝细胞癌(hepatocellular carcinoma,HCC)是临床中最常见的肝脏恶性肿瘤亚型,导致HCC发病的主要因素有酗酒、乙肝病毒感染以及代谢性疾病等[2]. 我国每年新增的HCC患者约占全球每年新增病例的50%,属于我国高发性肿瘤[3],给我国公共卫生系统带来巨大威胁. 对于进展期HCC患者,临床上通常可采用手术切除病灶、肝移植、射频消融及经导管肝动脉化疗栓塞等治疗方案. 然而早期HCC没有特征性临床表现,难以被及时诊断并进行治疗,多数患者初诊即为中晚期肿瘤并伴随癌细胞转移. 针对这类患者,分子靶向药物例如酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)能取得一定的治疗效果,但长期使用一、二代TKIs依然伴随着获得性耐药等问题[4-5],阻碍了HCC的治疗效果. 因此探索疗效显著且毒副作用小的抗肿瘤药物,是改善肝细胞癌患者生活质量、延长生存期的必然要求.
多肽通常由10~100个氨基酸分子脱水缩合,其广泛存在于动植物、真菌及细菌等生物体内. 在无尾两栖类的皮肤分泌液中发现多种具有抗肿瘤活性的多肽,其均具有正电性、疏水性和两亲性等特性, 可与带有阴离子的肿瘤细胞膜产生选择性[6]. 同时,生物活性肽具有抑制细胞增殖、抗微管蛋白聚合、细胞毒性等功能,呈现出抗癌潜能[7]. 国内外学者已从两栖类动物的皮肤分泌物中分离获得数百种生物活性分子,也陆续发现了一系列具有抗肿瘤活性的多肽. 研究发现,蟾蜍皮肤提取液中的Bufadienolides、多肽和生物碱,具有抗癌的药理活性[8],印度蟾蜍皮肤水提液中细胞毒蛋白(BMP1)对癌细胞具有抑制增殖和凋亡的活性[9],一些具有抗菌活性的天然肽(magainin II,蛙皮素II)也具有杀瘤的作用[10],福建大头蛙皮肤分泌物中提取的抗菌多肽 LFB 同时具有抗癌的活性[11]. 临床上使用的华蟾素注射液在治疗原发性肝癌、中晚期肺癌等恶性肿瘤中取得良好的疗效,也证实了蛙类分泌物可作为潜在治疗癌症的新药物来源[12].
本课题对福建本土自然资源福建大头蛙(Limnonectesfujianensis)皮肤分泌物中含有的多肽进行分离分析,从中发现多肽FJ-2945具有抑制肝癌细胞增殖、迁移和促进细胞凋亡的作用,通过系统研究其体外的抗肿瘤活性,初步探讨其抗肿瘤作用机制,为抗肿瘤多肽FJ-2945的临床前研究提供理论基础以及实验依据.
1 材料与方法
1.1 材料
Hep3b购自上海细胞生物研究所; DMEM培养基购自上海HyClone公司; FBS购自郑州博赛生物技术股份有限公司; RNA提取试剂盒,逆转录试剂盒购自诺唯赞生物技术有限公司; 引物序列由上海生工公司合成; CCK8试剂盒、RIPA裂解液、PMSF蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液、分子量标准彩色预染蛋白(15~120 ku)等购自碧云天生物技术有限公司; Skp2、p21、p27、E-cadherin和N-cadherin蛋白抗体购自上海Cell Signaling Technology公司; cyclin A2与二抗购自上海Santa Cruz公司.
1.2 方法
1.2.1蛙皮多肽序列与cDNA序列鉴定
蒸馏水冲洗蛙皮,釆用电刺激法(10 V,20 Hz)点式刺激背部,待产生白色沫状物质即用去离子水冲洗分泌物,并将所得分泌物溶液高速离心后冷冻干燥,保存于-20 ℃冰箱备用. 将5 mg冻干的福建大头蛙蛙皮分泌物重新溶解后离心收集上清液,通过 RP-HPLC对蛙皮中的组分以1 mL·min-1的流速进行总计240 min的梯度洗脱. 初始流动相为TFA/H2O (0.05/99.95, 体积比),终止流动相为TFA/ACN/H2O (0.05/80/19.95, 体积比). 洗脱过程中持续监测柱流出物在λ=214 nm 处的吸收峰,并使用自动收集馏分收集洗脱组分. 洗脱组分使用 LCQ-Fleet电喷雾离子阱质谱仪通过 MS/MS碎片测序确定洗脱组分中FJ-2945的氨基酸序列. 根据上述步骤得到的FJ-2945的氨基酸序列设计简并引物,通过5‘-RACE 和3’-RACE法得到包含完整阅读框的编码相应活性多肽的 cDNA 序列,通过与在线多肽数据库(NCBI-Blast)对比确认FJ-2945成熟肽序列后,最后委托上海生工公司通过固相蛋白质合成系统合成FJ-2945,合成多肽纯度达98%以上,置于-20 ℃保存并用于后续功能试验研究,临用前用细胞培养基配制成所需浓度.
1.2.2细胞培养
将Hep3b细胞培养在完全培养基DMEM (10%FBS+1%P/S,体积分数)中,置于37 ℃、5% (体积分数)CO2细胞培养箱中进行常规传代培养.
1.2.3CCK8实验
将对数生长期的Hep3b细胞消化离心后稀释至8 000个/孔的密度接种到96孔板中,置于孵箱中培养12 h 后,待细胞贴壁后,在实验组中加入不同终浓度(1、10、100 nmol·L-1和1、10、20、40、80、160 μmol·L-1)的多肽FJ-2945,每组设5个复孔,继续培养24 h,随后每孔加入10 μL的 CCK8试剂,继续孵育2 h后在450 nm处测定吸光度并计算相对抑制率.
1.2.4RTCA技术
将对数生长期的Hep3b细胞消化离心后稀释至3 000个/孔的密度接种至实时无标记细胞分析仪检测盘(E-Plate)中,连续监测76 h,每1 h记录一次. 种盘12 h后,取出E-Plate,实验组加入100 μL终浓度为1、2 μmol·L-1FJ-2945的培养基,对照组加入等体积含有PBS的培养基并继续培养至监测结束,试验结束后,记录实时传输数据并绘制细胞生长情况.
1.2.5WoundHealing划痕实验
将 Hep3b细胞以90%密度接种于6孔板中,待细胞充分贴壁后,用10 μL枪头垂直于皿底制造划痕,每制造一条划痕换一次枪头,随后用 PBS洗3次,实验组加入100 μL终浓度为1 μmol·L-1FJ-2945的培养基,对照组加入等体积含有PBS的培养基,置于恒温孵箱培养24 h,分别在孵育0、12、24 h显微镜下拍照记录划痕的愈合情况.
1.2.6Transwell实验
将Hep3b细胞用无血清培养液处理24 h后,实验组加入100 μL终浓度为1 μmol·L-1FJ-2945的培养基,对照组加入等体积含有PBS的培养基,继续培养24 h,消化离心,无血清培养基重悬细胞,按4×105个/孔的密度接种于小室中,下室加入500 μL含10%(体积分数)FBS的培养基,置于恒温孵箱中培养24 h,取出小室清洁并加入1 mL 4%(体积分数)多聚甲醛固定15 min,弃固定液,倒置风干后,PBS洗3次,0.1%(体积分数)结晶紫染色15 min,弃染色液,PBS洗3次,显微镜观察拍照,随机选取3个细胞均匀穿膜的视野统计并比较对照组与实验组的穿膜细胞数量.
1.2.7细胞周期检测
将对数生长期的Hep3b细胞以50%~60%的密度接种至6 cm培养皿中,贴壁培养后,实验组加入100 μL终浓度为1、2 μmol·L-1FJ-2945的培养基,对照组加入等体积含有PBS的培养基继续培养24 h,胰酶消化离心后,PBS 清洗2次,随后加入预冷的70%(体积分数)乙醇固定过夜,离心弃去上清液,PBS清洗1次,加入PI/RNase染色缓冲液室温避光染色30 min,随后流式细胞仪检测细胞荧光,观察细胞周期分布.
1.2.8qRT-PCR实验
实验组加入100 μL终浓度为1、2 μmol·L-1FJ-2945的培养基,分别用实验组1、2表示; 对照组加入等体积含有PBS的培养基,培养24 h后,使用RNA提取试剂盒提取细胞总RNA,测定浓度后,进行逆转录反应获得cDNA,随后将cDNA 模板与Master Mix、待测基因的正向引物和反向引物混合的反应体系进行qRT-PCR反应,以检测目的基因mRNA表达情况的变化.
1.2.9WesternBlotting实验
实验组加入100 μL终浓度为1、2 μmol·L-1FJ-2945的培养基(实验组1、2),对照组加入等体积含有PBS的培养基,培养24 h后,消化并收集细胞,提取总蛋白,BCA 试剂盒测定蛋白浓度,采用上样缓冲液(5×)将样品稀释至20 μg·μL-1. 将等量的细胞蛋白通过SDS-PAGE凝胶分离并湿转至PVDF膜,用脱脂牛奶封闭 1 h,加入一抗(1∶3 000,体积比)4 ℃孵育过夜,TBST清洗残余一抗后,加入二抗室温孵育1 h,TBST洗涤,最后在PVDF膜上滴加发光液进行发光检测.
1.2.10统计学分析
使用GraphPad Prism 9.0软件进行统计学分析,计量资料用平均值±标准差(x±s)表示,组间均数比较采用t检验,P<0.05表示差异具有统计学意义.
2 实验结果与分析
2.1 FJ-2945的多肽序列与 cDNA 序列鉴定
图1(a)为RP-HPLC梯度洗脱结果曲线. LCQ-MS/MS 鉴定#121洗脱峰中含有相对分子质量为2 945的多肽组分,通过在线多肽序列分析工具预测得到的的FJ-2945碎片化单电荷和双电荷 b-ion和片段的分子质量表,质谱中检测到的b-ion碎片用红色字体标记,而y-ion用蓝色标记,验证其多肽一级序列为TLKNLAKTAGKGALQSLLNHASCKLSGQC(见图1(b)). 测序得到FJ-2945的开放阅读框 cDNA(见图1(c)),与数据库(NCBI-Blast)对比确认FJ-2945成熟肽序列,说明蛙皮中存在编码FJ-2945的核苷酸序列,应用 SWISS-MODEL 多肽二级结构预测软件预测得到FJ-2945多肽具有两亲性的α螺旋二级结构(α-Helix)(见图1(d)). 根据文献报道,两亲性的α螺旋多肽常具有抗菌与抗肿瘤增殖作用[13].

图1 FJ-2945分离与结构鉴定Fig.1 Isolation and structure identification of FJ-2945
2.2 FJ-2945对Hep3b细胞生长与增殖的抑制作用
CCK8实验结果表明,多肽FJ-2945呈剂量依赖性的抑制Hep3b细胞的增殖过程,其半数抑制浓度(IC50)为(1.87±0.499)μmol·L-1(见图2(a)). 随后,通过RTCA技术同样验证多肽FJ-2945对Hep3b细胞的增殖呈剂量依赖性的抑制作用,在细胞培养76 h后,实验组中Hep3b细胞增殖速度显著低于对照组,接种2 μmol·L-1FJ-2945的实验组2细胞总量仅为对照组细胞的50%,实验组1细胞总量为对照组细胞的83%,表明FJ-2945对Hep3b细胞的生长增殖具有较强的抑制作用(见图2(b)).
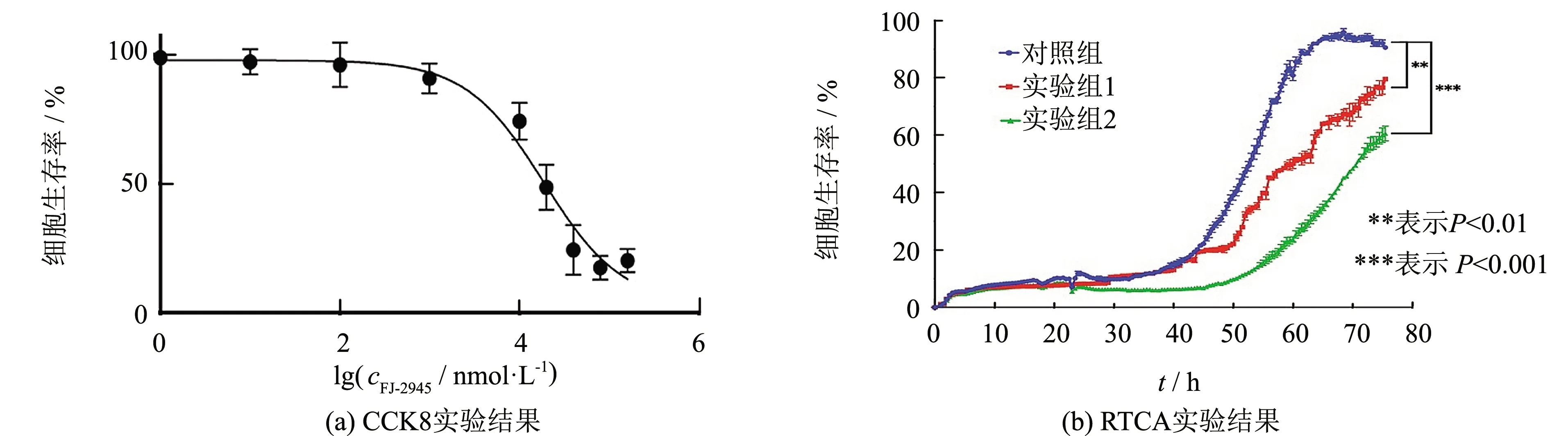
图2 FJ-2945对Hep3b细胞增殖的影响Fig.2 Effect of FJ-2945 on the proliferation of Hep3b cell
2.3 FJ-2945对Hep3b细胞周期分布的影响
流式细胞仪检测结果表明,实验组中Hep3b细胞呈现细胞周期G1/S期阻滞,并以2 μmol·L-1多肽FJ-2945 (实验组2)的作用更为显著(见图3(a~c)). 如图3(d)统计图中所示,经1、2 μmol·L-1多肽FJ-2945处理后,G0/G1期细胞数量提高至66.8%、70.9%,相比对照组60.7%有不同程度的提高. 此外,经过2 μmol·L-1FJ-2945处理后,处于sub-G1期的细胞数量由对照组中的5.12%提高到10.95%,说明FJ-2945可能同时诱导细胞凋亡.

图3 FJ-2945对Hep3b细胞周期的影响Fig.3 Effect of FJ-2945 on the cell cycle of Hep3b
2.4 FJ-2945对Hep3b细胞迁移的影响
划痕实验和Transwell实验检测多肽FJ-2945对Hep3b迁移能力的影响. 为避免因高浓度FJ-2945造成的细胞杀伤作用导致假阳性结果,选择1 μmol·L-1的FJ-2945处理细胞,分别在处理后0、12、24 h进行拍照记录. 结果如图4(a)所示,实验组中Hep3b细胞迁移速率明显低于对照组. 对照组在划伤24 h后划痕基本愈合,而实验组仍保留划痕,证实了多肽FJ-2945能明显抑制Hep3b细胞的迁移. Transwell结果如图4(b)所示,每个单独视野中实验组Hep3b细胞穿过至下室的细胞数量为(40±7)个,与对照组(83±4)个相比,差异具有统计学意义(***表示P<0.001),提示FJ-2945能抑制Hep3b细胞的迁移能力.

图4 FJ-2945对Hep3b细胞迁移能力的影响Fig.4 Effect of FJ-2945 on the cell migration of Hep3b
2.5 FJ-2945抗肿瘤机制研究
通过qRT-PCR检测细胞增殖、细胞周期相关因子E2F1、Skp2、CDK4、CCNA2、CDKN1B和细胞迁移相关因子Slug、Snail、E-cadherin、N-cadherin的变化,结果如图5(a)所示. 实验组中与细胞周期进展相关的基因如Skp2、E2F1、CCNA2、CDK4均没有发生显著变化,细胞迁移相关的基因Slug与Snail水平显著降低(*表示P<0.05, *** 表示P<0.001),CDKN1B、E-cadherin的mRNA水平显著上升(***表示P<0.001),说明多肽FJ-2945并非从转录水平上影响细胞周期相关因子,但是对细胞迁移调控因子E-cadherin、Slug与Snail则具有显著影响.
Western blotting实验结果如图5(b)所示,实验组中Skp2、Cyclin A蛋白的表达显著下降. 有研究报道细胞中Skp2含量降低会导致细胞增殖抑制并诱导细胞凋亡[14],或解释了FJ-2945的主要抗肿瘤分子靶标. 另一方面,实验组中Skp2靶蛋白p27含量则显著上升. 据文献报道,Skp2介导p27周期性的泛素-蛋白酶体降解,使p27释放Cyclin A 或Cyclin E/Cdk2复合物的抑制状态,从而允许细胞通过 G1/S 期[15]. 这些结果可能说明FJ-2945是通过降低 Skp2在肝癌细胞中的蛋白含量,从而抑制了由Skp2介导的下游靶蛋白p27泛素-蛋白酶体降解过程,该结果导致细胞周期蛋白p27在细胞中积累并抑制CDK-cyclin复合体,从而造成细胞周期G1/S 期阻滞[16]. 此外,实验组中细胞锚定蛋白E-cadherin表达量升高而促进细胞迁移的N-cadherin表达量降低, 则说明FJ-2945可能通过抑制癌细胞上皮间质转换(EMT)转变,从而降低肝癌细胞的迁移能力[17].

图5 FJ-2945抗肿瘤机制研究Fig.5 Anti-cancer mechanism study of FJ-2945
3 讨论
我国肝癌的发病率在恶性肿瘤中位居第四位,死亡率位居第二位,并且肝癌是所有肿瘤中预后最差的肿瘤[18]. 肝癌的诊治水平可以提高患者的生存率,除了传统化疗药物,加快研发新型的药物尤为重要. 国内外已发现蛙类皮肤腺分泌物中部分抗菌、抗肿瘤等生物活性成分[11, 19-20],且由于蛙皮活性多肽的相对分子质量小、特异性强、毒性小等特点一直被认为是极具潜力的新型抗肿瘤药物的研究对象,但其抗肿瘤的机制多样且尚未被彻底明确限制了其抗肿瘤的研究进展[21]. 福建大头蛙(Limnonectesfujianensis)属于福建省武夷山地区的两栖动物优势种,其皮肤腺体分泌物含有大量的多肽类活性物质,本课题组从福建大头蛙皮肤分泌物中分离并鉴定新型活性多肽FJ-2945的氨基酸与cDNA序列,并使用合成的FJ-2945多肽进行抗肿瘤活性与抗肿瘤机制研究.
本研究结果表明,多肽FJ-2945能够抑制Hep3b细胞的生长增殖、迁移与凋亡,表明多肽FJ-2945对肝癌细胞Hep3b抑制作用以及潜在的治疗价值. 在抗肿瘤机制方面,本研究明确了多肽FJ-2945通过降低细胞内Skp2蛋白含量造成p27蛋白在胞内累积,从而造成细胞周期的G1/S 期阻滞,最终抑制Hep3b细胞增殖. 根据文献报道,在细胞增殖过程中,Skp2通过降解p27促进细胞周期G1/S期转换,而在细胞迁移过程中,Skp2蛋白的高表达被认为与肿瘤增殖与迁移呈正相关,其机制主要与胞质Skp2诱导的细胞锚定蛋E-cadherin的过度降解有关[22-24]. 本实验抗肿瘤机制初步研究结果表明,多肽FJ-2945极有可能是通过影响细胞中Skp2的蛋白质表达,从而影响Skp2的下游因子如p27、E-cadherin等,最终抑制肝癌细胞的增殖与迁移能力.
综上所述,多肽FJ-2945具有显著的抑制Hep3b细胞增殖、迁移的作用,并诱导Hep3b细胞凋亡的抗肿瘤活性,但同时与其他多肽类物质一样也具有易水解、稳定性差与靶向性不强等缺点,因此需要在此基础上对多肽FJ-2945进行结构改造,以期进一步提升其稳定性与抗肿瘤活性,通过临床前实验更深入研究FJ-2945抗肿瘤作用机理,挖掘其临床应用的潜力.
