慢病毒介导的SPARC基因沉默对人瘢痕疙瘩成纤维细胞增殖调亡的影响
2022-07-13李心怡李小静朱晓璇丁以春
李 茜,李心怡,李小静,朱晓璇,丁以春
富含半胱氨酸的酸性分泌蛋白(secreted protien acidic and rich in cysteine,SPARC)是一种胶原结合蛋白,能够影响胶原细胞外基质的组装和转化生长因子-β1(transforming growth factor-β1, TGF-β1)的活性[1]。研究[2]表明,SPARC在多种纤维性病变组织中均呈现高表达。瘢痕疙瘩是一种病因不明的皮肤纤维过度增生性疾病,与肺、心脏纤维化等纤维性疾病具有相似的胶原细胞外基质组装和TGF-β活化过程。课题组先前的研究[3-4]表明病理性瘢痕中SPARC表达高于正常皮肤;经外源性SPARC处理的HKF显示出明显的增殖迹象,在兔耳瘢痕中注射SPARC,其成纤维细胞增殖和胶原沉积明显增加。先前研究表明SPARC与瘢痕疙瘩的形成具有相关性,但具体的作用机制仍不清楚。
该研究构建了SPARC慢病毒干扰载体感染HKF,观察沉默SPARC基因对瘢痕疙瘩成纤维细胞生物学特性的影响。同时,拟通过检测细胞中TGF-β1及其Ⅰ型受体(TβRⅠ)的蛋白表达情况,初步探讨形成这一影响的机制。
1 材料与方法
1.1 主要材料重组慢病毒LV2N-NC和LV2N-shRNA-SPARC干扰载体由上海吉玛基因生物技术有限公司合成并鉴定,在293 T细胞中进行包装及滴度测定。DMEM培养基、胎牛血清(美国Gibco公司),TRIzol试剂、逆转录试剂盒(日本TaKaRa公司),MTT试剂、AnnexinV-FITC/PI 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),兔抗人TGF-β1、 TGF-β ReceptorⅠ抗体、重组人SPARC蛋白(美国R&D公司)。5例组织标本来自安徽医科大学第一附属医院整形外科,手术切除的典型瘢痕疙瘩(其中耳垂3例,肩部2例),取材标本术前均未接受药物及其他治疗且均获得本人或其监护人同意。
1.2 方法
1.2.1细胞培养 将瘢痕疙瘩标本剪去表皮和皮下组织,切成2~3 mm3的组织块,采用组织块贴壁法进行瘢痕疙瘩成纤维细胞的原代培养,以含20%胎牛血清、双抗(青霉素100 U/ml+链霉素100 U/ml)的高糖DMEM培养基,于37 ℃,5% CO2饱和湿度培养箱中培养。
1.2.2慢病毒感染HKF细胞和分组 取对数生长期的 HKF细胞以胰酶消化,计数后以 1×105个/孔接种到 6 孔板中,将细胞分为3组:其中未做任何处理的HKF细胞为空白对照组,转染空载质粒的 HKF细胞为 sh-NC 组,转染 SPARC shRNA 重组慢病毒载体质粒的HKF 细胞为 sh-SPARC 组。转染过程严格参照慢病毒转染手册,转染后筛选并收集稳定转染的HKF细胞。
1.2.3qRT-PCR检测SPARC基因表达 提取HKF细胞中总 RNA,逆转录得cDNA。以GAPDH为内源性参照,以SYBR Green染料法利用qRT-PCR检测系统,进行PCR 扩增。用2-ΔΔCt法计算SPARC mRNA的相对表达量。SPARC上游引物序列为5′-TGAGGTATCTGTGGGAGCTAATC-3′,下游引物序列为5′-CCTTGCCGTGTTTGCAGTG-3′,产物长度128 bp ;GAPDH 上游引物序列5′-AATCCCATCACCATCTTC-3′,下游引物序列5′-AGGCTGTTGTCATACTTC-3′,产物长度218 bp。
1.2.4Western blot检测SPARC蛋白的表达 提取各组细胞总蛋白,BCA法进行蛋白定量。制备好的蛋白样品经SDS-PAGE凝胶电泳后,转移至PVDF膜上,5%脱脂奶粉室温封闭1.5 h后,加入1 ∶1 000稀释的SPARC抗体4 ℃孵育过夜,TBST洗膜后加二抗室温孵育2 h,再次洗膜后进行ECL显色。
1.2.5MTT法检测细胞增殖 取对数生长期的各组细胞,以3 000/孔接种于96孔板,分别培养24、48、72、96 h后于每孔加入 20 μl MTT溶液,37 ℃体积分数5 % CO2培养箱孵育4 h后弃上清液。在避光操作下每孔加入150 μl二甲基亚砜,摇床混匀10 min,酶标仪检测490 nm波长各孔吸光度OD值。每组5个复孔。实验独立重复 3 次。
1.2.6流式细胞术检测细胞周期及细胞凋亡 转染后的各组HKF细胞以胰酶消化,离心收集细胞,调整细胞悬液密度为 1×106/ml,加入预冷的 70 % 的乙醇4 ℃固定24 h,离心弃上清液,PBS洗涤细胞2次。加入配置好的碘化丙啶(PI)染色液,37 ℃避光温浴30 min后用流式细胞仪检测细胞周期比例。另取5×104~1×105个重悬的细胞,离心沉淀后加入 195 μl 结合缓冲液重悬细胞,然后加入5 μl Annexin V-FITC 和10 μl PI,混匀后避光室温孵育 20 min,随后立即上流式细胞仪检测细胞凋亡情况。
1.2.7Western blot检测TGF-β1及TβRⅠ蛋白的表达 分别收集人瘢痕疙瘩成纤维细胞空白对照组,sh-NC组和sh-SPARC组细胞,提取细胞总蛋白并进行蛋白定量。制备好的蛋白样品经SDS-PAGE凝胶电泳后,转移至PVDF膜上,5%脱脂奶粉室温封闭1.5 h后,加入1 ∶1 000稀释的TGF-β1及TGF-β Receptor Ⅰ 抗体4 ℃孵育过夜,TBST洗膜后加入相应二抗,室温孵育2 h,再次洗膜后进行 ECL 显色,以GAPDH为内参。

2 结果
2.1 重组慢病毒感染人瘢痕疙瘩成纤维细胞后SPARC mRNA和蛋白的表达sh-SPARC 组HKF细胞中SPARC mRNA的相对表达水平均明显低于空白对照组和 sh-NC 组(n=3,F=45.56,P=0.000 2),见图1;空白对照组和 sh-NC组之间SPARC mRNA相比,差异无统计学意义(P>0.05);Western blot检测也得到了相同结果,SPARC基因在蛋白水平的变化与其在mRNA水平表达变化一致。见图2。

图1 3组细胞中SPARC mRNA相对表达水平比较与空白对照组比较:***P<0.001

图2 3组细胞中SPARC蛋白的表达
2.2 SPARC对HKF细胞增殖的影响对各组细胞分别培养24、48、72、96 h后观察,可见转染SPARC干扰载体的人瘢痕疙瘩成纤维细胞,其增殖效应较空白对照组有所减缓(n=5,F=8.47,P=0.010 6),空白对照组和 sh-NC组比较,在490 nm吸光度OD值差异无统计学意义(P>0.05)。见图3。

图3 MTT 法检测人瘢痕疙瘩成纤维细胞增殖结果与空白对照组比较:*P<0.05
2.3 SPARC对HKF细胞周期的影响流式细胞术检测结果显示,sh-SPARC组的HKF细胞进入S期的比例有所减少(n=3,F=105.00,P<0.05),G0/G1期细胞百分比高于空白对照组与sh-NC组(n=3,F=40.45,P=0.000 3),空白对照组与sh-NC 组各时期细胞百分比比较差异均无统计学意义(均P>0.05)。见表1。
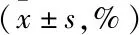
表1 流式细胞仪分析人瘢痕疙瘩成纤维细胞周期结果
2.4 SPARC对HKF细胞凋亡的影响sh-SPARC组HKF细胞凋亡率高于空白对照组和 sh-NC 组,(n=3,F=171.08,P<0.05);空白对照组和 sh-NC 组HKF细胞凋亡率比较差异无统计学意义(P>0.05),见图4。

图4 流式细胞仪分析HKF凋亡率
2.5 SPARC对HKF细胞中TGF-β1及TβRⅠ蛋白表达的影响Western blot的检测结果显示sh-SPARC组HKF细胞中 TGF-β1及TβRⅠ蛋白的表达较空白对照组和sh-NC组降低,空白对照组和 sh-NC 组间差异无统计学意义。见图5。
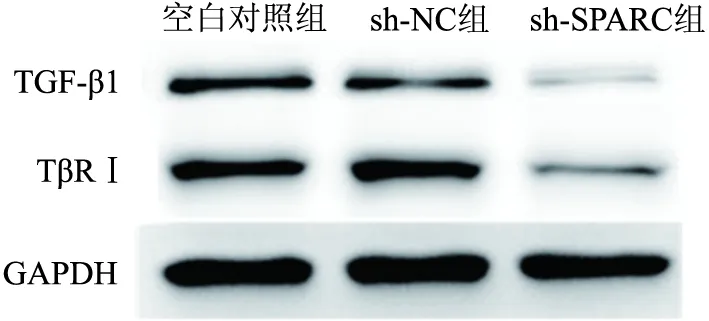
图5 3组 HKF中TGF-β1及TβRⅠWestern blot结果
3 讨论
瘢痕疙瘩是易感个体的正常伤口愈合紊乱的结果,其病变明显超出受损区域边界,向周围正常皮肤呈浸润性生长,且这种异常增长持续存在[5]。该病严重影响患者的生活质量,若长在关节部位还有可能对运动功能产生影响。复杂多样的疾病成因和巨大的个体差异使得瘢痕疙瘩的防治在临床中依然难以攻克。
SPARC是一种基质细胞糖蛋白,它可以通过与细胞外基质结构成分和生长因子的结合来调节细胞间的相互作用[6]。SPARC已被证实和多种纤维化疾病相关[7]。瘢痕疙瘩实质是皮肤的纤维过度增生性疾病,先前的研究[3]在细胞和组织水平初步比较SPARC在正常皮肤、增生性瘢痕和瘢痕疙瘩中的表达情况,结果显示,SPARC 在瘢痕疙瘩成纤维细胞中的表达水平高于正常皮肤;经体外培养的瘢痕疙瘩及正常皮肤成纤维细胞与重组人SPARC蛋白共培养后,其成纤维细胞的增殖加快,且TGF-β1的蛋白表达较对照组增加,并且浓度越高这种效应也越显著[4],提示SPARC基因的激活或过表达可能是瘢痕疙瘩形成的重要因素,但其具体的作用机制尚不明确。
TGF-β是目前已知与瘢痕形成关系最密切的促纤维化细胞因子之一[8],其中 TGF-β1最为关键[9]。TGF-β1及其受体在瘢痕疙瘩组织和成纤维细胞中高度表达,同时与正常皮肤成纤维细胞相比,瘢痕疙瘩成纤维细胞对TGF-β1更为敏感,高表达的TGF-β1通过刺激成纤维细胞增殖并促进其合成胶原蛋白、纤连蛋白等细胞外基质成分,同时诱导蛋白酶抑制剂如纤溶酶原激活物抑制剂-1(PAI-1)和金属蛋白酶组织抑制剂1(TIMP1)的表达,抑制细胞外基质的降解,导致细胞外基质的合成与降解失衡,使得以胶原为主细胞外基质在真皮内过度沉积,最终导致瘢痕疙瘩的形成[10-11]。有研究[12-13]表明SPARC通过TGF-β受体及Smad2/3依赖通路刺激TGF-β信号系统是与SSc患者纤维化相关的一个重要机制;将SPARC添加到SPARC缺失的系膜细胞中可诱导TGF-β1的产生[14];在人正常皮肤成纤维细胞中用小干扰RNA (siRNA)特异性抑制SPARC基因能够降低 I 型胶原的表达,减少细胞外基质沉积,并减弱 TGF-β1 的促纤维化作用[15]。
该研究推测在瘢痕疙瘩的形成过程中,SPARC 同样通过 TGF-β1/Smads信号通路发挥作用,为了验证这一猜想,并确定能否通过沉默SPARC基因来抑制瘢痕疙瘩中成纤维细胞的过度增殖,该研究设计构建了SPARC基因慢病毒干扰载体并感染至人瘢痕疙瘩成纤维细胞,成功下调了成纤维细胞中SPARC mRNA和蛋白的表达,并通过MTT法和流式细胞术检测瘢痕疙瘩成纤维细胞增殖、凋亡以及细胞周期的变化,结果显示SPARC基因的低表达可以明显调低成纤维细胞的增殖速度,阻滞细胞周期进程并增加瘢痕疙瘩成纤维细胞的凋亡率。同时运用Western blot实验方法检测在细胞增殖过程中,与SPARC蛋白以及瘢痕组织均具有相关性作用的 TGF-β1及其受体的量效关系,寻找 SPARC 蛋白影响瘢痕组织形成发展的特定关系。结果显示SPARC基因干扰组成纤维细胞中的TGF-β1及TGF-β Ⅰ型受体的水平都有所降低,提示SPARC在瘢痕疙瘩形成过程中可能是通过TGF-β1信号系统发挥作用,但对其下游信号分子的影响还有待深入研究。
