HBV通过下调PTEN的表达拮抗IFN-α抗病毒活性
2022-07-13樊星语胡冰琪黄俊峰刘欢欢陈礼文
樊星语,胡冰琪,黄俊峰,杨 英,刘欢欢,张 浩,王 琴,周 强,陈礼文
乙型肝炎病毒(hepatitis B virus,HBV)感染是重要的公共健康问题,感染人体后表现为急、慢性乙型肝炎,肝硬化和肝细胞癌等[1]。尽管可使用有效的疫苗预防,但在全球范围内尚未成功根除 HBV。PTEN是重要的抑癌基因,在人类很多癌症(如肺癌、卵巢癌、甲状腺癌、肝癌等)中发生突变或缺失,几乎一半的肝癌患者存在PTEN基因的缺失[2]。有研究[1]显示,PTEN的磷酸酶活性正向调节干扰素调节因子3(IRF3)进入细胞核,发挥促进先天免疫反应作用,且此结果在HBV感染的细胞中得到了验证。但HBV感染后IFN-α介导的JAK/STAT信号通路与PTEN间的关系尚未完全清楚。该研究旨在分析HBV感染后PTEN下调所致的IFN-α的抗病毒活性变化机制,为研究抗HBV感染提供线索。
1 材料与方法
1.1 试剂与仪器HepG2细胞、HepG2.2.15细胞、HBV1.3质粒、空白载体(pcDNA3.1)由安徽医科大学第二附属医院检验科留存;PTEN-OE质粒、RNA抽提试剂(TRIzol)、引物序列购自上海生工生物公司;DMEM、0.25%胰蛋白酶购自美国Gibco公司;胎牛血清(FBS)、遗传霉素G418、双抗(×100青-链霉素溶液)、PBS购自美国 HyClone公司;BCA蛋白浓度检测试剂盒购自上海碧云天生物公司;抗PTEN、IRF9、MxA等抗体购自英国Abcam公司;抗GAPDH、山羊抗兔/鼠IgG抗体购自美国Affinity公司;LipofectamineTM3000 转染试剂购自美国 Invitrogen 公司;poly(I ∶C)购自美国GLPBIO公司;ECL底物发光试剂盒购自美国Pierce公司;RNA反转录试剂盒、荧光染料SYBR购自美国Thermo Fisher Scientific公司。
1.2 方法
1.2.1细胞培养和转染 HepG2、HepG2.215细胞采用含10%FBS、1%双抗的DMEM培养,其中HepG2.2.15 细胞的每100 ml培养基中加入320 ng遗传霉素G418,培养条件为37 ℃ 、5%CO2,待细胞生长至 90% 融合时,用胰蛋白酶消化1~2 min,1 ∶3传代培养。待细胞至对数生长期,将胰蛋白酶消化的细胞均匀铺至细胞培养板,待细胞融合至70%~80%时使用新鲜培养基换液后进行转染。按照 LipofectamineTM3000试剂使用说明转染细胞,48 h 后收集细胞用于化学发光技术、qRT-PCR、Western blot检测。
1.2.2poly(I ∶C)处理细胞 HepG2.2.15细胞转染PTEN-OE/pcDNA3.1 质粒36 h后使用新鲜培养基换液,以LipofectamineTM3000转染试剂向细胞中转染适量poly(I ∶C),12 h后收集细胞上清液和胞内RNA、蛋白用于化学放光法、qRT-PCR和Western blot检测。
1.2.3HBV相关指标定量检测 向HepG2.2.15细胞中转染PTEN-OE和pcDNA3.1质粒,48 h后收集细胞培养上清液,细胞上清液中乙肝表面抗原(HBsAg)、乙肝e抗原(HBeAg)指标由雅培全自动化学发光分析仪 i4000 SR检测。
1.2.4qRT-PCR实验 采用TRIzol法提取细胞总RNA进行逆转录得到cDNA,qRT-PCR 检测IFN-α、HBV pgRNA 的表达水平,GAPDH作为内参。引物列表见表1,反应条件:95 ℃预变性2 min,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸1 min。

表1 引物序列
1.2.5Western blot实验 用PBS冲洗后各孔加含PMSF(体积比1 ∶100)的RIPA裂解液,冰上裂解30 min后刮取细胞至EP管,离心(15 000 r/min、30 min,4 ℃)后收集上清液并使用BCA法进行蛋白定量,加入×5蛋白上样缓冲液,沸水中煮10 min后冷却。使用SDS-PAGE (10%分离胶+5%浓缩胶)电泳分离蛋白质, 蛋白信息转至PVDF膜后使用含5%脱脂牛奶的TBST溶液封闭2 h,TBST洗膜3次后加入一抗(抗-IRF-9抗体:1 ∶2 000;抗-MxA抗体:1 ∶1 000;抗-PTEN抗体:1 ∶1 000;抗-GAPDH抗体:1 ∶5 000)中4 ℃振荡孵育过夜。根据一抗来源室温孵育二抗(山羊抗兔/鼠 IgG抗体:1 ∶5 000)1~2 h,ECL两种试剂1 ∶1混匀后均匀滴加在膜上,使用ECL仪曝光显色,以GAPDH作为内参。

2 结果
2.1 HBV感染对PTEN蛋白表达的影响HepG2细胞同时转染HBV1.3和pcDNA3.1质粒,48 h后提取蛋白,Western blot检测PTEN蛋白的表达。结果显示,瞬时转染HBV的HepG2中,PTEN蛋白的表达较对照组降低(图1A);与HepG2细胞相比,稳定表达HBV1.3基因组的HepG2.2.15细胞中PTEN蛋白的表达降低(图1B)。因此,在HBV瞬时转染和稳定转染的肝癌细胞中,PTEN蛋白表达均下调。
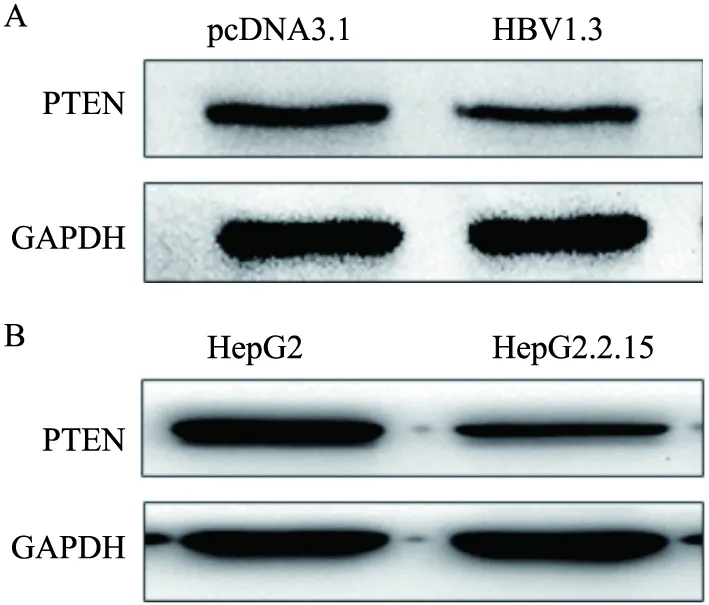
图1 Western blot检测瞬时转染和稳定转染HBV的细胞中PTEN蛋白的表达
2.2 PTEN对HBV表达的影响实验结果显示,与pcDNA3.1组相比,PTEN-OE组HBsAg、HBeAg表达降低(图2),差异有统计学意义(F=83.351,P<0.05;F=396.415,P<0.05);PTEN-OE组pgRNA表达降低(图3),差异有统计学意义(F=643.375,P<0.05),提示PTEN下调HBV相关抗原及pgRNA的表达。
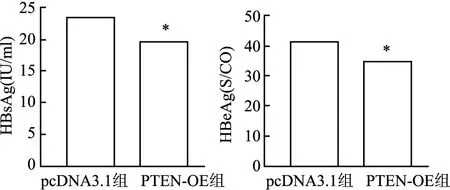
图2 化学发光法检测HepG 2.2.15细胞转染后HBsAg、HBeAg的表达与空白载体pcDNA3.1组比较:*P<0.05

图3 qRT-PCR检测HepG2.2.15细胞转染后HBV pgRNA的表达
2.3 PTEN对IFN-α表达的影响向HepG2.2.15细胞转染pcDNA3.1和PTEN-OE,处理36 h后转染poly(I ∶C)将实验分为4组:pcDNA3.1组、pcDNA3.1+ poly(I ∶C)组、PTEN-OE组、PTEN-OE + poly(I ∶C)组。提取细胞内RNA,qRT-PCR 技术检测细胞中IFN-α mRNA的表达结果显示,PTEN-OE和pcDNA3.1组IFN-α没有明显差异,PTEN+poly(I ∶C)刺激组IFN-α表达水平高于pcDNA3.1+poly (I ∶C)刺激组(图4),差异有统计学意义(F=171.549,P<0.05)
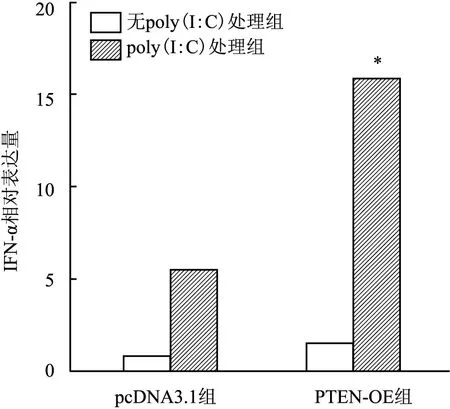
图4 qRT-PCR检测HepG 2.2.15细胞转染和poly(I ∶C)刺激后IFN-α mRNA的表达与无poly(I ∶C)处理组比较:*P<0.05
2.4 PTEN对MxA、IRF-9蛋白表达的影响Western blot检测各组细胞中MxA、IRF-9蛋白表达结果显示,与pcDNA3.1组相比,PTEN-OE的HepG2.2.15细胞中IRF9、MxA蛋白表达增加,两组均使用poly (I ∶C)诱导后,PTEN-OE组IRF9、MxA蛋白表达水平较空白组明显上升(图5)。

图5 Western blot检测HepG 2.2.15细胞转染和poly(I ∶C)刺激后IRF9、MxA蛋白的表达
3 讨论
HBV是一种通过血液或人体分泌物传播的DNA病毒,进入宿主细胞后,通过HBV pgRNA的复制,产生松弛的环状DNA,最终在核内转化为共价闭合DNA(cccDNA),利用不同启动子,转录4种mRNA、编码9种病毒蛋白(HBsAg、 HBeAg、 HBcAg、RT等)并逆转录出HBV DNA[3]。慢性乙型病毒性肝炎(CHB)是HBV侵犯肝脏所致的感染,全世界有超过 2.57 亿慢性感染者,约20% 的 CHB 感染者死于肝硬化、肝功能衰竭或肝细胞癌 (HCC) 的并发症,且HBV感染与急慢性肝炎、肝硬化和HCC患者的预期寿命直接相关[4]。尽管接种疫苗可以有效预防感染, 但目前的治疗方法只能控制和抑制病毒而不能治愈[5],HBV感染仍然是全球主要的健康问题之一。
PTEN全长200 KB,于1997 年由两个研究小组在研究染色体位置 10q23 时发现,在脑、前列腺和膀胱肿瘤中显示出频繁的缺失[6]。PTEN的主要功能是作为磷酸肌醇磷酸酶,通过负调节PI3K/AKT信号通路调节转录、翻译、细胞周期进程、诱导细胞死亡、刺激血管生成和干细胞自我更新发挥其抑癌作用[7]。多项研究[8-9]表明,PTEN在HCC表达中降低,并且与肿瘤等级、大小和肿瘤标志物表达相关。除了抑癌作用外,PTEN还调节由病毒感染激活的先天免疫应答。有研究[10]表明,在仙台病毒(SeV)、水泡性口炎病毒(VSV)或poly(I ∶C)的刺激下,PTEN在体内参与诱导I型干扰素(IFN-α、IFN-β)的产生,在Ser97位点诱导IRF-3去磷酸化并促进其转移进入细胞核。目前,IFN-α和核苷类似物是主要用于治疗CHB的药物[11]。HBV感染后,宿主细胞释放IFN,所有类型的IFN(IFN Ⅰ、Ⅱ和Ⅲ)与相应受体结合激活JAK/STAT信号通路,导致STAT1和STAT2的二聚化与IRF9结合形成了干扰素刺激基因因子3(ISGF3)复合物,该复合物转位至细胞核并与干扰素刺激反应元件(ISRE)结合以促进干扰素刺激基因(ISG)的转录, 诱导细胞产生抗病毒蛋白(如MxA)的表达[12]。
该研究表明,在瞬时转染和稳定表达HBV的肝癌细胞内,PTEN蛋白水平均下调,表明HBV感染与PTEN的表达存在一定相关性。为进一步探究PTEN的表达对HBV表达的影响,以PTEN-OE转染稳定表达HBV的HepG2.2.15细胞,研究表明HBV相关抗原(HBsAg、HBeAg)和HBV pgRNA表达水平下调,HBsAg是乙肝病毒外壳部分含表面抗原,标志HBV的感染,HBeAg、HBV pgRNA是提示HBV病毒复制的指标,这些结果共同表明PTEN可能参与下调HBV感染后的病毒复制,与Kim et al[9]的研究结果一致。Poly(I ∶C)是一种病毒双链RNA类似物,可在体外诱导IFN的表达,发挥抗病毒作用[13]。由于细胞本身分泌的内源性IFN-α含量较低,变化不易被观察到,通常采用外源poly(I ∶C)同时刺激细胞以放大所研究目的基因对IFN-α及其信号通路的作用效果。该研究表明,PTEN单独刺激细胞后,IFN-α水平较对照组未产生显著差异,实验组和对照组同时外加poly(I ∶C)刺激后,PTEN-OE组IFN-α水平较对照组显著上升,且PTEN-OE促进了HepG2.2.15细胞中JAK/STAT通路中IRF9、MxA蛋白的表达。由于PTEN作为抑癌基因,在癌细胞中低表达,故该实验只验证了癌细胞中过表达PTEN后的结果。通过以上结果可以推断,HBV感染可能通过下调PTEN水平发挥拮抗IFN-α介导的JAK/STAT信号通路的抗病毒作用。
