miR-34a在过敏性鼻炎小鼠中表达及治疗的作用研究
2022-07-13谢伟伟林秀联
谢伟伟,林秀联,龙 绮,孟 光,刘 硕
过敏性鼻炎属于鼻黏膜的变应性和炎症性疾病。其主要发病机制为患者暴露于变应原,从而介导IgE释放介质,激活多种免疫活性细胞释放细胞因子参与发病过程[1]。临床表现为鼻痒、鼻塞、打喷嚏和流清涕等,显著影响患者生活质量。然而目前尚不完全明确发病机制,药物治疗仅能缓解患者80%左右的症状。加之过敏性鼻炎极易复发,病情反复,给临床治疗带来一定障碍[2]。因此,深入探索过敏性鼻炎的特异性标志物及寻找可靠有效的治疗靶点显得极为重要。近年研究[3]显示微小RNA(microRNA,miR)参与了过敏性鼻炎发生发展过程。其中,miR-34是一类研究较多的miR分子,在多种炎性疾病发病中发挥重要作用,可促进炎症反应失衡[4-5],促炎因子表达上升,抑炎因子表达下调[6],但miR-34在过敏性鼻炎中表达罕见报道。因此,该研究旨在通过qRT-PCR检测过敏性鼻炎小鼠外周血miR-34a的表达水平,并采用miR-34抑制剂及阴性对照干预过敏性鼻炎小鼠,观察其对小鼠症状及炎症反应的影响。
1 材料与方法
1.1 材料40只5~6周龄的SPF级BALB/c 小鼠,雌雄各20只,体质量18~22 g;该研究中的动物实验得到武汉大学人民医院动物伦理委员会的批准。卵清蛋白(OVA)购自美国Sigma公司,ELISA试剂盒购自美国R&D公司,血浆/血清RNA纯化试剂盒(GenEluteTM Plasma/Serum RNA Purification Mini Kit)购自美国Sigma公司,两步法实时定量PCR试剂盒(QuantiTect Reverse Transcription Kit)购自美国Qiagen公司,miR-34a抑制剂购自广州锐博生物科技有限公司,NanoDrop 微量分光光度计购自美国Thermo Fisher Scientific公司,ABI 7500 qRT-PCR购自美国Applied BioSystems公司,流式细胞仪购自美国贝克曼库尔特公司,miR-34a和炎症因子的引物序列购自上海生工生物工程股份有限公司。
1.2 动物分组及模型制备选取10只作为空白对照组,余下30只BALB/c 小鼠进行建模,建模方法为:500 μg OVA溶于10 μl生理盐水配制成OVA溶液,腹腔注射隔天1次,连续7 次。第15 天开始激发实验,以5% OVA溶液双侧鼻腔点鼻,0.02 ml/侧,1 次/d,连续7次[7-8]。空白对照组注射等量生理盐水,模型组于激发实验结束15 min 内小鼠抓鼻次数明显增加,表明成功建立模型,将造模成功的30 只小鼠随机分为模型组、miR-34a抑制剂组及阴性对照组(NC组)。
1.3 干预方法miR-34a抑制剂组:造模结束后,小鼠尾部静脉注射100 μl miR-34a抑制剂载体混合溶液,均连续给药10 d;NC组在小鼠尾部静脉注射100 μl阴性转染质粒;模型组给予100 μl生理盐水。
1.4 小鼠临床症状评分干预结束后采用录像观察小鼠30 min的打喷嚏、挠鼻、鼻涕等症状。标准[9]中① 鼻痒,1 分:轻搔鼻 1~2 次;3分:剧烈抓挠鼻面不止;2 分:介于二者之间。② 喷嚏,1 分:1~3 个;2 分:4~10 个;3 分:11 个以上。③ 流涕,1 分:流至前鼻孔;2 分:超出前鼻孔;3 分:涕流满面,均采用叠加量化记分法。
1.5 血清IgE检测干预后于眼眶静脉取血2 ml。血样静置后离心,取上层血清ELISA检测IgE水平,严格按照试剂盒说明书操作进行。
1.6 血清总RNA的提取与qRT-PCR检测运用GenEluteTMPlasma/Serum RNA Purification Mini Kit提取各组小鼠的血清的总RNA。采用NanoDrop 微量分光光度计测定总RNA浓度,同时计算A260/A280比值,计算纯度;通过RNA琼脂糖凝胶电泳检测样品RNA完整性。采用QuantiTect Reverse Transcription Kit合成第一链互补cDNA,采用miScript SYBR GreenPCR Kit进行qRT-PCR检测。采用U6作为miR-34a的内参,采用GAPDH作为炎性因子的内参,最后通过2-△△Ct公式计算miR-34a 和炎症因子mRNA的相对表达量。引物序列见表1。

表1 引物序列
1.7 流式细胞仪检测CD3+、CD4+、CD8+T细胞表达干预结束后在无菌条件下于股静脉采集肝素静脉血2 ml。各流式管中加入50 μl全血,振荡混匀,避光静置15 min后加0.5 ml溶血剂避光静置10 min后加入250 μl PBS。1管加4色标记单克隆荧光抗CD45-FITC/CD3-PCS/CD4-RD1/CD8-ECD 5 μl,CD45+设门,分析CD3+、CD4+、CD8+T淋巴细胞表达率。
1.8 Western blot检测鼻黏膜组织中IL-2、IFN-γ表达各组小鼠鼻黏膜组织加入少量胰蛋白酶消化后,加入蛋白裂解液快速混匀,运转离心机后保留上清液,放置在75 ℃水浴10 min使蛋白变性后放入样孔中,每组取5 μg蛋白进行电泳实验。将蛋白转移到PVDF膜TBS浸泡10 min,反复PBS冲洗,5 min/次,加入1抗IL-2、IFN-γ抗体(1 ∶1 000)孵育过夜,后放入2抗辣根过氧化物酶标记羊抗兔IgG,(1 ∶1 000)杂交冲洗。浸入ECL工作液,检测、显色等步骤,成像系统对印迹条带的吸光度进行分析。β-actin 作为内参。

2 结果
2.1 各组小鼠症状评分比较与空白对照组相比,模型组评分增加(P<0.05),miR-34a抑制剂组则降低,仍高于空白对照组,但显著低于NC组(P<0.05),NC组与模型组差异无统计学意义(P>0.05)。见图1。
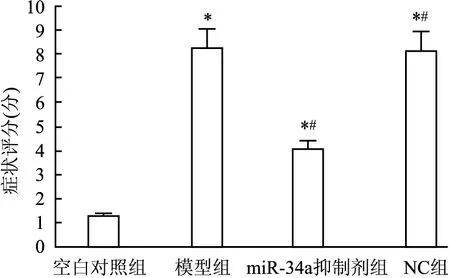
图1 各组小鼠症状评分比较
2.2 各组血清IgE水平与空白对照组相比,模型组血清IgE水平增加(P<0.05),miR-34a抑制剂组则降低,仍高于空白对照组,但低于NC组(P<0.05),NC组与模型组差异无统计学意义(P>0.05)。见图2。
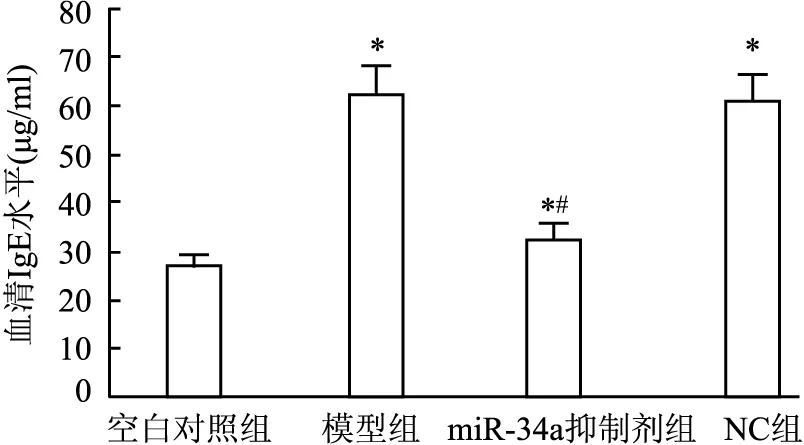
图2 各组血清IgE水平
2.3 各组炎症因子 mRNA表达情况与空白对照组相比,模型组IL-6、IL-8、IL-10、MMP-2、MMP-9及VCAM-1 mRNA增加(P<0.05),IL-35下降(P<0.05),与模型组相比,miR-34a抑制剂组IL-6、IL-8、IL-10、MMP-2、MMP-9及VCAM-1 mRNA下降,但miR-34a抑制剂组低于NC组(P<0.05),IL-35上升,但miR-34a抑制剂组高于NC组(P<0.05),NC组与模型组差异无统计学意义(P>0.05)。见表2。

表2 各组炎症因子 mRNA表达情况
2.4 各组小鼠CD3+、CD4+、CD8+T细胞表达与空白对照组相比,模型组CD3+、CD4+、CD4+/CD8+下降,与模型组相比,miR-34a抑制剂组CD3+、CD4+、CD4+/CD8+增加,但miR-34a抑制剂组高于NC组(P<0.05),NC组与模型组无差异(P>0.05)。见表3及图3、4。
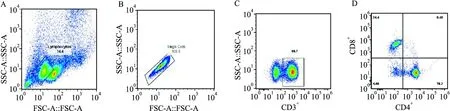
图3 流式细胞仪检测圈门策略 ×20A、B:圈门策略图;C、D:CD3+、CD4+、CD8+表达情况
表3 各组小鼠CD3+、CD4+、CD8+T细胞表达
2.5 Western blot检测各组小鼠鼻黏膜组织中IL-2、IFN-γ表达与空白对照组相比,模型组IL-2、IFN-γ水平下降(P<0.05),与模型组相比,miR-34a抑制剂组IL-2、IFN-γ水平升高,miR-34a抑制剂组高于NC组(P<0.05),模型组与NC组比较差异有统计学意义(P<0.05)。见表4、图5。

图5 各组小鼠鼻黏膜组织中IL-2、IFN-γ表达

表4 各组小鼠血清中IL-2、IFN-γ水平
3 讨论
过敏性鼻炎是患者暴露于致敏原后导致的鼻黏膜慢性非感染性炎性疾病,主要由IgE介导释放组胺及免疫和细胞因子引起。过敏性鼻炎发病受到基因和环境等多重因素的影响,基因表达异常是主要病理机制[10],但其机制尚未完全阐明清楚,microRNAs是一类长度约19~23 nt的非编码RNA分子,但到近年来,其广泛的生物学调控功能才逐渐被揭示出来,可与靶基因mRNA碱基配对引导沉默复合体(RISC)降解mRNA或阻碍其翻译转录后的调控,参与多种细胞增殖、分化和凋亡等诸多生理过程[11]。
miR-34属于一类在哺乳动物中广泛分布的高度保守miRNA家族。miR-34a定于lp36.22,目前发现miR-34a在气道变应性疾病中发挥重要作用,

图4 各组流式细胞术检测结果代表图 ×20A:空白对照组; B:模型组; C:miR-34a抑制剂组; D:NC组;1:各组CD3+表达情况;2:各组CD4+、CD8+表达情况
Solbcrg et al[12]研究显示miR-34s(miR-34c-5p、miR-34b-5p)在哮喘患者的支气管上皮细胞中的表达显著下调。该研究采用 OVA 造模过敏性鼻炎小鼠,小鼠均表现出明显的挠鼻、喷嚏和流涕,叠加各项分数计算总分大于 5 分,说明造模成功。随后通过qRT-PCR检测小鼠外周血miR-34a的表达水平,结果显示,与空白对照组小鼠比较,模型组小鼠的miR-34a相对表达水平增加(P<0.05)。提示miR-34a可能参与过敏性鼻炎的病理过程,由于血清中都稳定存在大量特异性表达的microRNAs,外周血可重复快速获得,使得qRT-PCR检测结果更快获取到,技术成本较低,可操作性高,为了进一步探讨特异性 miR-34a对小鼠过敏性鼻炎的治疗作用,该研究采用特异性miR-34a抑制剂及任意序列的阴性对照物滴鼻干预小鼠过敏性鼻炎,首先评估对临床症状的改善情况,结果显示,miR-34a抑制剂治疗过敏性鼻炎组小鼠的临床症状评分显著下降,低于模型组,但仍高于空白对照组(P<0.05)。接下来笔者继续比较各组血清IgE水平,结果显示,模型组血清IgE水平增加(P<0.05),miR-34a抑制剂组则降低,但仍高于空白对照组(P<0.05),血清IgE 升高是过敏性疾病最有力的提示,过敏原刺激产生的IgE 与肥大细胞、嗜酸性粒细胞等表面相应受体结合,诱导过敏性炎症[13]。已经有研究[14]显示IL-4及IL-2在过敏性鼻炎中也起到关键性的作用,IFN-γ分泌的下调会增加过敏性疾病发病的可能,患严重哮喘的患者接触过敏原后常呈现出的IFN-γ下调。该研究表明抑制miR-34a表达可有效缓解变应性免疫反应,炎症反应是过敏性鼻炎发病的主要特征。该研究表明模型组小鼠促炎因子IL-6、IL-8、IL-10、MMP-2、MMP-9及VCAM-1 mRNA上调,抑炎因子IL-35下调,在注射miR-34a抑制剂后则逆转了促炎因子和抑炎因子的变化。IL-6和IL-10均为常见的促炎因子,参与免疫耐受维持作用,两者均在过敏性鼻炎患者中表达上调,参与炎性疾病进展。IL-35由IL-12a、EB病毒诱导基因3亚基构成, 具有免疫抑制/抑炎活性[15]。MMP-2和MMP-9属于MMP 家族,可促进炎症细胞向气道黏膜固有层浸润激活的炎症细胞通过表达释放MMP-2和MMP-9,形成正反馈,促进炎症反应。而I型血管细胞黏附蛋白(VCAM-1)与嗜酸性粒细胞表面受体结合从而黏附于血管壁,促进嗜酸性粒细胞的迁移,参与变态反应。该研究表明抑制miR-34a表达可抑制炎症反应,Tregs在变态反应性疾病的免疫调节中发挥十分重要的作用,机体发生炎症后,外周血中CD3+及CD4+降低,提示免疫功能下降,而在抑制miR-34a表达则可提升CD3+、CD4+、CD4+/CD8+表达率,表明抑制miR-34a后提高了小鼠免疫功能。
综上所述,miR-34a抑制剂有效缓解小鼠过敏性鼻炎的临床症状和炎症水平,提示miR-34a作为基因治疗小鼠过敏性鼻炎具有巨大潜力,但该研究尚未观察其安全性,今后研究中需进一步研究安全性。
