HIF-1α调控4-羟基他莫昔芬对乳腺癌MCF-7细胞敏感性的研究
2022-07-13陈宗跃张璟钰张敏琴樊双琴沈祥春
陈宗跃,张璟钰,张敏琴,樊双琴,沈祥春,陈 妍,张 玥
乳腺癌是女性最常见的恶性肿瘤,75%的恶性乳腺肿瘤患者呈现雌激素受体α(estrogen receptor-α,ERα)阳性[1]。他莫昔芬(tamoxifen, TAM)是原发性ERα阳性乳腺癌的核心治疗药物,临床数据显示约50%的反应性乳腺肿瘤因长期使用TAM而产生抗性并导致治疗失败[2]。低氧诱导因子1α(hypoxia induced factor 1α, HIF-1α)是细胞在低氧状态下稳定表达的核转录因子[3],其可调控多种耐药靶基因的表达从而致使肿瘤细胞的化疗耐药。目前已有研究[4]表明HIF-1α水平升高与多种恶性肿瘤耐药有关,但其与乳腺癌TAM耐药的关系目前尚不明确。因此,该研究采用TAM的活性代谢物4-羟基他莫昔芬(4-hydroxy tamoxifen,4-OHT)构建乳腺癌TAM耐药细胞模型,探讨HIF-1α与乳腺癌TAM耐药的关系,为攻克乳腺癌耐药问题寻找新的靶点。
1 材料与方法
1.1 细胞与试剂人乳腺癌细胞MCF-7购自中国科学院昆明细胞库;4-OHT购自美国Abcam公司;FG-4592及LW6均购自上海MedChem Express公司;MTT购自北京索莱宝公司;胎牛血清(fetal bovine serum, FBS),DMEM高糖培养基购自美国Gibco公司;si-HIF-1α和阴性对照si-NC序列均购自上海吉玛公司,Lipofectamine 2000购自美国Invitrogen公司;凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;抗HIF-1α购自美国Sigma公司;β-actin单克隆抗体购自美国Bioworld公司;二抗羊抗兔/羊抗鼠购自上海斯信生物科技有限公司;一抗稀释液/二抗稀释液均购自上海碧云天生物有限公司。
1.2 主要仪器LDZX型立式高压蒸汽灭菌锅购自上海申安医疗器械厂;SW-CJ-1型超净工作台购自苏州净化设备有限公司;Heal force型细胞培养箱购自上海力申科学仪器有限公司;CFX型凝胶成像系统购自美国Bio-rad公司;3020-426型多功能酶标仪购自美国Thermo公司;NovoCyte 3008型流式细胞仪购自美国艾森生物有限公司。
1.3 方法
1.3.1构建耐药细胞 将MCF-7细胞培养于37 ℃,5 % CO2的培养箱中,细胞传代贴壁后加处理因素。MCF-7/TR通过浓度梯度法诱导获得,将4-OHT浓度从1 μmol/L逐渐提高到5 μmol/L,筛选6个月,待细胞生长稳定后,通过给予MCF-7和MCF-7/TR细胞不同浓度4-OHT(0.625、1.25、2.5、5、10、20、40、80 μmol/L)作用24 h后,用MTT法检测细胞的耐药性。后配制含5 μmol/L的4-OHT和10 %胎牛血清的DMEM培养基常规培养耐药细胞以继续维持其耐药性。耐药指数(resistance index, RI)=IC50(MCF-7/TR)/IC50(MCF-7)。
1.3.2MTT法检测细胞存活率 将乳腺癌MCF-7亲本细胞或MCF-7/TR细胞分别接种于不同96孔板内(1×104个/孔),培养24 h后,分别给予不同组MCF-7/TR细胞4-OHT(5、10、20 μmol/L)联合LW6(15 μmol/L)作用24 h、FG-4592(25 μmol/L)联合不同浓度4-OHT(5、10、20 μmol/L)作用24 h以及给予沉默HIF-1α蛋白MCF-7/TR细胞不同浓度4-OHT(5、10、20 μmol/L)作用24 h后,加入20 μl/孔的MTT孵育4 h,于酶标仪波长490 nm处测吸光度值,计算各浓度药物下的抑制率(inhibition rate, IR),并绘制细胞生长抑制曲线,实验重复3次,每组设置5个复孔。IR=[(对照组OD值-给药组OD值)/对照组OD值]×100 %。
1.3.3Western blot法检测蛋白表达 将药物处理24 h后的MCF-7/TR或MCF-7细胞用RIPA裂解液加蛋白酶抑制剂裂解细胞20 min后收集上清液,采用BCA蛋白含量检测试剂盒测定各组蛋白浓度并按照40 μg共20 μl上样各组蛋白进行电泳、转膜、封闭。封闭完成后按照抗体说明书稀释一抗,4 ℃孵育过夜,恢复至室温后加入TBST洗涤3次,每次10 min。加入二抗室温孵育90 min后再次洗膜,曝光,采用自动凝胶成像系统(Bio-Rad)进行成像,所得数据使用Image Lab分析软件进行One-way ANOVA分析。
1.3.4siRNA实验探讨HIF-1α蛋白对MCF-7/TR细胞耐药的影响 将对数生长期的MCF-7/TR细胞接种于6孔板中,培养至融合率达到50%~60%,根据转染说明书,使用Lipofectamine 2000试剂进行转染,si-HIF-1α和si-NC的转染浓度为0.1μmol/L。细胞转染6 h后,采用含有10% FBS的DMEM高糖培养基换液,继续培养48 h,提取总蛋白进行敲除效果验证。细胞抑制率实验在转染48 h后给予不同浓度4-OHT(5、10、20 μmol/L)作用24 h后进行细胞存活率检测。
1.3.5流式细胞术检测细胞凋亡率 用不含EDTA的胰酶消化各给药组细胞,收集细胞悬液,2 000 r/min离心5 min后弃去上清液,用1×PBS缓冲液洗涤细胞2次,再以2 000 r/min离心5 min收集细胞,按照Annexin V-FITC/PI试剂盒说明书加入500 μl Binding Buffer悬浮细胞,先加入5 μl AnnexinV-FITC 混匀后,再加入5 μl PI溶液,在室温条件下避光反应 15 min后上流式细胞仪检测。

2 结果
2.1 构建乳腺癌TAM耐药细胞系MCF-7/TR给予MCF-7和MCF-7/TR细胞不同浓度4-OHT(0.625、1.25、2.5、5、10、20、40、80 μmol/L)作用24 h后,MTT法检测4-OHT对MCF-7/TR细胞和MCF-7亲本细胞的生长抑制作用。结果显示,与MCF-7细胞相比,MCF-7/TR细胞对4-OHT的抵抗性增强(P<0.05),其RI值为(5.56±0.80)(图1)。
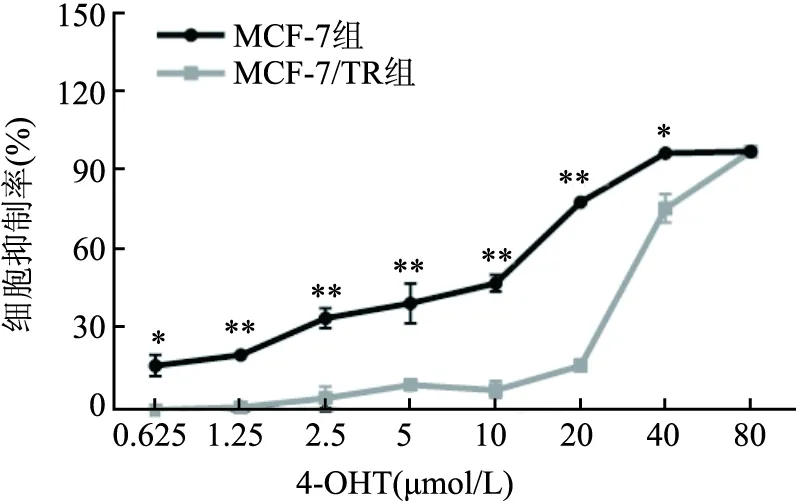
图1 4-OHT对MCF-7和MCF-7/TR 细胞的生长抑制影响与MCF-7/TR组比较:*P<0.05,**P<0.01
2.2 HIF-1α表达与乳腺癌细胞MCF-7他莫昔芬耐药之间的关系按照实验分组(MCF-7,MCF-7+4-OHT,MCF-7/TR,MCF-7/TR+4-OHT)分别给予MCF-7和MCF-7/TR细胞4-OHT(1 μmol/L)作用24 h。Western blot结果显示,与未给药处理的亲本细胞MCF-7相比,MCF-7/TR细胞中HIF-1α蛋白表达上调(F=13.46,P<0.05);与未处理组 MCF-7/TR细胞比较,低剂量的4-OHT可上调MCF-7/TR细胞中HIF-1α蛋白的表达(F=12.54,P<0.05)(图2),提示乳腺癌TAM耐药可能与HIF-1α表达上调有关。
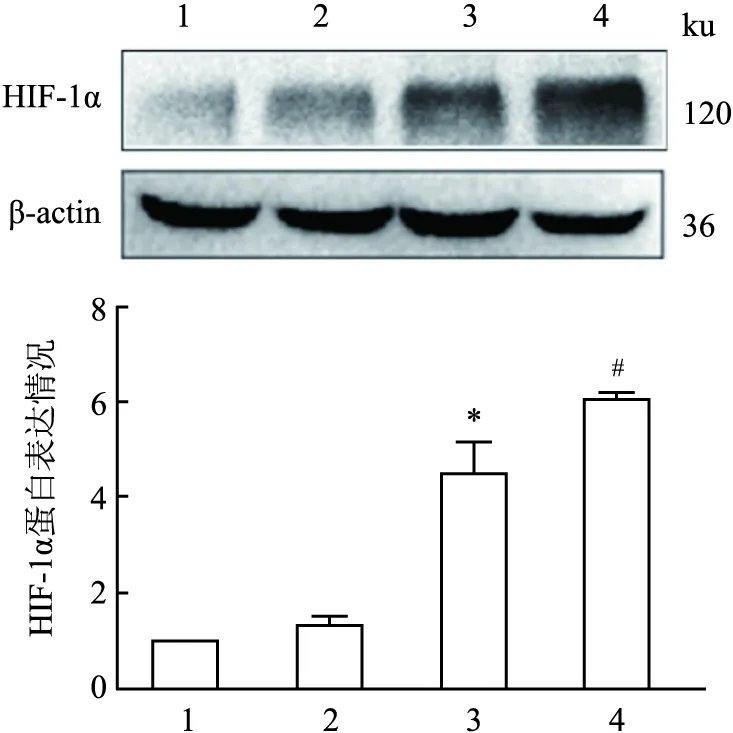
图2 MCF-7和MCF-7/TR 细胞中HIF-1α的表达情况
2.3 HIF-1α抑制剂LW6对MCF-7/TR耐药细胞的影响Western blot结果显示,与空白对照组(Control组)比较,给予MCF-7/TR细胞LW6(15 μmol/L)作用后,HIF-1α蛋白表达减少(F=20.76,P<0.05)(图3A);MTT结果显示,在给予MCF-7/TR细胞不同浓度4-OHT(5、10、20 μmol/L)联合LW6(15 μmol/L)处理后,LW6可提高4-OHT对MCF-7/TR的抑制率,LW6+5 μmol/L 4-OHT(F=12.51,P<0.05)、LW6+10 μmol/L 4-OHT(F=48.07,P<0.01)、LW6+20 μmol/L 4-OHT(F=31.71,P<0.01)(图3B);流式细胞术检测结果显示,与单用4-OHT(5 μmol/L)组相比,LW6(15 μmol/L)联合4-OHT(5 μmol/L)组细胞凋亡率增加(F=15.49,P<0.05)(图3C),结果提示抑制HIF-1α可增加乳腺癌TAM耐药细胞MCF-7/TR的化疗敏感性。
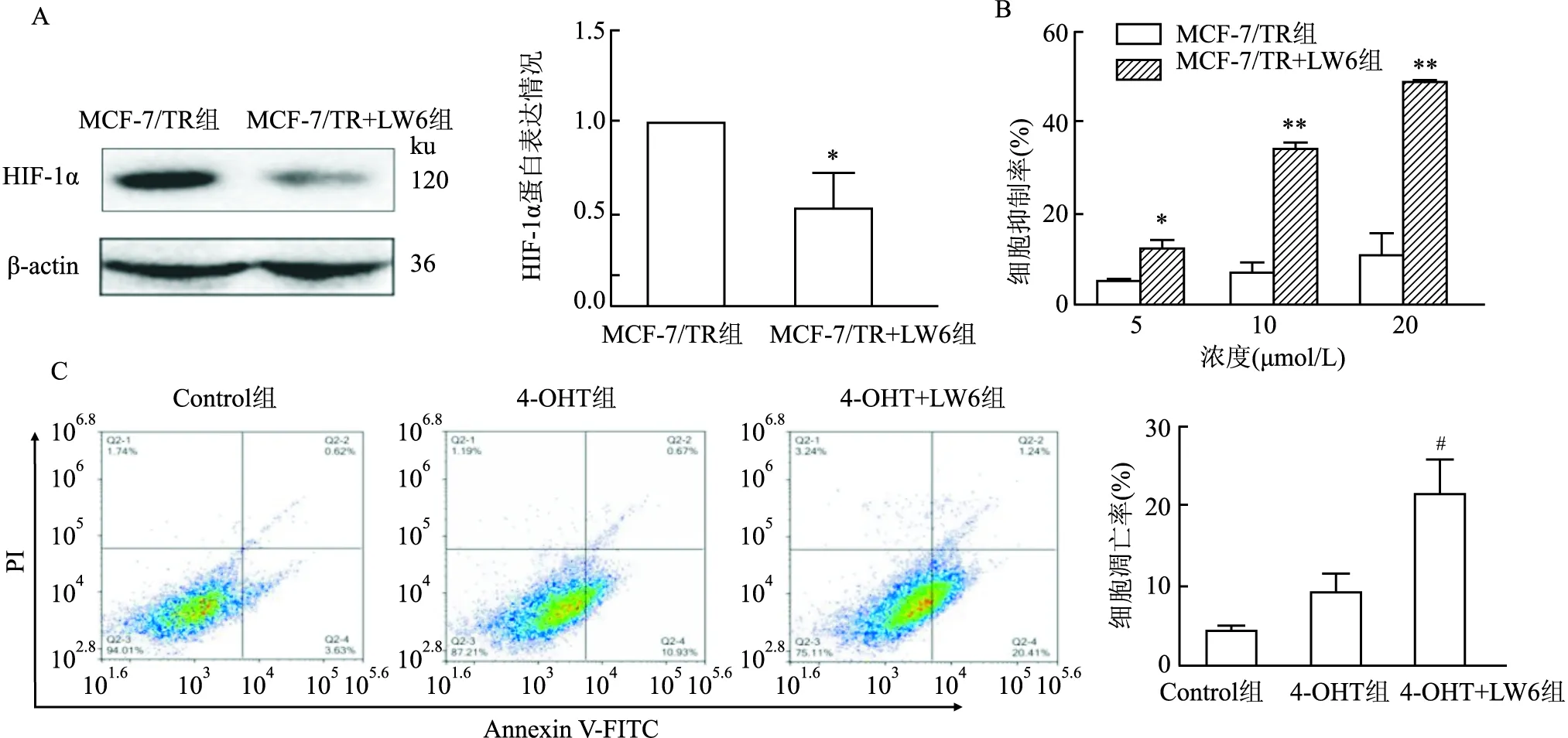
图3 HIF-1α抑制剂LW6对MCF-7/TR细胞的影响
2.4 沉默HIF-1α蛋白对MCF-7/TR细胞对4-OHT的敏感性的影响Western blot实验结果显示,与si-NC组比较,si-HIF-1α能有效敲除MCF-7/TR细胞中HIF-1α蛋白(F=56.04,P<0.01)(图4A);MTT结果显示,与空白对照组比较(si-NC),沉默HIF-1α可增强不同浓度4-OHT(5、10、20 μmol/L)对MCF-7/TR细胞的生长抑制作用,si-HIF-1α+5 μmol/L 4-OHT(F=45.86,P<0.01)、si-HIF-1α+10 μmol/L 4-OHT(F=37.86,P<0.01)、si-HIF-1α+20 μmol/L 4-OHT(F=36.61,P<0.01)(图4B);流式细胞术检测结果显示,与si-NC+4-OHT(5 μmol/L)相比,si-HIF-1α可增强4-OHT对MCF-7/TR细胞的抑制作用,细胞凋亡率增加(F=12.99,P<0.05)(图4C),结果表明HIF-1α是促进乳腺癌TAM细胞MCF-7/TR耐药的重要途径。
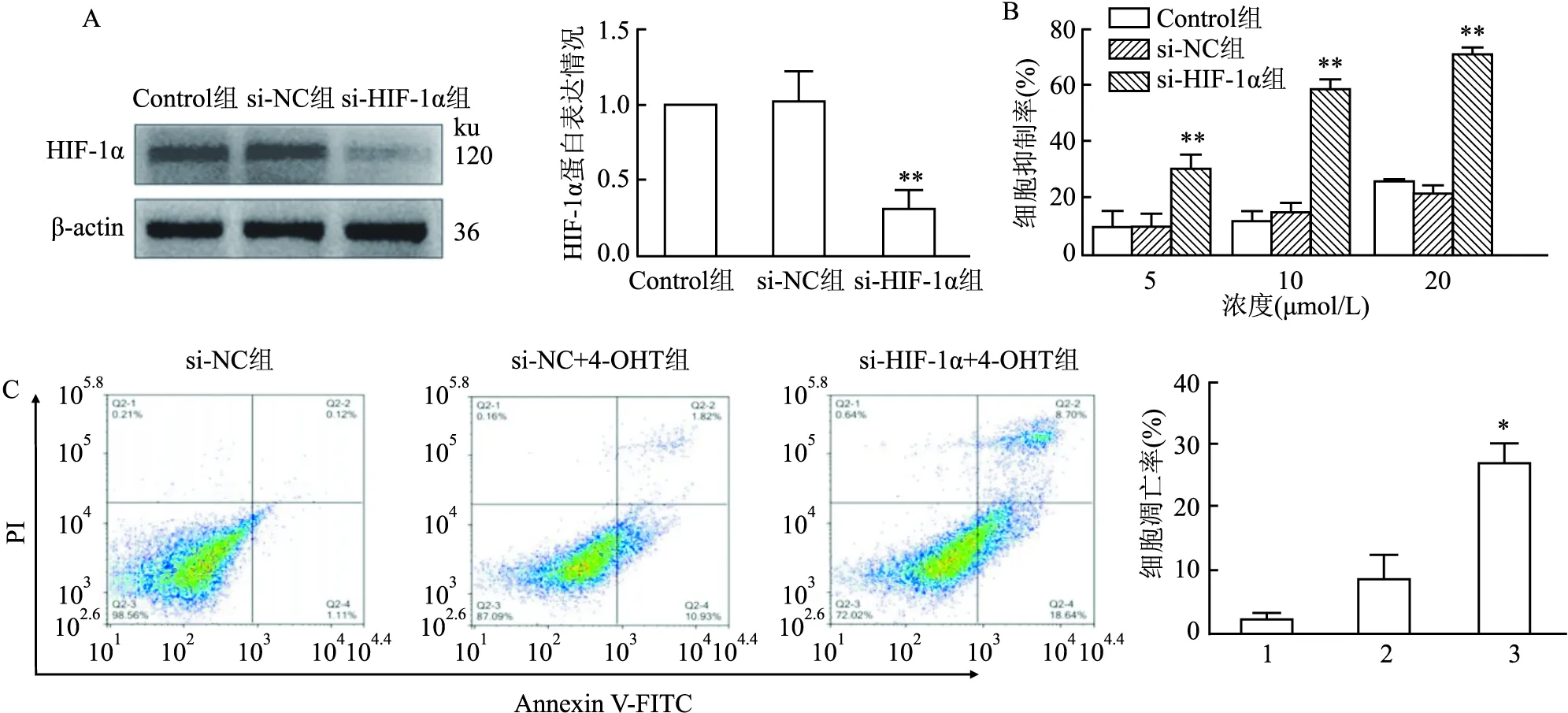
图4 沉默HIF-1α对MCF-7/TR细胞的影响
2.5 HIF-1α稳定剂FG-4592对4-OHT抑制MCF-7细胞生长的影响Western blot结果显示,与空白对照组相比,FG-4592(25 μmol/L)可上调MCF-7细胞中HIF-1α蛋白表达(F=16.76,P<0.05)(图5A);MTT结果显示,与单独使用4-OHT相比,FG-4592(25 μmol/L)联合不同浓度4-OHT(5、10、20 μmol/L)可降低4-OHT对MCF-7细胞的抑制率,FG-4592+5 μmol/L 4-OHT(F=10.49,P<0.05)、FG-4592+10 μmol/L 4-OHT(F=41.59,P<0.01)、FG-4592+20 μmol/L 4-OHT(F=105.80,P<0.05)(图5B);流式细胞术检测结果显示,与单用4-OHT(5 μmol/L)组相比,4-OHT(5 μmol/L)+FG-4592(15 μmol/L)组细胞凋亡率降低(F=16.35,P<0.05)(图5C)。
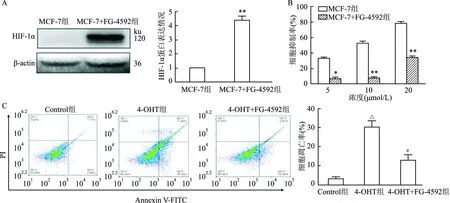
图5 HIF-1α稳定剂FG-4592对MCF-7细胞的影响
3 讨论
乳腺癌为激素依赖性肿瘤,研究显示雌激素可刺激乳腺癌细胞的生长和增殖,在乳腺癌的发生、发展及侵袭、转移中发挥重要作用[5]。目前,临床主要应用手术、放射治疗、全身治疗和辅助内分泌治疗等方式对乳腺癌患者进行治疗,其中,内分泌治疗是ER阳性乳腺癌的重要治疗方式,临床应用中显示其具有低毒、预后效果和耐受性好等特点。但在内分泌治疗过程中,其疗效因耐药性而受到了限制。研究[6]显示,最初对TAM治疗有反应的ER阳性乳腺癌在长期治疗期间敏感性逐渐降低,甚至出现复发和转移,形成继发性耐药,由于TAM耐药性的出现,治疗效果的降低,临床上乳腺癌病死率逐年递增。因此,探讨乳腺癌TAM耐药机制具有重要的研究意义。
TAM耐药的发生与乳腺癌细胞异常代谢激活、ER功能和表达的丧失以及基因表达谱的改变密切相关[7]。近年来研究[8-9]显示TAM的活性形式4-OHT可诱导HK-2蛋白高表达促进MCF-7细胞对4-OHT抵抗,同时研究显示脯氨酰羧肽酶(PRCP)活性的增加也介导了4-OHT的耐药过程,但是其确切的耐药机制仍需探索。既往研究[10]表明,HIF-1α在肿瘤细胞中的水平升高与病死率、癌症进展和抵抗治疗有关,且其表达与ERα阳性乳腺癌患者内分泌治疗耐药呈正相关[11]。HIF-1α在常氧条件下会被脯氨酸羟化酶(PHD)羟基化,再被VHL肿瘤抑制蛋白复合物识别后通过泛素蛋白酶途径降解[12]。而在乳腺癌耐药细胞中,即使是常氧条件,HIF-1α也呈现高表达[13],而HIF-1α是否影响耐药细胞对4-OHT敏感性仍不清楚。为了探讨HIF-1α与乳腺癌MCF-7细胞4-OHT耐药之间是否存在联系,该研究采用免疫印迹分析MCF-7/TR细胞及其亲本细胞中HIF-1α的表达水平,研究表明HIF-1α在MCF-7/TR细胞中高表达,而在亲本细胞中几乎不表达。在给予低剂量的4-OHT作用后,MCF-7/TR细胞中HIF-1α水平进一步增加,这提示HIF-1α可能参与乳腺癌细胞对4-OHT的耐药过程中。目前已有研究[14]表明抑制HIF-1α表达可体外抑制乳腺癌耐药蛋白并增加肿瘤细胞的化学敏感性。为了验证这一结论,该研究向MCF-7/TR细胞中加入HIF-1α抑制剂、MCF-7细胞中加入HIF-1α稳定剂,同时采用小分子siRNA干扰技术和流式细胞术探讨4-OHT对MCF-7/TR细胞影响。结果显示,在敲除HIF-1α蛋白或者加入HIF-1α抑制剂后,4-OHT对MCF-7/TR生长抑制作用增强,细胞凋亡率增加;而在MCF-7细胞中加入稳定剂FG-4592后,4-OHT对MCF-7生长抑制作用减弱,细胞凋亡率降低。
综上所述,该研究表明HIF-1α在4-OHT耐药乳腺癌MCF-7/TR细胞中具有重要作用,抑制HIF-1α表达可增加MCF-7/TR细胞对4-OHT的敏感性,因此,HIF-1α有望成为乳腺癌TAM耐药治疗的新靶点。但是,该研究对于HIF-1α调控乳腺癌4-OHT耐药的详细机制尚未阐明,还需进一步研究。
