甘草苷对刀豆蛋白A诱导的实验性肝损伤的保护作用及机制
2022-07-13文怡欣鄂志野鞠宝玲张红军
文怡欣,鄂志野,张 珊,聂 影,鞠宝玲,张红军
(牡丹江医学院免疫学教研室,黑龙江 牡丹江 157011)
中国是病毒性肝炎等慢性肝病的高发地区,肝纤维化是慢性肝脏炎症反应的组织修复过程,持续进展可以发展为肝硬化,甚至肝癌[1],因此寻找有效的抑制慢性肝损伤及抗肝纤维化的药物及其活性成分具有重要意义。在慢性肝脏疾病的治疗过程中,中医药发挥着重要作用。甘草是我国应用最广泛的中草药之一[2],具有多种药理作用,Liq是甘草中提取的黄酮类活性成分,具有抗炎、抗氧化应激、免疫调节及抗癌等作用。对于治疗抑郁症、糖尿病、胃癌以及肝癌都有作用[3]。因此,本研究拟通过ConA建立与病毒性肝炎发病机制最为接近的免疫性肝损伤实验动物模型,探讨Liq对实验性肝损伤是否具有保护作用及可能作用机制,为Liq的临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验试剂 ConA购自Sigma公司(美国);Liq购自成都瑞芬思生物公司;TRIZOL试剂购自Appied biosystem技术有限公司(美国);qRT-PCR反应试剂盒购自Roche公司(中国);HE染色试剂购自Leagene Biotechology公司(中国);Masson染色试剂盒购自索莱宝科技有限公司(中国)。
1.1.2 实验仪器 包埋机、旋转式切片机、烘片机(德国Leica)、NanoDrop2000微量RNA浓度分析仪(美国ThermoFisher)、3K15低温高速离心机(美国Sigma公司)、XH-D漩涡混合器(中国(上海)、生物显微镜(德国Leica)、7500荧光定量PCR仪(美国Bio-Rad)。
1.2 方法
1.2.1 实验动物分组及给药处理 SPF级ICR小鼠雌雄各半,8~10周龄,体重18~22 g,由牡丹江医学院医药研究中心提供。所有小鼠喂养于牡丹江医学院医药研究中心动物房[SYXK(黑)2019-006],生活在(24±2)℃,12 h昼夜节律的环境中,自由进食进水。本研究已获得牡丹江医学院动物伦理委员会批准。将32只ICR小鼠雌雄各半随机分为四组,每组8只分别为对照组、ConA模型组、药物中剂量(ConA+Liq 40 mg/kg)、药物治疗高剂量(ConA+Liq 80 mg/kg)。模型组及药物治疗组通过小鼠尾静脉注射ConA 10 mg/kg体重,1次/7 d,连续6次[4];对照组小鼠尾静脉注射等量生理盐水,1次/7 d,连续6次;第28天开始药物中剂量组给予Liq 40 mg/kg体重、药物治疗高剂量组给予Liq 80 mg/kg体重灌胃[5],1次/d,连续14 d;对照组及模型组小鼠给予等体积生理盐水灌胃,1次/d,连续14 d;第42天各组小鼠经摘眼球取血分离血清用于血清酶学检测;经脊髓离断处死,获得肝组织与脾脏组织。一部分肝脏组织存放于-80 ℃超低温冰箱用于qRT-PCR检测,剩余部分存放于4%多聚甲醛中固定用于组织学检测。
1.2.2 血清酶学检测 分离的血清用于检测ALT、AST的含量,采用牡丹江医学院红旗医院检验科迈瑞BS-2000全自动生化分析仪,检测步骤按制造厂商提供的说明书操作。
1.2.3 HE染色 将固定的实验肝脏组织进行脱水、浸蜡、包埋,切成4~5 μm厚的切片,常规脱蜡、复水,按照标准步骤进行苏木素-伊红染色,显微镜下观察组织病理情况。
1.2.4 MASSON染色 石蜡切片放入烘箱,随后放入二甲苯中(脱蜡),然后依次浸梯度酒精里3 min,随后用蒸馏水轻轻洗2 min,再按照MASSON染色试剂盒说明书步骤进行染色,随后用梯度酒精快速脱水,用二甲苯透明,最后用中性树胶进行封片,在显微镜下进行观察。 通过Image J 分析软件计算胶原纤维面积(%)=胶原纤维面积/总面积
1.2.5 qRT-PCR 在冰盒上进行肝脏组织的研磨,采用传统的TRIzol试剂方法提取肝脏组织中的总RNA,超微量核酸检测仪对总RNA的浓度进行检测。采用用罗氏逆转录试剂盒进行逆转成cDNA,根据说明书进行操作。采用SYBRGREEN进行荧光定量表达目的基因的mRNA,反应体系根据说明书配置成20 μL反应液,并将GAPDH扩增作为内参基因,用循环数阈值表达水平,采用2-△△CT法分析。引物序列见表1。

表1 qRT-PCR引物
1.3 统计学分析计量资料均采用“均数±标准差”表示,多组间差异的比较采用GraphPad Prism 8.0.2软件进行单因素方差分析确定,P<0.05表示差异有统计学意义。
2 结果
2.1 Liq可改善实验性肝损伤
2.1.1 血清酶学检测结果 与对照组相比,ConA模型组的AST以及ALT明显增加(P<0.05),与ConA模型组相比,药物治疗组中剂量组以及高剂量组的AST以及ALT的水平显著降低(P<0.05),见表2。
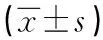
表2 各组小鼠血清ALT、AST水平变化
2.1.2 组织病理学检测结果 对照组小鼠的肝脏表面光滑细腻,红润,质地柔软,无出血点等。ConA模型组小鼠的肝脏肉眼可见表面颗粒状,可见点状出血点,并且颜色瘀红,质地较硬。药物治疗组可见组织大体上可见颜色以及质地有所改善,颗粒状出血点减轻等,见图1A。HE染色可见对照组小鼠的组织切片染色可见中肝小叶结构完整、肝细胞形态完整,细胞核形态均正常。ConA模型组小鼠肝组织切片染色可见肝脏小叶结构破坏,有大片组织坏死,细胞肿胀,伴有脂肪变性和胞质空洞化等。中剂量治疗组以及高剂量治疗组中分别小鼠的肝脏组织可见明显的好转,见图1B,坏死面积明显有所改善,细胞形态和结构均有好转。MASSON染色中胶原纤维表现为蓝色,对照组小鼠肝脏组织中未见蓝色胶原纤维表达,ConA模型组小鼠的胶原表达量增高,中剂量组与高剂量组小鼠肝脏组织的胶原表达量胶原表达量降低(P<0.05),见图1C,表3。从以上肝脏组织标本以及HE染色和MASSON染色分析观察可得Liq能够改善实验性肝损伤。

图1 实验动物肝脏组织病理学表现
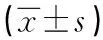
表3 各组小鼠肝脏组织胶原纤维表达量
2.2 Liq对ConA诱导的HSC活化的影响与对照组相比,ConA模型组肝脏组织col1a1、α-SMA的mRNA表达水平显著增高(P<0.05),这表示ConA诱导的慢性实验性肝损伤过程中存在HSC的活化。与ConA模型组比较,药物治疗中剂量组和药物治疗高剂量组肝脏组织col1a1及α-SMA的mRNA表达水平明显降低(P<0.05),这提示Liq可能通过抑制HSC活化来减缓实验性肝损伤,见表4。
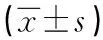
表4 各组小鼠Col1a1、α-SMA表达情况
2.3 Liq对ActivinA/Smad通路的影响与正常对照组相比,ConA模型组当中ActivinA、ACVR2A、smad2mRNA表达水平显著增高(P<0.05),这表明ActivinA信号传导通路参与了ConA诱导的实验性肝损伤过程。与ConA模型组相比,ActivinA、ACVR2A和smad2在药物治疗中剂量组以及药物治疗高剂量组当中的表达明显下调(P<0.05),这表明Liq可通过调节ActivinA/smad通路来缓解实验性肝损伤,见表5。
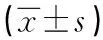
表5 各组小鼠Activina、ACVR2A、Smad2表达情况
3 讨论
慢性肝损伤持续进展可发展为肝纤维化[6],是肝硬化、肝衰竭、甚至肝癌的潜在因素,因此迫切的需要寻找一种安全有效、毒副作用小的药物来进行干预。目前西药治疗仅限于一种蛋白和一个靶点上进行,且副作用大,长期用药会逐渐依从性降低,影响治疗疗效。而中药治疗疾病主要是通过多靶点、多途径来进行的[7],并且具有安全副作用小、来源广泛等多种优点。因此用中药来治疗疾病已成为当前热门研究领域。Liq主来源于甘草[8],是甘草中提取出来的一种黄酮类活性成分,有研究表明,Liq具有抗癌作用、抗抑郁、抗炎及免疫调节等多种作用。
ConA是一种植物凝集素[9],ConA诱导的实验性肝损伤的发病机制主要是引起肝脏中的T细胞的活化与募集,联合天然免疫以及适应性免疫产生多种效应性细胞以及分子,引起肝组织内大量炎性细胞浸润并伴随着肝脏组织损伤及坏死。本研究显示ConA连续给药处理后,实验动物血清ALT、AST水平明显升高,肝脏组织肉眼可见表面粗糙并伴有点状出血,组织切片染色可见肝脏结构破坏,小叶结构消失,细胞肿胀,胞质空泡化及脂肪变性,伴有大面积组织坏死及炎性细胞浸润,通过MASSON染色可见ConA模型组肝脏组织胶原含量增加,以上说明本研究成功建立肝损伤模型。Liq连续灌胃给药两周后,从血清ALT、AST水平到组织病理改变,实验动物肝脏损伤程度明显减轻,说明Liq对ConA诱导的肝损伤具有改善及治疗功效。
在正常生理情况下,肝脏具有能分泌胆汁,参与食物的消化以及物质代谢、解毒防御等功能。在肝脏受到来自各种因素慢性损伤后,肝纤维化是慢性损伤进展的重要病理过程[10],形成机制主要由于HSC的活化产生大量细胞外基质和胶原沉积,破坏正常肝脏结构,导致肝脏功能异常。col1a1和α-SMA是HSC活化的重要指标,本研究表明,在ConA模型组肝脏组织中col1a1和α-SMA的mRNA表达水平明显升高,而在给予Liq药物治疗后,其col1a1和α-SMA的mRNA表达水平明显下降。这表明Liq可通过抑制HSC活化来缓解肝损伤。
HSC活化受多种细胞信号的调控,我们前期研究中发现,ActivinA在实验性性肝损伤模型动物肝脏组织中高表达[11],具可诱导HSC活化,抑制肝细胞的增殖,诱导肝细胞凋亡等作用,是重要的致纤维化因子。本研究表明,在给与ConA刺激后实验动物肝脏组织ActivinA、ACVR2A以及其相关下游信号蛋白Smad2的mRNA表达水平明显升高,Liq给药后ActivinA、ACVR2A以及Smad2的mRNA表达水平明显下降,与ConA模型组比较差异显著,这表明Liq可能通过调控ActivinA/Smad信号通路,发挥其保肝作用。
综上所述,Liq具有缓解肝损伤作用,其作用机制可能是通过其抑制HSC活化以及调控ActivinA/Smad信号通路来发挥其保肝作用。
