澳大利亚卫生技术评估及决策转化的分析和借鉴
2022-07-12刘蔼霞
张 秋 刘蔼霞
卫生技术评估(health technology assessment, HTA)是一种对于卫生技术的性质、效用和结果进行系统性评估的方法。随着我国老龄化趋势的加重和疾病谱的改变,社会对健康的刚性需求逐渐增加[1]。《2019年我国卫生健康事业发展统计公报》显示,我国医疗卫生总费用逐年攀升,国内生产总值(GDP)比重增长6.6%,个人卫生费用负担依然很重。《2021年国家医疗质量安全改进目标》中也提出要持续提升医疗质量安全管理科学化和精细化水平,保障医疗安全,把为人民群众提供安全、优质的医疗服务作为卫生健康工作的核心任务。所以随着医疗新技术和新药不断出现,医疗资源的合理优化配置和利用成为未来新医改的关键。
由于医疗领域科学决策的需求,HTA在我国的重要性日益凸显[2]。我国于20世纪80年代引入HTA。2009—2016年我国卫生部和英国国家卫生与服务优化研究院开展多项HTA建设合作。为了更好地发挥HTA的决策作用,2018年举办了首届中国卫生技术评估大会并设立国家药物与卫生技术综合评估中心。2019年我国进一步提出采用HTA科学开展药品临床综合评价。经过多年的发展,HTA呈现出快速发展趋势,但我国在HTA的评估流程设计及政策转化方面仍存在不足,有待进一步的优化。
澳大利亚是最早运用HTA制定医疗卫生领域决策的典型国家之一,尤其是在药品准入审核方面[3]。澳大利亚充分利用HTA进行决策,凭借干预措施,以确保纳税人的资金,实现以相对最少的医疗卫生成本获得相对最大的健康状况改善结果。在澳大利亚,运用HTA研究成果来通过上市决策的公共和私人资助计划包括:药物福利计划(pharmaceutical benefits scheme, PBS)、国家免疫计划(national immunization program, NIP)、医疗保险福利计划(the medicare benefits schedule, MBS)、假肢列表和国家血液协议,这些计划目录的增加均通过HTA来实现。
目前,澳大利亚联邦层面最权威的两个独立评估机构为药物福利咨询委员会(Pharmaceutical Benefits Advisory Committee, PBAC)和医疗服务咨询委员会(Medical Services Advisory Committee, MSAC)。PBAC是世界上第一个法定的专门开展药品报销目录评价和遴选的国家机构。因而研究澳大利亚HTA体系及机制,对我国现阶段正趋于逐步完善的HTA机制有一定的参考意义和价值。
1 澳大利亚HTA体系
1.1 澳大利亚HTA流程介绍
治疗用品管理局(the Therapeutic Goods Adminis- tration, TGA)、MSAC、PBAC和假肢清单咨询委员会(the Prostheses List Advisory Committee, PLAC)分别执行HTA程序,向澳大利亚政府卫生部提供咨询意见。HTA流程对于支持补贴医疗技术的可持续管理至关重要。澳大利亚政府通过多样化的卫生资金安排,如最典型的公共卫生补贴——PBS和MBS,以及私人医疗保险中的假肢名单,为与健康有关的产品和服务的成本价格提供补贴,资助澳大利亚人获得必要的医疗服务和技术。澳大利亚政府通过明确细化的HTA实施流程以及切实的研究成果来巩固利益相关者对HTA决策的信心。
在澳大利亚,各HTA机构主要通过如下两种方式来参与政府HTA决策:第1种方式:卫生技术通过澳大利亚治疗用品注册处(Australian Register of Therapeutic Goods, ARTG)批准上市前,在市场监管下评估其安全性和有效性。通过评估来确保卫生技术的安全及使用效果,并使用适当的质量控制办法进行生产。第2种方式:评估卫生技术的相对安全性、临床效果和成本-效益,基于此决定是否通过MBS、PBS和NIP分别为医疗服务(有或没有设备)、程序和诊断技术、药品和疫苗提供公共资金;是否在私人医疗保险中通过假肢列表补偿假肢装置;以及是否对卫生保健干预措施进行后市场监督,通告还处在上市批准阶段的卫生技术的上市决定或那些被证明不安全或使用效果不如预期的卫生技术的偿付情况。澳大利亚现行的HTA批准上市和补偿流程如图1。
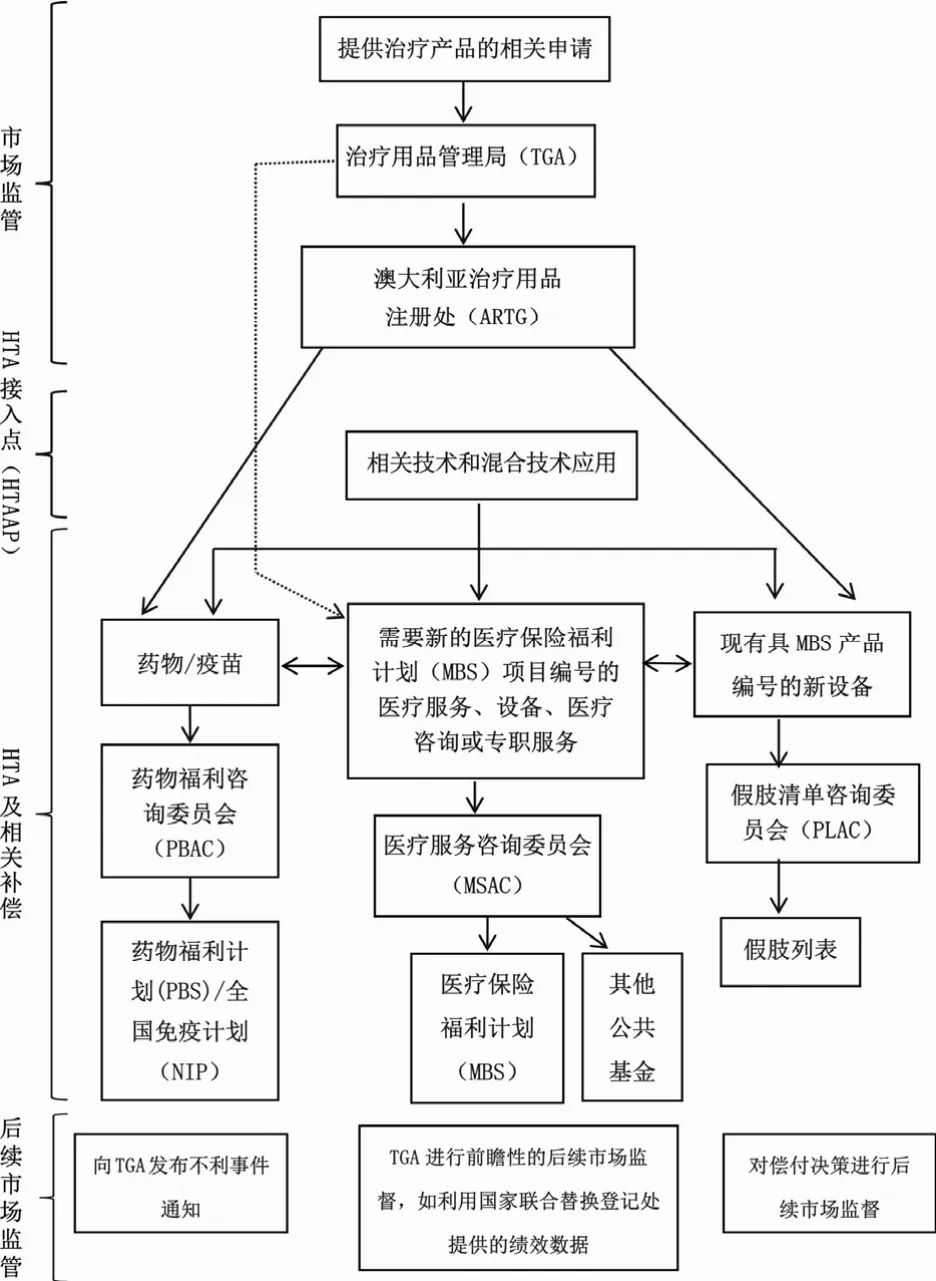
图1 澳大利亚现行HTA批准上市和补偿流程[4]
澳大利亚HTA流程大概分为3部分:第一部分是市场监管,表示卫生技术的相关申请必须提交给TGA,以便批准进入ARTG。第2部分是HTA及其补偿流程,图中显示了各种评估途径。对于药物或疫苗,可以向PBAC申请,如果成功,新项目将被纳入PBS或NIP;对于需要新的MBS项目编号的医疗服务或设备,需要向MSAC提出申请,如果成功,新服务将包含在MBS中;对于需要新的MBS项目编号的医疗咨询或专职服务,需要向MBS质量框架提出申请,如果成功,新服务将包含在MBS中;对于现有具有MBS产品编号的新设备,需要向假肢名单咨询委员会(Prostheses List Advisory Committee, PLAC)提出申请,如果成功将在假肢列表中列出。图中的HTA接入点(HTA assess point, HTAAP)管理相关技术和混合技术应用,这些技术需要由多个委员会考虑决定。第3部分后续市场监督,新的卫生技术上市后,TGA可能会收到一些不利事件,此时TGA便发挥其后续市场监管的作用。例如利用国家联合替换登记处提供的绩效数据,以及通过MBS质量框架对偿付决策进行后续监督。
1.2 澳大利亚HTA重要机构PBAC
TGA、MSAC、PBAC和PLAC分别执行HTA程序,向澳大利亚政府卫生部提供咨询意见。每个机构功能独立,可响应不同的政策需求,相互间联系紧密。
成立于1953年的PBAC是世界上第一个依法成立的专门开展药品报销目录评价和遴选的国家机构[5]。本文将重点对澳大利亚的PBAC进行介绍。
PBAC是由澳大利亚政府设立的独立专家机构。其委员会由21名独立专家组成,包括医生、卫生专业人员、卫生经济学家和消费者代表,他们被要求签署并遵循严格的利益冲突声明条款。PBAC下设药物利用小组委员会(Drug Utilization Sub Committee, DUSC)、经济小组委员会(Economics Sub Committee, ESC),协助分析和提供不同领域的建议。
PBAC的主要作用是推荐在PBS上市的新药。PBAC每年举行3次会议,除非PBAC提出积极的建议,否则PBS目录不能列出新药。在推荐目录药物时,PBAC会考虑澳大利亚注册使用该药物的医疗条件及临床有效性、安全性和成本-效益与其他治疗的比较。
PBAC的评审流程主要分为4个步骤:第1步,向TGA提交申请;第2步,PBAC评审材料交DUSC和ESC审核;第3步,PBAC提出建议;第4步,价格谈判;第5步,卫生部决定是否列入PBS目录及谈判价格确定。具体流程见图2。

图2 澳大利亚PBAC评审流程[6]
2 澳大利亚HTA成果的政策转化
澳大利亚强调利用HTA对PBS、NIP及MBS做出相关决策。三者的实施不仅有效遏制全民医疗费用的不合理增加,而且进一步完善了澳大利亚的医疗卫生体系。
2.1 PBS
PBS于1948年设立,为退休人员提供免费药品,并为社区群众免费提供139种“救命和预防疾病”药品。据澳大利亚卫生部最新发布的《卫生部2019—2020年年度报告》数据显示,多于160万澳大利亚 人可使用免费或打折PBS药物。同时,政府将补贴大部分医疗条件下的药品费用。
PBS的药品目录每季度出版一次。政府对PBS药品目录中每种药物的价格进行管理。随着需求的增加和新药的加入,PBS的整体成本会增加。当一个药品的预算超过一定的数额时需要国会参与讨论。政府通过制定若干战略确保PBS仍然为社区提供负担得起的必要药品,并帮助维持制药企业的正常运营。在PBS目录以外的处方药市场份额非常小,因此尽管目录中的药品价格会被PBS管制,制药企业仍愿意努力将其生产和销售的药品列入PBS目录[7]。
2.2 MBS
作为澳大利亚政府补贴的医疗保险服务的清单,MBS为所有澳大利亚居民和某些类别的澳大利亚游客提供获得医疗和医院服务的机会。公共服务部管理医疗保险福利的支付。
MSAC的评估重点是在诊断技术、医疗服务或设备的安全性、有效性和经济性上,被通过的MSAC报告最终会以MBS的形式公布出来,MBS对HTA的应用正是通过MSAC来实现。
2.3 NIP
免疫接种是有史以来最成功、最具成本-效益的健康干预措施之一[8]。NIP由澳大利亚联邦和州及地区政府于1997年设立。NIP是一项包括各级政府(澳大利亚、州、领地)、医疗保健提供者、管理人员和研究人员的合作方案。2018年澳大利亚发布了《2019—2024国家免疫战略》,旨在扩大和改进国家的免疫规划,最大限度地提高各年龄段公民的免疫覆盖率以预防疾病。
目前的预防接种规划包括一份按年龄组别和/或医疗风险划分的推荐疫苗表,根据年龄组别和风险向澳大利亚人士免费提供。根据NIP获得免费疫苗的资格与享受医疗保险福利的资格有关。澳大利亚实施全民医保制度。据经合组织数据显示,2019年澳大利亚政府/社会健康保险总保健覆盖率估值达100%,私人医疗保险覆盖率达53.6%。
由于澳大利亚规定所有申请加入PBS目录的药品或加入NIP的疫苗都必须经由PBAC评审,因此药品在ARTG注册成功之后需要通过PBAC的评审才能最终进入PBS目录。
澳大利亚目前正在推行COVID-19免疫接种计划,每个澳大利亚人都将获得接种COVID-19疫苗的资格。但在疫苗提供给澳大利亚人之前,必须得到监管和澳大利亚所有疫苗、药品和其他医疗用品管理局(TGA)的批准。COVID-19疫苗的供应批准须遵守严格的条件,例如阿斯利康的临时批准有效期为两年,期间要求阿斯利康继续向TGA提供有关正在进行的临床试验和上市后评估的长期有效性和安全性信息。所有注册疫苗均由TGA密切监测及负责应对任何安全问题。澳大利亚国内目前有阿斯利康和辉瑞的COVID-19疫苗获准使用:辉瑞疫苗主要用于16岁及以上人群,阿斯利康用于18岁及以上人群。截至2021年3月29日数据,已有541 761澳大利亚人接种了COVID-19疫苗。
3 借鉴
3.1 设置职能明确的HTA机构
设置职能明确的HTA机构利于评估成果高效率完成政策转化。澳大利亚的HTA机构是由多层次构成的,其中联邦层面最为有名的两个机构即PBAC和MSAC,均为国家级评估机构,负责对合作的大学、专业机构、私人顾问和卫生权威机构部署HTA的具体研究工作。此外,澳大利亚的多数医院还会通过设立治疗委员会开展HTA工作。
在我国,HTA体系由高校、研究所以及一些非附属医院等构成,相较于澳大利亚HTA的研究机构的设置,我国缺乏职能明确的调控机制和管理机构,这使各HTA研究机构相互之间协调起来十分困难。因此我国HTA机构的设置尚待完善,随着这几年HTA在国内被更多地应用,需要有更多专业的、权威的机构建立起来,形成我国的HTA网络。
3.2 加强我国HTA的决策透明性、规范性
澳大利亚的PBAC成员的结构组成利于提高消费者和临床医生等主要利益相关方的接触水平,从而为PBAC的决策过程提供信息。同时,PBAC和MSAC仅提供评估报告和相关的建议,并不最终决定药物或医疗设备是否进入相关国家福利计划中,拥有最终决定权的是卫生部。评估机构独立于政府卫生部门是十分正确的做法,一方面政府对HTA机构进行监督,另一方面,一定程度上减少甚至杜绝了各利益相关方为了自身利益最大化而将实际价值并不高的药品或医疗设备、技术、服务等推向市场,导致资源的不合理配置。过程和结果的透明性和规范性的提高将增加公众对国家卫生体系的信心。
我国不断强调医疗保险的循证决策,国家基本药物工作委员会负责基本药物目录审核[9],同时HTA辅助医保目录的准入决策。但HTA的人员构成、部门协调、工作流程缺乏系统化和规范化。目前,我国基本药物审核仍以官方机构专家掌握主要决策,主观性较强,透明性较差[8]。其导致公众对于医保目录准入和HTA的概念并不了解。我国应积极创新医保药物准入模式,不断加强HTA的公平性、全面性,立足本国国情,广泛动员医学专业人员、经济学专家及患者代表等社会群体的参与。
3.3 完善我国HTA方面的政策法规
HTA是澳大利亚药物定价的基本准则[10]。澳大利亚PBAC的职责是依法为卫生部提供有关药物的效果和经济效益方面的建议和咨询。1993年以后,澳大利亚相关法规规定,一份完整的申报产品的药物经济学分析报告是申请人在提交产品列入药物福利计划报销目录的申请时所必备的。药物经济学报告中需要提供该药与同类药相比的优势及证据并给出具体数据,只有当该种药品的疗效、安全性和成本-效果方面与同类药相比有更优异的表现时才会被纳入PBS目录中得到国家补贴。在澳大利亚,药品的HTA在法律的保障下快速发展。
对照我国,HTA研究成果能成功转化为政策的主要原因是政策需要,大多数的HTA工作以政府的项目委托方式展开,对HTA引入决策过程始终缺乏制度安排,这种零散的作业方式显然无法满足科学决策的要求。其中,HTA强调药物经济性。HTA的药物经济性证据在2017年中国基本医保药品准入谈判工作时被首次引入,HTA的应用提升了药品谈判的相对公平性。近年来,国家层面进一步关注到了HTA应用的经济价值和临床价值,如降低医疗卫生成本,辅助医保政策设立;提高药品疗效、安全性及经济性的临床价值等。2018年,国家发布关于基本药物制度的意见中提出对基本药物目录定期评估、动态调整,优先调入有效性和安全性证据明确、成本-效益比显著的药品品种[11]。我国部分社会机构发布HTA相关的行业性规范指南,中国药学会发布了2020年版《中国药物经济学评价指南》,但由于制定主体缺乏官方性,指南执行力度较弱[12]。我国需要借鉴澳大利亚这方面的成功经验,将HTA纳入到相关法规中,规范质量控制标准。
